8.薬物療法以外の痛み治療法
1
放射線治療
本項は日本放射線腫瘍学会に依頼して作成したものである。
1.がん疼痛治療における放射線治療概論
❶ がん疼痛治療における放射線治療の基本的な考え方
放射線治療は多くのがんに伴う局所の症状の改善に有効な手段である。放射線治療においては,治癒を目的とする「根治的」治療から,術後などに用いられる「予防的」治療,症状制御を目的とする「緩和的」治療などいろいろな目的の設定が可能である。
痛みの緩和を目的とした放射線治療は「緩和的」治療の代表的なものであり,その有用性は広く知られているが,有痛性骨転移を除いて無作為化比較試験などエビデンスレベルの高い臨床研究は少ない。この要因として,症状緩和を主目的とした治療が行われるような状況にあっては,患者の病状や全身状態・心理社会的条件のばらつきが大きく,一定の均一化した状況を念頭においた「標準治療」の確立が極めて困難であることが考えられる。
放射線治療の適応となるがん疼痛としては,骨転移および手術適応とならない病的骨折・不全骨折による骨痛,脳転移や原発性脳腫瘍による頭痛,神経や軟部組織などへの腫瘍の浸潤に伴う痛み,腫瘍による肝腫や脾腫などによる腹痛などさまざまなものが挙げられる。これらの痛みについては責任病巣が明確であれば,放射線治療の適応となる。放射線治療には痛みを軽減するだけでなく,痛みの原因である腫瘍に直接働きかけて腫瘍縮小などの効果を得ることにより,他の痛み治療の効果を高めるという役割も期待される。
がんによる痛みの緩和は,原因となるがん病巣の縮小や消失によっても得られる。悪性疾患の診断・治療において早い段階から緩和ケアを導入した場合には,この点も考慮して放射線治療の主目的をどのように設定するかが重要となる。したがって,最適な放射線治療を行うためには,個々の痛みに対して責任病巣を画像診断的に正確に把握し,病状や他治療との組み合わせなども考慮しなければならない。放射線治療の治療範囲やあてる放射線の量(線量/分割)の設定は,治療に対して期待される効果や患者の病状などによってさまざまである。痛みの責任病巣の局所制御により予後の改善が期待される場合や,比較的長期生存が期待される場合には根治的な放射線治療が必要とされる。この場合は,総線量が多く治療期間も長い治療が選択され,治療範囲も可及的に病巣を十分にカバーするように設定される。病状が進行し,放射線治療の効果にかかわらず予後が短いと考えられる場合や,他の治療との組み合わせにより短期間の症状緩和が求められる場合には,有痛性骨転移の1 回照射のように短期間で終了し,線量が少なく,有害事象(副作用)が起こりにくい治療法の選択が望ましい。また,放射線治療の対象となる腫瘍が大きい場合には,痛みの原因となる部分だけの照射にとどめて全身状態への負担を軽減するようなことも検討する必要がある。
放射線治療の効果による患者の全身状態の改善や,治療中の病状進行などによる悪化に際しては,治療目標の再設定とそれに伴う治療法の変更を要する場合もある。
❷ 放射線治療の種類
放射線治療とは,放射線そのものまたは放射線によって発生するフリーラジカルなどが細胞内の核(染色体)に変化を引き起こし,細胞分裂を障害することによって,細胞増殖の遅延や細胞死を引き起こすという作用を利用した治療である。
混同されることが多い画像診断的介入治療(interventional radiology;IVR)とは,治療手技そのものに画像診断(=radiology)が介入するものを指す。代表例として,肝臓の経カテーテル動脈塞栓療法(transcatheter arterial embolization;TAE)や経皮的骨形成術がある。
放射線治療の手段としては,いくつかの種類がある。一概に治療手段別に適応を限ることはできないが,治療の適応や治療装置のある他病院・施設への紹介を考える場合にはそれぞれの特徴を理解しておく必要がある。
1 )外照射(体外照射)
一般的に放射線治療という場合,体の外から放射線をあてる体外照射(以下,外照射)を指すことが多い。リニアック(高エネルギー放射線治療装置)・ガンマナイフ®・サイバーナイフ® といった名称は制御系などの機械的な特性の異なる装置名であって,外照射である,という点においては同じである。また,リニアック装置に特殊な機能を付加することによって放射線の集中性を非常に高めた,定位放射線治療(stereotactic radiotherapy;SRT),強度変調放射線治療(intensity-modulated radiation therapy;IMRT)や,臓器などの位置移動などを画像上で確認して治療位置の調整を行う画像誘導放射線治療(image-guided radiation therapy;IGRT)といったものもあるが,いずれも外照射に関する手法である。
外照射では,専用のフラットな寝台上で仰臥位になり,1 日1 回行うのが一般的である。状況によって1 日に複数回の治療を行うこともある。1 回の治療時間には,治療の内容によって多少ばらつきがあるが,数分〜十数分を要する。通常は月〜金の週5 日または4 日の治療となるが,治療目標や状況によって変更する場合もある。
この外照射においては,患者には治療中や治療計画(治療のやり方を決めるための画像検査など)にかかる数〜十数分(場合によっては数十分)の間,一定の体位を保持することが求められる。場合によっては,固定具などを作成する。がん疼痛治療においては,この体位保持が困難な場合が多く,鎮痛薬との併用を適切に検討することが必要である。
前出のガンマナイフ®,サイバーナイフ®,SRT,IMRT およびIGRT には治療範囲を極めて限局し,周辺臓器への影響を少なくした治療が行えるという利点がある。一方で,通常の治療よりも長時間にわたって十分な体位保持が必要であること,比較的高額の医療費がかかり保険適用のない場合も多いこと,施行できる施設に限りがあることなどの欠点もある。患者の社会的状況や予後の見通しなども含めて,求められる治療目標に見合った手段の選択が必要である。
さらに,陽子線治療・粒子線治療などの先端的な装置による外照射も存在するが,基本的には根治的治療が目標となるような場合を除いては,がん疼痛治療としては一般的ではない。
2 )密封小線源治療
Ir-192(イリジウム192),Cs-137(セシウム137),Co-60(コバルト60),Au-198(金198)などの放射線同位元素を含有した金属製の針や粒などを治療したい部位に留置あるいは刺入することで,局所的な放射線治療を行う方法である。非常にエネルギーの低い放射線を出す放射線同位元素を用いるため,放射線の影響を受ける範囲が限局されるという利点がある。近年普及してきたIr-192(イリジウム)による高線量率組織内照射装置の場合,1〜数cm 程度の小さな病巣の場合には数十分の治療1 回で腫瘍を縮小して鎮痛効果を得ることも可能である。しかし,放射性物質の管理上の問題や比較的特殊な治療技術であるために行える放射線腫瘍医(radiation oncologist)や施設が極めて限定されるという問題がある。また,症例によっては入院や全身麻酔が必要な場合があることや,多少観血的で侵襲性を伴うことも考慮しなくてはならない。
3 )非密封小線源治療(内照射)
放射性同位元素を含んだ内用剤〔I-131(ヨード131)〕や注射剤〔Sr-89(ストロンチウム89)〕を投与し,体内に入った放射性同位元素が一定の機序によって病巣に集積することで,放射線治療を行う方法である。使用される放射性同位元素の発生する放射線のエネルギーや半減期によって,外来での治療の可否や排泄物などの処理への配慮が異なってくるので詳細については各施設の核医学の専門家や放射線腫瘍医などに確認することが必要である。なお,比較的低侵襲な治療法と考えられるが,現時点では臨床データの蓄積段階でもあるので,適応については十分に検討し,治療後は全身的な影響に関する経過観察が必要である。
2.代表的ながん疼痛治療に対する放射線治療
❶ 有痛性骨転移に対する放射線治療
1 )有痛性骨転移の機序と基本的な考え方
骨転移は,がん疼痛の代表的なものであり,患者のQOL に大きく影響する。その頻度は原疾患により異なるが,例えば肺がん・乳がん・前立腺がんの患者ではその全経過中に高頻度で骨転移を有するようになると報告されている。
骨転移による痛みの発生機序については十分に解明されているとはいえないが,全体像としては以下のように捉えられる。
骨転移の成立過程は,①原発巣から腫瘍細胞が遊離し血管内へ移動する,②腫瘍細胞が血流中で生き残る,③腫瘍細胞が血管から組織へ浸潤し,骨へ定着して微小転移巣を形成する,④転移巣で血管新生が起こり,腫瘍増大して骨融解を引き起こす,というように大別できる。細胞の遊離や移動にはカドヘリンなどの接着因子の機能状態,ケモカイン(白血球を遊走させるサイトカイン,白血球遊走因子),低酸素や酸性環境,細胞形態の変化などの役割が大きい。骨転移巣の特徴の一つは,炎症時にみられるマクロファージや破骨細胞などの間質細胞間のシグナル伝達が,腫瘍細胞によっても引き出される点である。よって転移巣は炎症と同様に,骨融解と造骨のいずれをももたらしうるが,破壊的骨融解に終わることが多い。PTH-rP*は腫瘍細胞そのものが分泌し破骨細胞の活性を高める。
腫瘍組織そのものは無痛である。転移巣がもたらす痛みは,まず影響を受けた骨に由来する痛みと巻き込まれた周辺の神経の痛みとに大別できる。前者は腫瘍細胞による発痛物質や,骨の内圧の上昇や骨の機械的強度の低下による骨内や骨膜にある感覚神経の終末装置への刺激による痛みであり,後者は腫瘍が神経根などへ直接浸潤し圧迫することで生じる痛みと整理できる。しかし,これらの痛みを明確に区分できないことも多い。
放射線治療による鎮痛効果の機序は十分に解明されているわけではないが,上記の骨転移痛発生のさまざまな段階に働きかけているものと考えられる。
*:PTH―rP(parathyroid hormone-related protein)
腫瘍細胞が産生する液性因子で,PTH 受容体に結合してPTH と同様の生理活性を発揮し,高カルシウム血症の原因となる。
2 )有痛性骨転移に対する外照射
有痛性骨転移に対する外照射は,緩和的放射線治療のなかでは最もエビデンスの得られている領域である。原疾患にもよるが,60〜90%の症例で痛みの緩和が得られ,30%程度の患者では治療部位の痛みに対してオピオイドが不要になる。鎮痛効果は,通常,照射開始後2 週程度から出現し,4〜8 週で最大になる。一回線量が多いほど比較的早く痛みが緩和される傾向がある。治療効果持続期間は約6 カ月程度(中央値)で,一般的には総線量が多いほど,長くなる傾向がある。そのため,2 週〜1カ月を超える予後が期待されない症例は治療の適応とならない可能性が高い。
標準的とされているのは1 回3 Gy を10 回,2 週間で治療する方法(30 Gy/10 回/2 週)である。鎮痛目的の放射線治療としては,8 Gy/1 回,12 Gy/2 回,20〜24 Gy/4〜6 回など数多くの線量分割法の報告があるが,鎮痛効果という点ではほぼ同等と考えられる。そのため病的骨折・不全骨折や脊髄圧迫を伴わず放射線治療歴のない骨転移(uncomplicated bone metastasis)において,8 Gy/1 回照射は重要な選択肢であり,対象となる骨転移巣の性状についての正確な画像診断などによって適応を判断する必要がある。一方,欧米などの無作為化比較試験などで8 Gy/1 回照射の痛みの再燃率や骨折のリスクは従来法より高いという報告もあり,予後良好と考えられる場合や荷重長管骨病変については多分割照射のほうが好ましいという考え方もある。また,数カ月以上の生存期間を予測される溶骨性変化では,放射線治療による痛みの緩和だけでなく骨強度を改善する再骨化が期待されるが,多分割照射のほうが再骨化には有利と考えられている。
骨転移が周囲に浸潤する腫瘤を形成している場合や神経の圧迫を伴うような場合には,腫瘍の縮小を図ることが望ましいため,総線量の高い多分割照射が適応となる。末梢神経の圧迫や浸潤による神経障害を伴っている病変に対しては,放射線治療により鎮痛できる割合は40〜60%と低く報告されているので,鎮痛薬,鎮痛補助薬の使用や神経ブロックなどの他治療の併用を検討することも必要である。
1〜5 回程度の少ない治療回数の放射線治療を行う場合には,1 回線量が大きくなり,治療部位や治療範囲の広さによっては有害事象がやや強めに認められる可能性がある。そのため,実際の線量分割法を決定するには,患者の意思も尊重したうえで,これらの要因を総合的に判断することが大切である。
骨皮質の3 cm 以上あるいは50%以上の溶骨性変化を伴い,骨折のリスクが高い長管骨の有痛性骨転移に対しては,整形外科的な予防的固定術の適応を検討する必要がある。固定術後は,固定具の緩みやずれを起こさないために,ある程度長期の生存期間が予測される場合には術後照射を行う。
がんの病状の進行に伴って,痛みの明らかな原因となる骨転移が複数部位に及ぶ場合がある。このような場合,同時に何部位までの放射線治療を行えるかについては明らかな根拠はない。治療部位数が多くなれば,結果として照射範囲が大きくなり全身への影響が出やすくなることや,1 回の治療に時間がかかり体位保持が困難になりやすいなどのデメリットもある。現行の保険診療では,1 回に2 部位までしか認められていないという現実もふまえて放射線治療部門と十分に相談し,患者個々に応じた判断をする必要がある。
また,一度放射線治療を施行した部位の症状再燃に対する再治療は,治療装置の進歩によって,ある程度の対応は可能な場合もあり,再治療による痛みの緩和もある程度は期待できる。しかし,再治療による重篤な有害事象のリスクは否定できないので,十分な説明を行って同意を得る必要がある。
全身に広がった多発性骨転移で痛みの責任病巣を明確にできない場合は,半身照射という選択肢がある。骨髄抑制や消化器症状(悪心・嘔吐・下痢)などの急性期有害事象(副作用)が比較的強く,補液や制吐薬の前投薬などの十分な全身管理が必要である。鎮痛薬の改良や種々の治療方法の導入によって,現在ではほとんど行われなくなっている。そのため適応については,放射線腫瘍医に十分に相談し検討したうえで,慎重に判断する必要がある。
有痛性脊椎転移において,見落としてはならない病態に,脊髄圧迫症候群がある。腫瘍そのものまたは転移のある椎体の変形によって脊髄が圧迫される状態で,最終的には圧迫された脊髄レベルより遠位側の神経麻痺として完成するため,ADL(日常生活動作)を低下させ,QOL を大きく損なう。初発症状としては,背部痛が多いが,症状と脊髄圧迫のレベルが一致しないことも多いので注意を要する。麻痺によって歩行できなくなった場合,放射線治療を行っても十分に運動機能が回復しないことが多いので,早い段階で治療することが重要である。
3 )有痛性骨転移に対するRI(放射線同位元素)治療
Sr-89(ストロンチウム89)はβ線という弱いエネルギーの放射線を出す物質で,骨転移巣の骨の改変に伴う再ミネラル化に伴って病巣に取り込まれ,治療効果を発現する。取り込まれたSr-89 は病巣にとどまるため,有効期間は3 カ月程度である。エネルギーが低いため,投与後数時間後には帰宅可能で外来にて使用可能である。有痛性骨転移の治療について,いくつかの無作為化比較試験では,治療効果の発現が外照射よりやや遅い傾向があるものの,全体の疼痛緩和率などでは外照射と同様の鎮痛効果が報告されている。
本治療の適応を判断するにあたっては,いくつかの点に留意することが必要である。まず,欧米を中心とした無作為化比較試験の対象疾患がほとんど乳がん・前立腺がんであることで,有効性が明確なのは乳がん・前立腺がんの多発性造骨性病変という特定の病態である。しかし,本治療が治療戦略の主力として期待されるべき広汎な骨転移では効果が低かったという報告もある。骨シンチで集積像を示す病巣以外での効果を期待しにくいこと,腫瘤を形成するような骨転移巣や骨折のリスクの高い溶骨性変化を示す病変に対しては外照射のように脊髄圧迫症候群や骨折を回避するだけの明らかな抗腫瘍効果は期待できないことにも注意が必要である。
半身照射同様,骨髄抑制が重要な副作用である。すでに凝固系に異常を来しているような場合や,化学療法などの影響で骨髄抑制のリスクを有している場合は適応とならない。また,投与された放射性同位元素は体内にとどまるため,骨髄抑制の回復には場合によっては数カ月を要する。そのため,化学療法や全骨盤照射などの骨髄抑制を来す可能性のある抗がん治療が予定されているような状況では,時期を慎重に検討する必要がある。特徴的な副作用はフレア現象と呼ばれる投与後の一過性の痛みの増悪で,20%前後に認められるので,患者への説明および十分な鎮痛薬の調整が必要である。
上記のような点に留意して適切に行えばSr-89は有効な痛み治療の選択肢である。
有痛性骨転移に対するRI(放射線同位元素)治療としてはI-131(ヨード131)による甲状腺がん骨転移の治療が古くから行われている。この治療は,I-131 が放出するγ線の透過力が比較的強くて投与量が多いため,患者の体内および排泄物などの放射能レベルが低下するまで特殊病棟への入院を必要とする。そのため施行可能な施設がかなり限られている。
❷ 脳転移に対する放射線治療
脳転移は頭痛以外にもめまい,悪心・嘔吐,種々の神経障害などを引き起こす。放射線治療はこれらの症状の緩和に用いられる。通常は25〜30 Gy/8〜10 回程度の外照射を行う。治療範囲は,疾患・病変の数と局在部位などによって決定し,線量も病状などによって増減する。脳以外の病変が制御されていて全身状態が良好な単発または3 個程度までの脳転移に対しては,外科的切除や定位放射線治療などの積極的治療によって予後が改善する可能性がある。
❸ その他のがん疼痛に対する放射線治療
原発巣か転移巣かを問わず,痛みの責任病巣が局在する腫瘍として同定されれば,患者の全身状態が可能な限り放射線治療の適応となる。線量分割方法としては,30 Gy/10回前後が多いが,局所制御を得ることが好ましいと判断されれば50 Gy/25 回など根治的放射線治療と同様の治療を行う場合もある。一般的には線量が多いほど十分な局所制御が得られ,症状が緩和されている期間も長くなる。
体表に近い病変などでは,密封小線源治療の良い適応となる場合もある。
(日本放射線腫瘍学会 清水わか子,永倉久泰)
【参考文献】
1) 日本放射線腫瘍学会 編.放射線治療計画ガイドライン2012 年版,第3 版,金原出版,2012; pp277-88
2) Lutz S, Berk L, Chang E, et al. Palliative radiotherapy for bone metastases:An ASTRO evidence-based guideline. Int J Radiat Oncol Biol Phys 2011;79:965-76
3) Berger AM, Shuster JL Jr, Von Roenn JH eds. Principles and Practice of Palliative Care and Supportive Oncology, 4th ed, Lippincott Williams & Wilkins, 2013;pp13-5
4) Hanks G, Cherny NI, Christakis NA, et al eds. Oxford Textbook of Palliative Medicine, 4th ed, New York, Oxford University Press, 2011;pp526-47
5) McMahon SB, Koltzenburg M, Tracey I, Turk D eds. Wall & Melzack’s Textbook of Pain, 6th ed, Elsevier, 2013;pp1075-91
2
神経ブロック
本項は日本ペインクリニック学会に依頼して作成したものである。
1.神経ブロック総論
がん疼痛治療の基本は世界保健機関(WHO)のがん疼痛治療法による薬物療法である。この方法により,多くの患者のがん疼痛の治療が可能となっている。ただ,この方法でも,鎮痛効果が得られない場合や薬物の副作用のため継続できない例が10〜30%あると報告されている。治療困難ながん疼痛に神経ブロックは良い適応である。また,治療早期に神経ブロックを適応することは,長期にわたりより良い痛みの緩和が得られる可能性がある。
❶ 神経ブロックとは
神経ブロックとは,局所麻酔薬の投与や神経破壊的処置などにより,末梢から中枢への侵害性入力の伝達を抑制または遮断することにより鎮痛効果を発揮する手法である。オピオイドの投与経路の変更目的に,神経ブロックの手法を用いて硬膜外腔およびクモ膜下腔にオピオイドを投与する方法はこの項に含めることにする。
❷ 利点と欠点(表1)
神経ブロックは,薬物療法で起こる副作用(悪心・嘔吐,便秘,眠気,意識障害など)は生じず,即時的な鎮痛効果が得られる利点がある。神経ブロックによって鎮痛を得た結果,鎮痛薬を減らすことができる。ただ,神経ブロックは,痛みの部位,痛みの原因,全身状態,局所の状態などにより,適切なブロック法がない場合や施行できない場合があり,適応が限られる欠点がある。
利 点
欠 点
|
❸ 適応と禁忌
神経ブロックの適応(表2)は,オピオイドの全身投与で鎮痛が困難な症例,治療に抵抗する重篤な副作用のため薬物療法の継続が困難な例などである。また,薬物療法による効果が明らかでない初期段階でも,神経ブロックが薬物療法に比して鎮痛効果,QOL,ADL 改善の点で優れていると予測される場合には適応となる。以前はモルヒネ換算で1 日120 mg 以上の場合に神経ブロックの適応を考慮することが推奨されていたが,現在のガイドラインではこのような目安は示されていない。神経ブロックを実施する前に,疾患の現況を含む全身状態と予測される経過などの評価を行う。神経ブロックは,程度に差があるがいずれも侵襲的でQOL やADL に影響を及ぼす場合もある。そのため患者・家族にリスク・ベネフィットを十分説明し,同意を得ることが大切である。本邦でがん疼痛に広く適応されている神経ブロックを表3 に示す。
一般的な禁忌は,出血傾向,止血凝固障害,刺入経路に感染巣がある場合などである。腫瘍により神経の走行や隣接組織などに解剖学的異常を生じている場合,神経ブロックに習熟した医師がいない場合には相対的禁忌である。
|
|
- ※ 1:
- 頸部より尾側の痛みに使用される。
- ※ 2:
- 合併症の危険性の少ない,胸部,会陰・肛門部の痛みに適応される。
❹ 神経ブロックの課題
抗がん治療と痛みに対する薬物療法の進歩と神経ブロック施行医師の減少により神経ブロックの施行数が減少している。しかし,がん疼痛に神経ブロックを行う意義は明らかである。不十分な鎮痛は,不安,うつ状態を生じ,痛み閾値を低下させ,痛みを増強させるといった悪循環を形成するので,緩和ケア担当者は痛みの緩和を目指し積極的に神経ブロック施行医師と連携を行うことが重要である。
2.神経ブロック各論
以下に,代表的な神経ブロックを概説する。
❶ 腹腔神経叢ブロック,内臓神経ブロック
膵臓がんをはじめとするがんによる上腹部痛に有効な方法である。
[特 徴] クモ膜下ブロック,硬膜外ブロックなどの体性神経ブロックと異なり,感覚・運動への影響が少なく,機能障害が少ないという利点がある。ただ,内臓よりの感覚線維は交感神経と並走しており,本ブロックでは交感神経も同時に遮断され,一過性の低血圧や腸管蠕動の亢進を生じる。
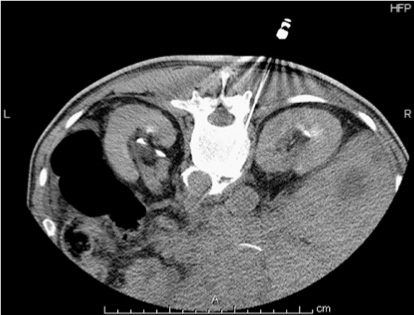
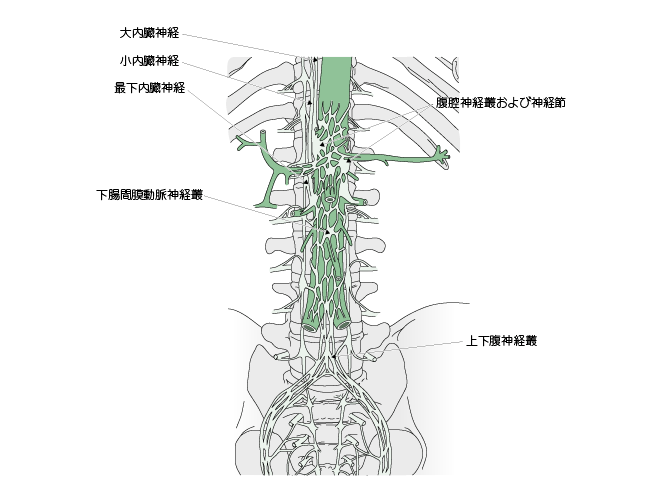
[解 剖] 胃,肝臓,胆囊,膵臓,脾臓,腎臓,結腸などの上腹部内臓からの求心性神経は,腹腔神経叢内にある腹腔神経節に入り,内臓神経(大,小,最下内臓神経),交感神経幹,白交通枝を通って後根に入り,脊髄後角に至り,脊髄を上行する(図1)。
図1 内臓神経および大動脈周囲の神経叢
[適 応] 上腹部内臓のがんによる上腹部痛および背部痛が適応となる。
[方 法] 腹腔神経叢ブロックでは,大動脈前面の腹腔神経叢を遮断し,内臓神経ブロックでは横隔膜脚,椎体前面,大動脈で囲まれるコンパートメント(retrocrural space)内で内臓神経を遮断する(図2)。X 線透視,CT ガイドまたは超音波内視鏡下で行う。
[有効率] 膵臓がんやその他の上腹部の癌患者の70〜90%で長期間の痛みの緩和を得ることができる。膵臓がんの浸潤度と腹腔神経叢ブロックの効果についての研究では,浸潤度が高くなるほど有効性は低く,浸潤度が低いほど有効率は高かった。
[合併症] 一過性の血圧低下,起立性低血圧(30〜40%),アルコールによる酩酊(顔面紅潮,動悸,悪心など)(20〜30%),下痢(60〜70%)などがあり,非常にまれに対麻痺を生じる。
❷ 下腸間膜動脈神経叢ブロック
[特 徴] 下部消化管,腹大動脈周囲への浸潤による下腹部痛,腰痛に有用な方法である。運動・感覚,排尿・排便への影響はない。腫瘍やリンパ節浸潤の部位によっては腹腔神経叢ブロック,内臓神経ブロック,上下腹神経叢ブロックなどと併用される。
[解 剖] 横行結腸左半分,下行結腸,S 状結腸,直腸からの求心性神経は,下腸間膜動脈神経叢を経由し遠心性の交感神経と並走し脊髄に入る。
[適 応] 横行結腸左半分,下行結腸,S 状結腸,直腸由来の痛みや,腹大動脈周囲のリンパ節浸潤や腫瘍の浸潤による下腹部痛や腰痛が適応となる。
[方 法] X 線透視またはCT ガイド下にアルコールまたはフェノールを下腸間膜動脈神経叢に注入する。
[有効率] 他のブロックと併用される場合が多く,下腸間膜動脈神経叢ブロック単独での有効率は不明である。
[合併症] 一過性の低血圧および起立性低血圧,下痢,酩酊,アルコール性神経炎,血管穿刺,後腹膜血腫などがある。
❸ 上下腹神経叢ブロック
[特 徴] 感覚・運動や排尿・排便に影響は生じない。腫瘍やリンパ節の部位によって下腸間膜動脈神経叢ブロックと併用する場合もある。
[解 剖] 上下腹神経叢は,第2,3 腰内臓神経が大動脈分岐部付近で左右が合して形成される神経叢であり,直腸,前立腺,精囊,膀胱後半部,子宮頸部,腟円蓋部などの骨盤内臓器からの求心性神経線維を受けている。
[適 応] 直腸,前立腺,精囊,膀胱後半部,子宮頸部,腟円蓋部などの骨盤内臓器による下腹部痛が適応となる。
[方 法] X 線透視またはCT ガイド下にアルコールまたはフェノールを上下腹神経叢に注入する。
[有効率] がんによる下腹部痛および骨盤内の痛みの患者の72%に著効を示したと報告されている。
[合併症] アルコールによる酩酊,感染(椎間板炎),その他血管穿刺,腸管穿孔,第5 腰神経損傷,射精障害,膀胱直腸機能障害などがあるが,いずれもまれである。
❹ クモ膜下鎮痛法
[特 徴] オピオイドまたは局所麻酔薬を単独または併用し,クモ膜下腔に投与し痛みの緩和を得る方法で,頸部より尾側の痛みに適応される。クモ膜下鎮痛法は,少量の薬液で確実な痛みの緩和が得られ,モルヒネの全身投与で起こる悪心・嘔吐,便秘,眠気などの副作用が少ない。クモ膜下鎮痛法は,硬膜外鎮痛法に比べて鎮痛効果が確実で長期間安定しているが,本邦では硬膜外鎮痛法ほど普及していない。
[鎮痛原理] オピオイドは脊髄液中を拡散し,脊髄および脳にあるオピオイド受容体に作用し鎮痛効果を発揮する。モルヒネは水溶性であり,脳脊髄液中を拡散し,脊髄や脳の広範囲に作用し鎮痛効果を示す。局所麻酔薬は神経線維のNa+チャネルを遮断し神経伝導を抑制・遮断し鎮痛効果を示す。
[適応および禁忌] 頸部より尾側の薬物療法が困難な痛みに適応される。一般的な神経ブロックの禁忌事項に加え,頭蓋内圧の亢進状態は禁忌である。
[方 法] 本邦では,モルヒネ投与用の体内埋め込み型ポンプが認可されていないため,クモ膜下カテーテルの薬液注入端を皮下に通し体外に出す方法と,皮下に注入用のポートを留置する方法が行われている。一般にオピオイドはモルヒネが,局所麻酔薬はブピバカインが使用される。モルヒネは広範囲に鎮痛効果を発揮するためカテーテル先端の位置を厳密にする必要はないが,ブピバカインは注入部位を中心に鎮痛効果を発揮するので痛みに相当する髄節にカテーテル先端を位置させる。硬膜外腔に腫瘍が浸潤している場合には,髄液還流障害を来す可能性があるため,カテーテル先端を腫瘍より中枢に位置させる。モルヒネの1 日投与量は,ブロック前の経口モルヒネ換算の1/300〜1/100 とし,ブピバカインは10〜20 mg/日で開始し痛みに応じ調節を行う。
[有効率] オピオイドの全身投与で効果がなかった患者に対してモルヒネを用いたクモ膜下鎮痛法が有効であったとの報告は多いが,質の低い無作為化比較試験しかないため,がん疼痛に対するクモ膜下鎮痛法は弱い推奨である。一方,本邦では,モルヒネとブピバカインの併用投与が一般的である。この投与法は,硬膜外鎮痛法の無効例に有効であり,またいろいろな部位の痛みに対する有効例が報告されている。モルヒネのみの投与では,クモ膜下投与が全身投与に比して,鎮痛効果および副作用の点で優れている。ブピバカイン併用例では,オピオイドのみによるクモ膜下鎮痛法で治療が困難であった神経障害性疼痛をはじめとする痛みの患者の70〜80%に有効であったと報告されている。
[合併症および副作用] 合併症として感染,髄膜炎,硬膜外血腫,神経損傷などがある。また,カテーテル周囲から髄液漏が起こることがある。他に,オピオイドによる呼吸抑制や眠気,尿閉,瘙痒感,局所麻酔薬による脱力や尿閉,低血圧,カテーテル関連のトラブル(屈曲,閉塞,脱出,周囲組織の炎症性肉芽)などがある。
❺ 硬膜外鎮痛法
[特 徴] 硬膜外鎮痛法は,局所麻酔薬を単独またはオピオイドを混合し硬膜外腔に注入する方法で,頸部より尾側のがん疼痛,非がんの痛み治療法として広く行われている。
[鎮痛原理] 硬膜外腔に投与された局所麻酔薬は,神経根,脊髄に作用し神経伝達を抑制・遮断し,オピオイドは脊髄および脳のオピオイド受容体に作用しシナプス伝達を抑制し鎮痛効果を発揮する。
[適応と禁忌] 頸部より尾側の各種の痛みに適応されている。また,侵襲的なブロックを施行するまでの架橋的鎮痛法として行われる。一般的な神経ブロックの禁忌事項に加え,頭蓋内圧の亢進状態は禁忌である。
[方 法] 硬膜外鎮痛法には,神経ブロック針で薬液を注入する単回法とカテーテル留置し持続的に投与する持続法がある。持続法には,薬液注入端を皮下に通し体外に出す方法と皮下に注入用のポートを留置する方法が行われている。硬膜外腔へのモルヒネ投与は,経口投与の1/10 量で同等の鎮痛効果が得られる。
[有効率] がん疼痛に対する硬膜外鎮痛法は臨床現場では多く施行されているが報告は少ない。硬膜外鎮痛前の内服治療と比較して,硬膜外鎮痛法により鎮痛効果が改善した例が100%,76%であったとする2 つの後ろ向き検討を行った報告がある。
[合併症] 合併症として感染,髄膜炎,硬膜外血腫,硬膜外膿瘍,神経損傷などが起こる可能性がある。他に,局所麻酔薬による筋力低下や尿閉,低血圧,オピオイドによる呼吸抑制や眠気,尿閉,瘙痒感がある。長期間の硬膜外鎮痛では硬膜外腔の線維化や炎症,カテーテルトラブル(閉塞,断裂,移動など)が起こり,鎮痛効果の減弱や注入時痛を生じる。
(日本ペインクリニック学会 坪田信三,平川奈緒美,小杉寿文,長櫓 巧)
【参考文献】
1) Caraceni A, Hanks G, Kaasa S, et al;European Palliative Care Research Collaborative(EPCRC);European Association for Palliative Care(EAPC). Use of opioid analgesics in the treatment of cancer pain:evidence-based recommendations from the EAPC. Lancet Oncol 2012;13:e58-68
2) Ripamonti CI, Bandieri E, Roila F;ESMO Guidelines Working Group. Management of cancer pain:ESMO Clinical Practice Guidelines. Ann Oncol 2011;22(Suppl 6):vi69-77
3) Serban S, Bruno PF. New interventional strategies for the treatment of cancer pain. Topics in Pain Manage 2009;25(5):1-7
4) de Oliveira R, dos Reis MP, Prado WA. The effects of early or late neurolytic sympathetic plexus block on the management of abdominal or pelvic cancer pain. Pain 2004;110:400-8
5) Vissers KC, Besse K, Wagemans M, et al. 23. Pain in patients with cancer. Pain Pract 2011; 11:453-75
6) がん疼痛に対する神経ブロックの役割と実際の治療法.日本緩和医療学会がん疼痛治療ガイドライン作成委員会 編.Evidence-Based Medicine に則ったがん疼痛ガイドライン,真興交易医書出版部,2000;pp107-14
7) National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology. Adult Cancer Pain(version 1. 2012)
http://www.nccn.org/professionals/physician_gls/f_guidelines.asp
8) Curatolo M, Bogduk N. Diagnostic and therapeutic nerve blocks. Fishman SM, Ballantyne JC, Rathmell JP, et al eds. Bonica’s Management of Pain, 4th ed, Philadelphia, Lippincott Williams & Wilkins, 2010;pp1401-23
9) Zara C, Baine N. Cancer pain and psychosocial factors:a critical review of the literature. J Pain Symptom Manage 2002;24:526-42
10) Cervero F. Sensory innervation of the viscera:peripheral basis of visceral pain. Physiol Rev 1994;74:95-138
11) Loukas M, Klaassen Z, Merbs W, et al. A review of the thoracic splanchnic nerves and celiac ganglia. Clin Anat 2010;23:512-22
12) Eisenberg E, Carr DB, Chalmers TC. Neurolytic celiac plexus block for treatment of cancer pain:a meta-analysis. Anesth Analg 1995;80:290-5
13) Akhan O, Altinok D, Ozmen MN et al. Correlation between the grade of tumoral invasion and pain relief in patients with celiac ganglia block. AJR Am J Roentgenol 1997;168:1565-7
14) Kumar A, Tripathi SS, Dhar D, et al. A case of reversible paraparesis following celiac plexus block. Reg Anesth Pain Med 2001;26:75-8
15) Kitoh T, Tanaka S, Ono K, et al. Combined neurolytic block of celiac, inferior mesenteric, and superior hypogastric plexuses for incapacitating abdominal and/or pelvic cancer pain. J Anesth 2005;19:328-32
16) Bosscher H. Blockade of the superior hypogastric plexus block for visceral pelvic pain. Pain Pract 2001;1:162-70
17) 井関雅子.上下腹神経叢ブロック―透視下アプローチ.ペインクリニック2011;32:S181-7
18) de Leon-Cassaola OA, Kent E, Lema MJ. Neurolytic superior hypogastric plexus block for chronic pelvic pain associated with cancer. Pain 1993;54:145-51
19) Swarm RA, Karanikolas M, Cousins MJ. Injections, neural blockade, and implant therapies for pain control. Hanks G, Cherny NI, Christakis NA, et al eds. Oxford Textbook of Palliative Medicine, 4th ed, New York, Oxford University Press, 2011;pp734-55
20) 大澤匡弘,中川貴之,成田 年.薬理学的知識.日本緩和医療学会緩和医療ガイドライン作成委員会 編,がん疼痛の薬物療法に関するガイドライン2010 年版,東京,金原出版,2010; pp35-6
21) Baker L, Lee M, Regnard C, et al. Evolving spinal analgesia practice in palliative care. Palliat Med 2004;18:507-15
22) Bennett G, Serafini M, Burchiel K, et al. Evidence-based review of the literature on intrathecal delivery of pain medication. J Pain Symptom Manage 2000;20:S12-36
23) Mercadante S. Problems of long-term spinal opioid treatment in advanced cancer patients. Pain 1999;79:1-13
24) Smith TJ, Staats PS, Deer T, et al. Randomized clinical trial of an implantable drug delivery system compared with comprehensive medical management for refractory cancer pain: impact on pain, drug-related toxicity, and survival. J Clin Oncol 2002;20:4040-9
25) Kurita GP, Kaasa S, Sjøgren P;European Palliative Care Research Collaborative(EPCRC). Spinal opioids in adult patients with cancer pain:a systematic review:a European Palliative Care Research Collaborative(EPCRC)Opioid Guidelines Project. Palliat Med 2011;25:560-77
26) Nitescu P, Appelgren L, Linder LE, et al. Epidural versus intrathecal morphine-bupivacaine: assessment of consecutive treatments in advanced cancer pain. J Pain Symptom Manage 1990;5:18-26.
27) Sjöberg M, Appelgren L, Einarsson S, et al. Long-term intrathecal morphine and bupivacaine in “refractory” cancer pain. I. Results from the first series of 52 patients. Acta Anaesthesiol Scand 1991;35:30-43
28) Sjöberg M, Nitescu P, Appelgren L, et al. Long-term intrathecal morphine and bupivacaine in patients with refractory cancer pain. Results from a morphine:bupivacaine dose regimen of 0.5:4.75 mg/ml. Anesthesiology 1994;80:284-97
29) 柳本富士雄,森山萬秀,福永智栄,他.がん性疼痛におけるインターベンション治療の役割―硬膜外ブロック.ペインクリニック2007;28:624-32
30) Bedder MD, Burchiel K, Larson A. Cost analysis of two implantable narcotic delivery systems. J Pain Symptom Manage 1991;6:368-73
31) Smitt PS, Tsafka A, Teng-van de Zande F, et al. Outcome and complications of epidural analgesia in patients with chronic cancer pain. Cancer 1998;83:2015-22
3
経皮的椎体形成術(骨セメント)
本項は日本インターベンショナルラジオロジー学会に依頼して作成したものである。
1.経皮的椎体形成術の概要
経皮的椎体形成術は,椎体骨の脆弱化した部位に画像誘導下に経皮的に針を刺入し,骨セメント製剤を注入することにより,椎体骨の脆弱さを補強する治療法である。1984 年にフランスから報告されて以降,1990 年代に急速に普及し,現在は欧米を中心に骨粗しょう症の治療法の一つとして広く行われている。
その原理は,骨セメント製剤の注入により骨を補強し,荷重による椎体骨の変形(きしみ)を抑制して,荷重時の痛みを緩和するものである。この他にも,骨セメント製剤の凝固時の発熱や化学毒性による直接的な抗腫瘍効果の可能性も指摘されているが,詳細は明らかになっていない。このため,骨粗しょう症に限らず,原発性あるいは転移性腫瘍により椎体骨が脆弱化した場合にも,同様の原理で痛みを緩和することが可能であり,がん疼痛としての椎体骨の腫瘍性疼痛に対する治療法として活用されている。
2.適 応
明確なエビデンスをもって緩和ケアにおける椎体形成術の適応を示す資料はない。ここでは,日本腫瘍IVR 研究グループで行われた臨床試験(JIVROSG-0201)の結果から,現時点における臨床現場での判断に役立てることが可能なものを抜粋して示す。以下の5 項目すべてを満足する場合が,椎体形成術の適応と考えられる。また,保険診療では同時に治療できるのは4 椎体以内と制限されている。
(1)椎体の腫瘍性病変による体動時疼痛
体動時に出現あるいは増強する痛みで,その原因が椎体骨の脆弱化に起因すると考えられるもの。現時点で,放射線照射や薬物療法などの既存の治療法に先行して行うことを妥当とするエビデンスはないが,荷重により椎体骨の破壊が進む可能性が強い場合,骨折の危険性から運動制限が必要な状況下では,先行しての施行を考慮することは許容されると考えられる。なお,活動性炎症(結核性椎体炎,感染性椎体炎)は否定されている必要がある。
(2)腫瘍が脊柱管に大きく露出していない
骨セメント製剤の脊柱管への漏出の危険性を回避するため,脊柱管との境界を形成する椎体後壁が概ね維持されていることが望ましい。ただし,骨セメント製剤漏出の危険性については技術的な要因が大きいため,最終的な判断は個々の症例の状況や術者の判断に委ねざるをえない。
(3)著しい出血傾向がない
(4)解剖学的に穿刺針の刺入が可能
上部胸椎〜頸椎は技術的難易度が増し,相対的にリスクも高くなるため適応は慎重に判断する必要がある。また,圧迫骨折による椎体骨の扁平化が高度な場合は,穿刺針の刺入が難しい場合がある。
(5)処置に要す体位の保持が可能
多くは腹臥位で施行される。麻酔などの全身的な管理により可能であれば問題ない。
3.手技の概要
従来,整形外科で使用される骨セメント製剤が用いられていたが,2009 年12 月に本治療用の製剤であるSpinePlex が本邦で薬事承認された。椎体骨の穿刺には骨生検針が使用され,X 線あるいはCT ガイド下に穿刺針を刺入する。注入された骨セメントの椎骨外への漏出を防ぐため,中部胸椎〜腰椎では横突起を介して刺入する方法が一般的である。穿刺針先端の位置についても,同様に骨セメントの漏出,特に脊柱管内への漏出を防ぐため,椎体骨の前1/3 付近が適切とされている。ただし,腫瘍による骨破壊部位に骨セメントを注入することが重要であるため,骨破壊部位の局在により最適とされる位置は変更される場合がある。また,十分な骨セメント製剤の注入を行うため左右両側から2 本の針を穿刺する場合もある。しかし,注入される骨セメント製剤の量と効果とは必ずしも一致せず,腫瘍による疼痛治療が目的の場合には1 本で施行される場合が多い。
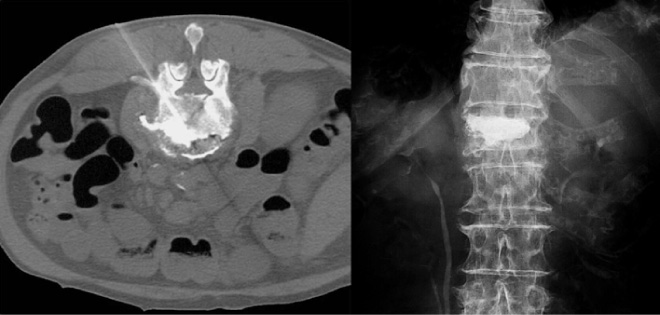
骨セメントの注入は,リアルタイムにX 線あるいはCT 透視で骨セメント製剤の広がりを確認しながら行う。骨セメント製剤は注入は,1 mL のシリンジに分注する方法や専用の器具を用いる方法がある(図3)。目的とする部位への骨セメント製剤の注入が完了したことをX 線透視あるいはCT にて確認した段階で,穿刺針を抜針する。抜針後は2 時間程度のベッド上安静の後,術前の安静度まで復帰し,翌朝からは鎮痛効果の度合いにあわせ活動範囲を拡大する。椎体形成術自体による痛みは一般に軽微であり,穿刺部の局所麻酔と必要に応じて軽い鎮痛薬を使用するのみで十分である。しかし,手技中は原則として腹臥位を維持する必要があり,手技中の体位維持が問題となる場合には,全身的な鎮静や麻酔も考慮される必要がある。技術的な難しさにもよるが,1 椎体骨に要する時間は概ね30〜40 分程度であるため,複数部位の椎体形成術を一期的に行うことも可能である。また,多椎体を同時に治療する際には同一体位を維持する時間が延長するため,局所麻酔のみで4 椎体以上を同時に治療することは容易でない。なお,保険診療では1 度の手術での治療椎体は4 椎体以内と制限されている。
図3 椎体に刺入された穿刺針(左:CT)と注入された骨セメント(右:単純X 線)
4.成 績
海外,国内を問わず,悪性腫瘍症例に対する椎体形成術は,骨粗しょう症に混じる形で実臨床として行われた結果についての後向き集計による報告のみであり,前向き研究として行われたのは本邦で行われた前述のJIVRSG-0202だけである。よって,ここではその結果の概要を示す。
本試験は,有痛性椎体悪性腫瘍に対する経皮的椎体形成術の安全性ならびに臨床的有効性の評価を目的として,primary endpoint を安全性の評価,secondary endpoints を臨床的有効性の評価,有害事象の発現頻度・程度として行われた第Ⅰ/Ⅱ相試験であり,国内10 施設より症例33 例が登録された。登録例の内訳は,男性16例,女性17 例,平均年齢62 歳,PS 0 が1 例,PS 1 が2 例,PS 2 が12 例,PS 3 が13 例,原発巣は肺がん7 例,乳がん7 例,大腸がん7 例,肝臓がん4 例,骨髄腫3 例,膵臓がん2 例,舌がん1 例,食道がん1 例,皮膚がん1 例であり,治療椎体数は42 椎体で,その内訳は,胸椎19 例,腰椎23 例,溶骨性35 例,混合性5 例,造骨性2 例,平均椎体圧潰率75.8%であった。
結果として,原疾患の進行による30 日以内の死亡2 例を除き,NCI-CTC Grade 4 以上の有害事象発現はなく,Grade 3 の穿刺部からの出血(用手圧迫により止血),Grade 2 の低アルブミン血症が認められたのみであった。手技の完遂率は100%で,有効率は1 週間目の測定において,著効:VAS 値が0〜2 となる,または治療前より5 以上低下,有効:VAS 値の低下が2 以上5 未満,無効:上記以外の場合とする判定規準にて,著効20 例(61%),有効3 例(9%),無効10 例(30%),有効率70%(95%信頼区間:51〜84%)であり,疼痛緩和までの期間は,平均2.4 日(SD:3.2 日),中央値1 日であった。なお,治療後4 週目の効果は,著効73%,有効12%,無効15%,有効率83%とさらに上昇していた。また,対象例の生存期間中央値は194 日(SD:240 日)であった。
以上の結果より,JIVROSG-0202 試験では,「有痛性椎体悪性腫瘍に対する経皮的椎体形成術は許容される安全性と実行性,70%程度の有効率を有し,かつ効果発現までの期間が1 日程度と極めて短く有効な治療法である」と結論している。なお,文献的には,有害事象として,痛みの悪化,軽度の発熱,神経根の症状悪化,軽度の心機能低下などの軽度なものが10%程度に,また肺塞栓症,アナフィラキシーショック,脊髄圧迫による永久的脊髄障害,死亡などの重篤なものが1%以下ながら報告されている。
5.本邦の状況と椎体形成術の扱い
椎体形成術が有痛性椎体悪性腫瘍に対し,臨床的に良い結果を示す場合のあることは紛れもない事実である。しかしながら,その成績について十分な情報が蓄積されているとは言い難く,特に対象とすべき症状の範囲,安全に施行しえる限界,他の治療法との組み合わせ,まれな有害事象の頻度など,国内外を問わず多くの検討課題が残されている。一方,国内では,骨粗しょう症に対する椎体形成術と同列に語られる場合が多いため,整形外科医を含めさまざまな意見が混在し,十分なコンセンサスは形成されていない。
経皮的椎体形成術は2012 年に保険収載され,日常診療で施行できるようになった。経皮的椎体形成術に使用する骨セメント製剤および器具は2009 年12 月に薬事承認された製品があり,これを用いて行うこととなる。
経皮的推体形成術は有用な治療選択肢の一つであるが,施行するうえで最も重要なことは,「この治療法が有効性はあるものの一定のリスクをもち,かつ,その内容について十分な臨床データが蓄積されていない」という事実を正しく患者に伝え,その不確実性について十分な理解を得たうえで同意をとる慎重な姿勢である。また,実施については,適応の判断も含め,その技術についての知識を有するIVR 専門医と連携して行うことが望まれる。加えて痛みの原因についての判断には,神経内科医や整形外科医,麻酔科医などの判断が必要になる場合があり,さらに頻度が低いとはいえ,種々の合併症に対する緊急対応には整形外科医,麻酔科医の援助が不可欠であり,これらの診療科の連携が得られる状況下で行われる必要がある。
(日本インターベンショナルラジオロジー学会 荒井保典)
【参考文献】
1) Galibert P, Deramond H, Rosat P, et al. Preliminary note on the treatment of vertebral angioma by percutaneous acrylic vertebroplasty. Neurochirurgie 1987;33:166-8
2) Cotten A, Boutry N, Cortet B et al. Percutaneous vertebroplasty:state of the art. Radio graphics 1998;18:311-20
3) 馬場康貴,大久保幸一,濱田健司,他.転移性溶骨性骨腫瘍に対する経皮的椎体形成術(経皮的骨セメント局注療法)の1 経験例.日医放会誌1997;57:880-2
4) 小林 健,高仲 強,松井 修,他.CT 透視を用いた経皮的椎体形成術の有用性.IVR 会誌1999;14:343-8
5) Barr JD, Barr MS, Lemley TJ, et al. Percutaneous vertebroplasty for pain relief and spinal stabilization. Spine 2000;25:923-8
6) Weill A, Chiras J, Simon JM, et al. Spinal metastases;indications for and results of percutaneous injection of acrylic surgical cement. Radiology 1996;199:241-7
7) Murphy KJ, Deramond H. Percutaneous vertebroplasty in benign and malignant disease. Neuroimaging Clin N Am 2000;10:535-45
8) Padovani B, Kasriel O, Brunner P, et al. Pulmonary embolism caused by acrylic cement;a rare complication of percutaneous vertebroplasty. AJNR 1999;20:375-7
9) Chiras J, Depriester C, Weill A, et al. Percutaneous vertebral surgery. Technics and indication. J Neuroradiol 1997;24:45-59
10) Grados F, Depriester C, Cayrolle G, et al. Long-term observations of vertebral osteoporotic fractures treated by percutaneous vertebroplasty. Rheumatology 2000;39:1410-4
11) Jensen ME, Kallmes DE. Percutaneous vertebroplasty in the treatment of malignant spine disease. Cancer J 2002;8:194-206
12) Kaufmann TJ, Jensen ME, Ford G, et al. Cardiovascular effects of polymethylmethacrylate use in percutaneous vertebroplasty. AJNR 2002;23:601-4
13) McGraw JK, Heatwole EV, Strnad BT, et al. Predictive value of intraosseous venography before percutaneous vertebroplasty. J Vasc Interv Radiol 2002;13:149-53
14) Shimony JS, Gilula LA, Zeller AJ, et al. Percutaneous vertebroplasty for malignant compression fractures with epidural involvement. Radiology 2004;232:846-53
15) Cheung G, Chow E, Holden L, et al. Percutaneous vertebroplasty in patients with intractable pain from osteoporotic or metastatic fractures:A prospective study using quality-of-life assessment. Can Assoc Radiol J 2006;57:13-21
16) Kobayashi T, Arai Y, Takeuchi Y, et al. Japan Interventional Radiology in Oncology Study Group(JIVROSG):PhaseⅠ/Ⅱ clinical study of percutaneous vertebroplasty(PVP)as palliation for painful malignant vertebral compression fractures(PMVCF):JIVROSG-0202. Ann Oncol 2009;20:1943-7