�������ᇁ@�`���ÃK�C�h���C��
�K�C�h���C�������̕����ԍ�����C�Y�����镶�����X�g�փ����N����܂�
III�D������
1
������������
�imultiple myeloma�FMM�j
�imultiple myeloma�FMM�j
�����_
������������imultiple myeloma�FMM�j�́C�`���זE�̒P�N���[�����i��ᇐ��j���B�ƁC���̎Y���ł���P�N���[�����Ɖu�O���u�����iM �`���j�̌����E�A�������ɂ������Â����鎾���ł���1�j�B�킪���ł͐l��10 ���l�������3 �l�̔��Ǘ��ŁC�{�M�ł̎��S�Ґ��͔N��4,000 �l�O��ł���B�S������ᇂ̖�1���C�S�������ᇂ̖�10�����߁C���Ǘ��C���S���Ƃ��ɔN�X�����X���ɂ���B���ۍ������ƕ���iInternational Myeloma Working Group�FIMWG�j�ɂ��f�f�K�����L���p�����Ă���i�\1�j2�j�B
���̒��őS�g���w�Ö@�̑ΏۂƂȂ�̂�CRAB�iO�j�ŏ̂���鑟���Q�C���Ȃ킿���J���V�E�����ǁC�t�s�S�C�n���C���a�ρC���̑��i�ߔS�f�x�nj�Q�C�A�~���C�h�[�V�X�C�N2 �����ۊ����j�̂�����ȏ��L���Ă���nj�����isymptomatic myeloma�j����яnj�^������҂ł���CM �`���ʂ͎��ÊJ�n�̎w�W�Ƃ��Ă͗p���Ȃ����Ƃɒ��ӂ��K�v�ł���B�������C2011 �N�̑�13 �ۍ������ƕ���ɂ����ăK�C�h���C���̌���������Ă��ꂽ�B���������Ƃ��ẮC�����Q��������f�f���ہimyeloma-defining event�FMDE�j�Ə̂��邱�ƁC�u�N2 �����ۊ����v��MDE ���珜�O���ꂽ���ƁC�A�~���C�h�[�V�X��y�������P�Ƃł�MDE�Ƃ��Ȃ����ƁC�t�s�S�̒�`�ɂ͌����N���A�`�j���l�ł͂Ȃ����Z�������h�ߗ��iestimated glomerular filtration rate�FeGFR�j��p���C①���Ɍ����̂Ȃ��N35���ȏ��eGFR �̒ቺ�C②���Ɍ������Ȃ�eGFR 50 mL/�������C③�t�����ɂ��light chain nephropathy �̐f�f�C�̉��ꂩ��MDE �Ƃ��ėp�����邱�ƂɂȂ������ƂȂǂ���������B�nj�����҂̐f�Âɂ����Ď��ÊJ�n�O�̃x�[�X���C���]���Ƃ��Ċ��߂��錟�����ڂ����i�\2�j�B
�nj�����ɑ��Ċ��җ\��𐄒肷�邽�߂̕a�����ނƂ��āC������2 �~�N���O���u�����l�ƃA���u�~���l�݂̂�p���鍑�ەa�����ށiInternational Staging System�FISS�j�̎g�p�����������i�\3�j3�j�B�����Đ��F�̕��͂�FISH �ifluorescence in situ hybridization�j�@��p�����a�^�̒��s���Ă���C�����X�N�a�^�ƕW�����X�N�a�^�ɕ��ނ���\����q�Ƃ��Ă̈Ӌ`��������Ă���i�\4�j4�j�B�������C�����_�ł�ISS ����F�̕a�^�Ɋ�Â����w�Ö@�̑w�ʉ��͎��{����Ă��Ȃ��B
���Ì��ʔ���ɂ́C���ۍ������ƕ���ɂ�铝����ʔ���K���iuniform response criteria�j���L���p�����Ă���5�j�B���ʔ���ɕK�v�Ȍ������ڂƔ���K���������i�\5�C�\6�j�B�܂�����QOL �̕]���ɂ�EORTC-MY20 �⍜�a�ςɑ���BM22 �Ȃǂ̕]���\�̎g�p���L�p�ł���6�j7�j�B
Monoclonal Gammopathy of Undetermined Significance�iMGUS�j
|
�������Qrelated organ or tissue impairment�iend organ damage�j�iCRABO �nj�j
- ���J���V�E�����ǁF�����J���V�E����11 mg/dL �܂��͊�l���1 mg/dL ����㏸
- �t�s�S�F�����N���A�`�j���l��2 mg/dL
- �n���FHb �l����l���2 g/dL �ȏ�ቺ�܂���10g/dL ����
- ���a�ρF�n���a�ς܂��͈������܂����e頏ǁiMRI�CCT�j
- ���̑��F�ߔS�f�x�nj�Q�C�A�~���C�h�[�V�X�C�N2 �����ۊ���
| ��ʌ���
���A�C�փw���O���r���C���Z�E���t���C�ÌŌ����C�����w�E�Ɖu�����i���`���C�A���u�~���C���r�����r���CAST�CALT�CALP�CLDH�C�A�~���[�[�C�A�����j�A�C�A�_�C�����CBUN�C�N���A�`�j���C�i�g���E���C�J���E���C�J���V�E���C�`������C��2 �~�N���O���u�����CCRP�j�CHBs �R���CHBc �R�́CHBs �R�́CHCV �R�́CHIV �R�́C����X �������C�S�d�}�C�������_�f�O�a�x |
| M �`���̓���ƒ��
�`������i�����C�A�j�C24 ���ԔA�`����� |
| �����`���זE�̑����C�`���זE��̏ؖ�
�������h�E�������� |
| �����Q�̐f�f
�S�g��X �������i���W���F���E���C��ŁC���ŁC���ŁF���E���C�]���F���ʁC���Ս��F���ʁC���E�̏�r���F���ʁC���E�̑O�r���F���ʁC���E�̑�ڍ��F���ʁC���E�̉��ڍ��F���ʁj |
| ���̑��̌����i�K�v�ɉ����lj��j
�����i�牺�g�D�C�����C���O�C�݁C���邢�͐t�j�C���t�E�����E�����S�f�x�C��ꌟ���C�`�~�W���L�i�[�[�C�N���I�O���u���� |
| Stage | � |
|---|---|
| Ⅰ | ������2 �~�N���O���u������3.5 mg/L �����A���u�~����3.5 g/dL |
| Ⅱ | Ⅰ�ł�Ⅲ�ł��Ȃ����� |
| Ⅲ | ������2 �~�N���O���u������5.5 mg/L |
���FStage Ⅱ�ɂ͈ȉ���2 ���܂܂��B
- ������2 �~�N���O���u������3.5 mg/L �Ō����A���u�~��3.5 g/dl �̂���
- �����A���u�~���l�ɂ�����炷������2 �~�N���O���u������3.5 mg/L ����5.5 mg/L �̂���
�iGreipp PR, et al. J Clin Oncol 23�i15�j:3412-3420, 2005 �����p�j
| �����X�N�Q�iUnfavourable risk�j
FISH �@�ɂ��t�i4;14�j�Ct�i14;16�jor t�i14;20�j |
| �W�����X�N�Q�iFavourable risk�j �����X�N�Q�Ƃ��Ăُ̈폊�����Ȃ��C���L�ُ̈��F�߂� ����{�́ihyperdiploidy�j�CFISH �@�ɂ��t�i11;14�jor t�i6;14�j |
Plasma cell myeloma, WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, IARC Press 2008
���ِ����Ƃ́C������F�̂̐��ɑ�����F�߂��Ԃ������B
M �`���ʑ���̂��߂̌���
|
����\�a�ρimeasurable disease�j�̒�`
|
PR ��������SD �K���̔��f�̂��߂̃t�H���[�A�b�v
|
| Response subcategory | Response criteria |
|---|---|
| sCR�istringent CR�j | CR�K�������ƂƂ��ɉ��L�̏��������B FLC�ifree light chain�j��i��/�Ɂj������ŁC�Ȃ����� �Ɖu�g�D���w�܂��͌u���R�̖@�ɂč�������clonal plasma cell�iPC�j���ؖ����Ȃ��B |
| CR�icomplete response�j | �Ɖu�Œ�@�ɂČ����ƔA����M �`�����Ƃ��ɉA�����C�Ȃ����� ��`���זE��̏����C�Ȃ����� ������PC ��5�������܂Ō����B |
| VGPR�ivery good partial response�j | �����ƔA��M �`�����Ɖu�Œ�@�ł͌��o����邪�C �`���d�C�j���ł͌��o����Ȃ����C�܂��� 90���ȏ��M �`�����������C�A��M �`����100 mg/24 ���Ԗ����܂Ō����B |
| PR�ipartial response�j | ����M �`����50���ȏ㌸�����C�Ȃ����� 24 ���ԔA��M �`���ʂ�90���ȏ㌸�����邩�C200 mg/24 ���Ԗ����܂Ō����B �����ƔA��M �`��������\�a�ςłȂ��ꍇ�i����M �`����1 g/dL�C�A��M �`����200 mg/24 ���ԁj�ɂ́CM �`���K���̑���Ɍ���FLC �l��involved/uninvolved FLC �䂪50���ȏ㌸������K�v������B �����ƔA��M �`��������\�a�ςł͂Ȃ��C�Ȃ�������FLC �l������\�a�ςłȂ��ꍇ�iFLC��10 mg/dL�j�ɂ́CM �`���K���̑���ɍ�����PC ��50���ȏ㌸�����Ă��邱�Ƃ�K�v�Ƃ���i���������ÑO�̍���PC �� 30���̏ꍇ�̂݁j�B ��L�̋K���ɉ����āC���ÑO�ɓ�`���זE����݂����ꍇ�ɂ͑���\�a�ς̒��a�ƒZ�a�̐Ϙa��50���ȏ㌸�����Ă��邱�Ƃ��K�v�����Ƃ���B |
| SD�istable disease�j | CR, VGPR, PR, PD �̂�����̋K�������������Ȃ��ꍇ�B |
| Relapse subcategory | Relapse criteria |
| Progression#�iPFS/TTP �]���ړI�̌v�Z�ɗp����B���ʔ���Ƃ��Ă�progressive disease�m�i�s�n�ƁC���Ò��܂��͎��ÏI�����disease progression�m�����n �̗��҂̔���ɗp����B�܂�CR ���B��̑����ɑ��Ă������K�����g�p����B�j | ���L�̍��ڂ�1 ���邢�͂���ȏ�����ꍇ�B
|
| Relapse from CR�i�G���h�|�C���g��DFS �̏ꍇ�ɂ̂ݗp����j | ���L�̈ꍀ�ڈȏ�����ꍇ
|
| Clinical relapse �iTTP/PFS �]���ɂ͗p���Ȃ��j |
���L�̍��ڂ̈���邢�͂���ȏ�����ꍇ�i��ᇐi�W�ɔ��������Q�gCRABO �nj�h�̑����������w�W�j
|
- ���ׂĂ�response �̔���ɂ͘A������2 ��̔��肪�K�v�ł���i6 �T�Ԃ̊Ԋu��������K�v�͂Ȃ��j�B
- sCR�CCR ����̖ړI�ł̍���������1 ��̔���݂̂ł悢�B
- Clonal PC �̑��݂́C��/�ɔ�����ɔ��肷��B�Œ�100 �ȏ��PC ���J�E���g����/�ɔ䂪��4�F1 �܂��́�1�F2 �ł��鎞�ɂُ͈�Ȕ䗦�Ɣ��f����B
- ���ׂĂ�progression �̔���ɂ͘A������2 ��̔��肪�K�v�ł���i6 �T�Ԃ̊Ԋu��������K�v�͂Ȃ��j�B# �����ɂ��T�u�J�e�S���[�̖��̂�progressive disease�iPD�j�Ƃ���Ă���C���̒��ɋ��`��PD�i�i�s�j�Ǝ��Ò��܂��͎��Ì��disease progression�i�����j���܂ނƂ̋L�ڂ����邪�C����������₷���\���ł��邽�߁C���҂�progression �Ɖ��̂��Ă܂Ƃ߂��B
- ����܂ł�MR ����Cnear CR ����C�v���g�[�̒�`�͗p���Ȃ��B
- ����\�a�ρimeasurable disease�j�̒�`�́C�\1 ���Q�Ƃ̂��ƁB
- CRABO �nj�ɂ��ẮCIMWG �̐f�f�K���̑����Q�iend/related organ damage�j�̍����Q�ƁB
�y�Q�l�����z
1�j McKenna RW, et al. Plasma cell neoplasms. Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, IARC ; 2008 : pp200-13.
2�j International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders : a report of the International Myeloma Working Group. Br J Haematol. 2003 ; 121�i5�j : 749-57.
3�j Greipp P, et al. International staging system for multiple myeloma. J Clin Oncol. 2005 ; 23�i15�j : 3412-20.
4�j Fonseca R, et al. International Myeloma Working Group molecular classification of multiple myeloma : spotlight review. Leukemia 2009 ; 23�i12�j : 2210-21.
5�j Durie BGM, et al. International uniform response criteria for multiple myeloma. Leukemia 2006 ; 20�i9�j : 1467-73.
6�j Cocks K, et al. An international fi eld study of the reliability and validity of a disease-specific questionnaire module �ithe QLQ-MY20�j in assessing the quality of life of patients with multiple myeloma. Eur J Cancer. 2007 ; 43�i11�j : 1670-8.
7�j �����Е��C��. ���]�ڂ��҂ɑ���EORTC QOL �������W���[��-EORTC QLQ-BM22 ���{��ł̊J��-�@���Ɖ��w�Ö@. 2010 ; 37�i8�j : 1507-12.
���A���S���Y��
�nj�����̑O���a�Ԃł���MGUS �△�nj�����͖����Ìo�ߊώ@�iwatchful wait�j�������ł���C�nj�����Ɉڍs�������_�őS�g���w�Ö@���J�n����i���nj�����FCQ1,CQ2�C�G�r�f���X���x��1iiA�j�BMGUS �́C�N��1���̊����ŏnj������S�g���A�~���C�h�[�V�X�i�s���邱�Ƃ��m���Ă���C10 �N���12���C20 �N���25���C25 �N���30���̊��҂Ŏ����̐i�s���F�߂���1�j�B�����i�s�̃��X�N���q�Ƃ��āC①����M �`����1.5 g/dL �ȏ�C②��IgG �^�C③�����V���y���i��/�Ɂj��ُ��3 ���q��������Ă���C�i�s������\�����郂�f��������Ă���i�}1�j2�j�B���nj������nj�����邢�͑S�g���A�~���C�h�[�V�X�ւ̐i�s�́C�f�f���5 �N�Ԃ͔N10���C����5 �N�Ԃ͔N3���C10 �N����ƔN1���ɔF�߂���3�j�B�i�s�̃��X�N���q�Ƃ���①�������`���זE�䗦10���ȏ�C②����M �`���Z�x3 g/dL �ȏ�C③�����V���y����̑傫�Ȉُ�i��/�ɔ��0.125 �ȉ���������8.0 �ȏ�j��3 ���q��p�����\�����f��������Ă���i�}2�j4�j�B
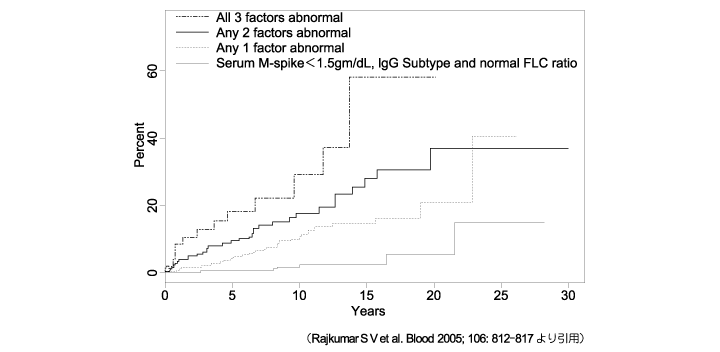
�}1�@MGUS ���҂̐i�W���X�N
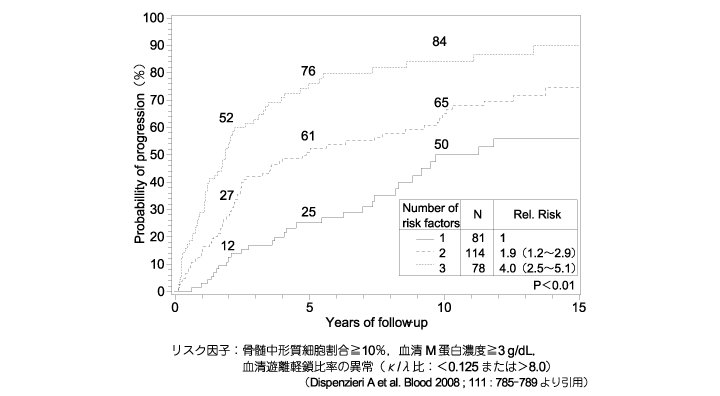
�}2�@���nj�����҂̐i�W���X�N
���̌Ǘ����`���זE��␑�O�`���זE��ɑ��ẮC40�`50 Gy�i20�`25 �����j�̋Ǐ����ː��Ǝ˂��s������ɖ����Ìo�ߊώ@���C�nj�����Ɉڍs�����ꍇ�ɂ͂��߂đS�g���w�Ö@���l������B�A�W���o���g�Ö@�Ƃ��Ẳ��w�Ö@�͐�������Ȃ��i�Ǘ����`���זE��E���O�`���זE��FCQ1�C�G�r�f���X���x��3iiA�j�B�Ȃ��������`���זE��ɑ��ẮC�nj�����Ɠ��l�̎��Õ��j���I�������B
�����_�ł́C�nj�����͎��������҂ł��鎾���ł͂Ȃ��B�������C���É���ɂ�蒷���̐������\�ƂȂ��Ă��鎾���ł���B���Ȃ킿�C�ǍD�Ȑ����̎��iquality of life�FQOL�j���ێ����Ȃ��璷��������ڎw�����Ƃ����ÖڕW�ƂȂ�B��ʂɎ��Ƒ������זE�ڐA���p��ʉ��w�Ö@ �ihigh-dose chemotherapy with autologous hematopoietic stem cell transplantation�FHDC/AHSCT�j�̓K���ƂȂ�65 �Ζ����̈ڐA�K�����҂ƁC65 �Έȏ゠�邢�͏d�v����̏�Q�̂��߂Ɏ��Ƒ������זE�ڐA�̓K���ƂȂ�Ȃ��ڐA��K�����҂ɂ���ĈقȂ������Ð헪���I�������B65 �Ƃ����N��͂����܂Ŗڈ��ł���C����Տ��ɂ����Ă͐����w�I�N����l��������Ŏ��Õ��j�����肷��B�ڐA�K�����҂ł́C���w�Ö@����ѐV�K��܂�p���������Ö@��̑�ʃ����t�@�����iMEL�j�Ö@�ɂ�銮�S�t���icomplete response�FCR�j�̒B���������̖������������ԁC�Ђ��Ă͒��������̑�ւ��}�[�J�[�ƂȂ邱�Ƃ�������Ă���6�j7�j�B�܂��ڐA��K�����҂ɂ����Ă��C�V�K��܂p�������w�Ö@�ɂ��CR �B�������̑�����������Ă���C����܂ŃS�[���h�X�^���_�[�h�ł�����MP �Ö@�𗽂��������Ԃ̉��������҂ł���悤�ɂȂ���8�j�B
�x���Ö@�Ƃ��ẮC�r�X�z�X�z�l�[�g���܂̕��p�ɂ���č��ɂ�a�I���܂Ȃǂ̍��֘A���۔����̌������ʂ݂̂Ȃ炸�C�������Ԃ̉������ʂ����҂ł���悤�ɂȂ���9�j10�j�i�x���Ö@�FCQ1�C�G�r�f���X���x��1iiA�j�B�܂��C�䂪���ɂ����ẮC�t��Q�̂��߂Ƀr�X�z�X�z�l�[�g���܂��g�p���Â炢�ꍇ�ɂ̓q�g�^�RRANKL�ireceptor activator of nuclear factor-��B ligand�j���m�N���[�i���R�̂ł���f�m�X�}�u�̎g�p���I���\�ł���11�j�i�x���Ö@�FCQ2�C�G�r�f���X���x��1iC�j���C�d�ĂȒ�J���V�E�����ǂ����������Ƃ����邽�߁C���Ӑ[�������J���V�E���Z�x�̃��j�^�����O���K�v�ł���B�������C�����̖�܂͊{���iantiresorptive agent-related osteonecrosis of the jaw�FARONJ�j�Ȃǂ̓����I�ȗL�Q���ۂ�L���Ă���C���É���ɂ�芳��QOL �Ȃ����Ƃ̂Ȃ��悤�ɓK�Ȕz�����K�v�ł���i�x���Ö@�FCQ3�j�B�܂��C������זE�͕��ː�������r�I�ǍD�ł��邽�߁C���ǐ��̗n���a�ς�a�I���ܕ��̏��ɂ�ړI�Ƃ����ꍇ��C�Ґ����邢�͐_�o���̈��������O�����ő̕a�ςɑ��Ă͋Ǐ����ː��Ǝ˂��L���ł���B����ɁC������ɍ��p�x�ɂ݂��鍇���ǂł���t��Q�i�x���Ö@�FCQ4�j�C����������ю��Ö�̕���p�Ƃ��Č���₷�������ǁi�x���Ö@�FCQ5�j�C�����_�o��Q�i�x���Ö@�FCQ6�j�⌌���ǁi�x���Ö@�FCQ7�j�ɑ���\�h��x���Ö@�ȂǁC���ߍׂ����z�����K�v�ƂȂ�B
�i���jCQ�ԍ��i�s���N�F�����j���N���b�N����ƁC�����ʂֈړ����܂�
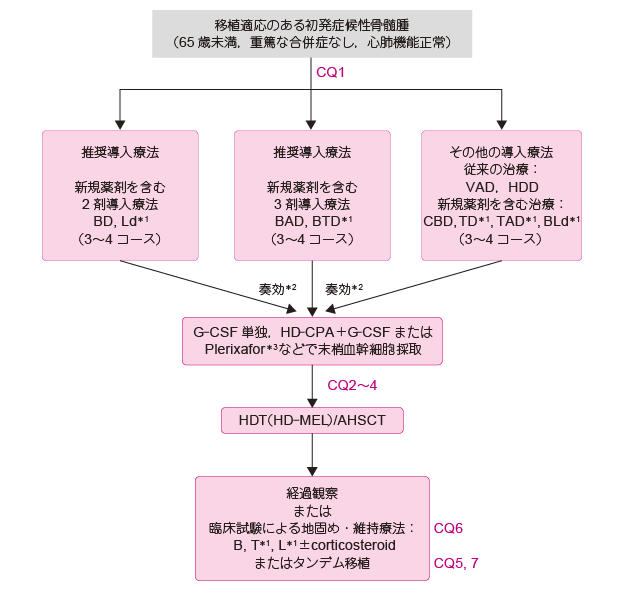
*1 �����K���O
*2 �����Ö@�ɂĔ�t���̏ꍇ��,�����Ö@�̕ύX,���邢�͍Ĕ��E���ɑ��鎡�Â�I��
*3 ���������F
M(MEL): melphalan, P : prednisolone, B : bortezomib, T : thalidomide, L : lenalidomide,
C(CPA): cyclophosphamide, V : vincristine, A : doxorubicin, D : dexamethasone,
HDD : high-dose dexamethasone, d : low-dose dexamethasone, HDT : high-dose therapy,
AHSCT : autologous hematopoietic stem cell transplantation
1.�ڐA�K���̂��鏉���nj������
65 �Ζ����ŏd�v����@�\�̕ێ�����Ă��鏉��������҂ɑ��ẮC���ʂ��v���Ő[���t�������҂ł��C�����Ƒ������זE�̎�����Ɉ��e����^���Ȃ������Ö@���{�s�i�ڐA�K�����ҁFCQ1�C�G�r�f���X���x��1iiDiv�j��C���Ƒ������זE�ڐA�p�������MEL �Ö@�����{���邱�Ƃ����������i�ڐA�K�����ҁFCQ2�CCQ3�CCQ4�C�G�r�f���X���x��1iiA�j�B�ڐA�K�����҂ɑ��铱���Ö@�Ƃ���MEL �Ȃǂ̃A���L�����܂�i���h�~�h�iLEN�j�̒������^���{�s����ƁC�������זE�̎�����̒ቺ�ɂȂ��邱�Ƃ��m���Ă��蒍�ӂ��K�v�ł���B���������Ö@�Ƃ��ẮC�����t�����������҂ł���{���e�]�~�u�iBOR�j�ƃf�L�T���^�]���iDEX�j���p�̓����Ö@�iBD �Ö@�j������C3�`4 �R�[�X�{�s��Ɏ��Ɩ��������זE�̎�ƕۑ����s���B��荂�����ʂ����҂ł��铱���Ö@�Ƃ��āC�V�K��܂��܂�3 �ܕ��p�Ö@�ł���CBD �Ö@�mBD�{�V�N���z�X�t�@�~�h�iCPA�j�n��BAD �Ö@�mBD�{�h�L�\���r�V���iDXR�j�n�����邪�C�����ɓŐ����������邱�Ƃɗ��ӂ��ׂ��ł���B�t��Q���Ă��Ă�BOR �͎g�p���₷����܂ł���B�������C�x�̊Ԏ��e�▖���_�o��Q�����݂���ꍇ�Ȃǂ�BOR �ɂ��Ő������O�����ꍇ�ɂ́C����܂ŕW���I�ɗp����ꂽVAD �Ö@�iVCR, DXR, DEX�j����DEX �Ö@�ihigh-dose dexamethason�FHDD�j�Ȃǂ��I�����ƂȂ�B���Ɩ������������זE�́CG-CSF �P�Ƃ܂���CPA ��ʗÖ@��G-CSF �p���č̎悵�CCD34 �z���זE��2�~106 ��/���ґ̏d�ikg�j�ȏ�̑������זE�邱�Ƃ�ڕW�Ƃ������ۑ����Ă����B���MEL �Ö@�͒ʏ�200 mg/m2 ��2 ���Ԃɕ����ē��^���邪�C�t��Q������ꍇ�ɂ�70���Ɍ��ʂ���B2 ���ڂ̑��MEL ���^�̗��X���ɓ������Ă��������Ɩ������������זE���}���𓀂��ėA������B��������̐V�K��܂̎g�p�ɂ����MEL �Ö@���s�����ƂȂ������̖������������Ԃ������邩�ǂ����̗Տ������������s���Ă��邪�C�����̌��ʂ����炩�ɂȂ�܂ł͑��MEL �Ö@��65 �Ζ����̊��҂ɑ���W�����Âł���B1 ��ڂ̈ڐA��̌��ʂ��ŗǕ����t���iVGPR�j�����̊��҂ɂ����ẮC2 ��ڂ̈ڐA�i�^���f���ڐA�j�����{���邱�ƂŖ������������ԁiPFS�j��S�������ԁiOS�j�̉������ʂ������邱�Ƃ�������Ă���i�ڐA�K�����ҁFCQ5�C�G�r�f���X���x��2A�j�B�������ŋ߂̉��Ă̗Տ������ł́C1 ��ڂ̈ڐA��̒n�łߗÖ@��ێ��Ö@�Ƃ��ĐV�K��܂��g�p����Ă���CPFS �̉������ʂɉ����āC�ꕔ�̗Տ������ɂ����Ă�OS �̉������ʂ�������Ă���i�ڐA�K�����ҁFCQ6�C�G�r�f���X���x��1iiDiii�j�B�������C������̖�܂�p�����ꍇ�����K���^�@�i���^�ʁC���^���W�����Ⓤ�^���ԂȂǁj�͊m������Ă��炸�C�Տ������ł̎��{���]�܂����B���������āC����Տ��ɂ����Ă̒n�łߗÖ@��ێ��Ö@�́C��ܑϐ��������̔��ǂ��܂߂��L�Q���ۂ̃��X�N�Ɗ��җ��v�C�����Ĉ�Ìo�ϓI�ȑ��ʂ��悭�l���Ď��{���邩�ǂ��������肷��K�v������B����Ɏ�����ڎw���āC���Ƒ������זE�ڐA��ɍ�����j��I���푢�����זE�ڐA�i�~�j�ڐA�j�����{����헪�����݂��Ă��邪�C���i�K�ł͌����I���Â̈���o���C�Տ������Ƃ��Ă̎��{�����������i�ڐA�K�����ҁFCQ7�j�B
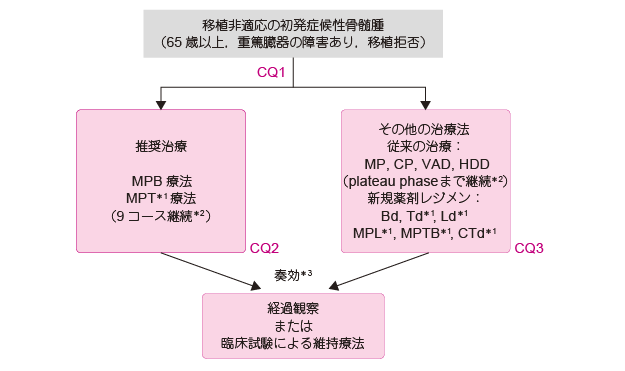
*1 �����ی��K���O
*2 �]���̉��w�Ö@�̓v���g�[�܂Ōp�����ďI�����邪,�V�K��܃��W�����ł͎��K���^���ԂɊւ���G�r�f���X�͂Ȃ��B
*3 �����Ö@�ɂĔ�t���̏ꍇ��,�����Ö@�̕ύX,���邢�͍Ĕ��E���ɑ��鎡�Â�I��
B:�Ԏ����x��,�d�ĂȖ����_�o��Q��L����ꍇ�͕s�K
L:�����ǂ�i�s���̐t��Q��L����ꍇ�͕s�K
T:�����ǂ�d�ĂȖ����_�o��Q��L����ꍇ�͕s�K
2.�ڐA��K���̏����nj������
�ڐA��K�����҂ɑ���W�����Â͌��݁CMPB �Ö@�iMEL, PSL, BOR�j��������MPT �Ö@�iMEL, PSL, THAL�j�Ȃǂł���C40 �N�ȏ�ɂ킽���ĕW�����Âł�����MP �Ö@�iMEL, PSL�j�ɔ䂵��PFS �̉������ʂ݂̂łȂ�OS �̉������ʂ�������Ă���i�ڐA��K���̖����Í�����FCQ1�C�G�r�f���X���x��1iiA�j�B�č��ɂ����Ă�LEN�{����DEX ���p�Ö@�iLd�j�̗L����������Ă��邪�CMP �Ö@������MPT �Ö@�Ƃ̃����_������r�����̌��ʂ����ł���C�����ȈӖ��ŕW�����ÂƂ͔F������Ă��Ȃ��B���ҔN��▖���_�o��Q�C�����ǂȂǂ̃��X�N��x�̊Ԏ��e�̍����̗L���Ȃǂ��l�����ď]����MP �Ö@�Ȃǂ̒ʏ�ʉ��w�Ö@�̑I����������BMPB �Ö@��MPT �Ö@�ł́C�ʏ�9 �R�[�X�܂Ōp�����邱�Ƃ�ڕW�Ƃ��邪�C���Ìp�����Ԃ��r���������Տ������͑��݂��Ȃ��BMP �Ö@�ő�\�����]���̉��w�Ö@�̏ꍇ�́C�v���g�[�m����iSD�j/�s�ρiNC�j�ȏ�̌��ʔ��肪�Ȃ��ꂽ���_���K���ɂ���M �`���ʓ��̌v���l�̕ω����}25���ȓ���3 �J���ȏ�p�������ꍇ�n�Ɏ���܂Ōp�����Ď��Â��I�����邱�Ƃ���ʓI�ł���C����ȏ�̎��Ìp���͊��җ��v�Ɍ��т��Ȃ����Ƃ�������Ă���i�ڐA��K���̖����Í�����FCQ2�C�G�r�f���X���x��1iiA�j�B�܂��CLEN ��THAL �Ȃǂ̖Ɖu���ߖ�́CDEX �Ƃ̕��p�ɂ�葊����ʂ����҂ł��邪�C����҂ɑ�����DEX �̓��^�͊����ǂ⌌���ǂ�U�����邱�Ƃ�������Ă���C�N��ɉ��������ʂ����߂���i�ڐA��K���̖����Í�����FCQ3�C�G�r�f���X���x��1iiA�j�B�ڐA��K�����҂ɑ��铱���Ö@��̈ێ��Ö@�ɂ��ẮC�������������Ԃ̉������ʂ������������ʂ�������̂́COS �̉������ʂ���������K�͎����͏��Ȃ��C���{����ꍇ�͗Տ������̔��e�ōs�����Ƃ����߂���B
�y������������ �A���S���Y���@��1.1 �ŒNjL�R�����g�z
FIRST �����ł́A����Ld�Ö@��MPT �Ö@�ɔ䂵�A�S�t�����A�t���̎��APFS ���L�ӂɗǂ����тł���A����QOL �̌���Ɋ�^���邱�Ƃ����҂ł��邽�ߐ��������12�j�B
*1 ���ƈڐA����܂ށB
*2 �~���Ö@�̑I��:①���ÏI�������� 6 �J���ȏ�o�ߌ�̍Ĕ��E�ĔR�ł����,���Â��ēx���݂Ă��悢�B②���ÏI�������� 6 �J�������̍Ĕ��E�ĔR�ɑ��Ă�,�{���e�]�~�u,���i���~�h�~,�T���h�}�C�h�𒆐S�Ƃ������ÈȊO�̋~���Ö@��I������B
*3 ���Ƒ������זE�ڐA�� 55 �Ζ���,���f����2 �~�N���O���u���� 2.5 mg/L ����,�ڐA��t������ 9 �J���ȏ�,CR ���B��Ȃǂ̗�ŗL����������Ă���B
BOR-based BOR/IMiD-based LEN-based THAL-based ���̑� |
BOR�iB�j�Fbortezomib, LEN�iL�j�Flenalidomide, THAL�iT�j�Fthalidomide,
DEX : dexamethasone, PLD�Fpegylated liposomal doxorubicin,
DXR�iA�j�Fdoxorubicin, CPA�Fcyclophosphamide, ETP�Fetoposide, CDDP : cisplatin
*1 PLD, ETP, CDDP, bendamustine : �����K���O
*2 �킪���ɂ����đ�Ⅰ�����������{����Ă��Ȃ����p�Ö@�ɂ��ẮC�����Ƃ��Ď{��IRB �̋�����Ŕ팯�҂��當���ɂ�铯�ӂĎ��{����B
3�D�Ĕ��E����������
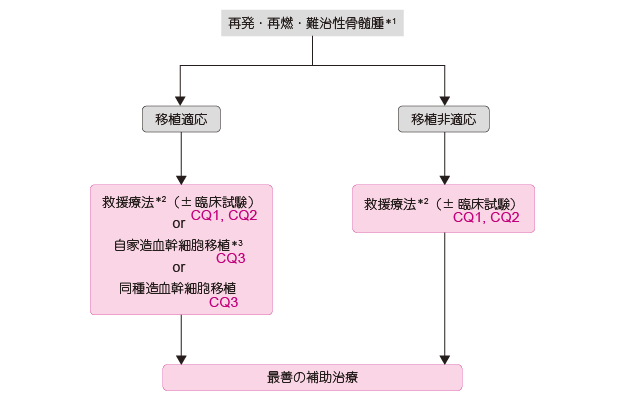
�Ĕ��E���ɑ��ẮC���Â̍ŏI���^������6 �J���ȏ�o�߂��Ă���̍Ĕ��E�ĔR�ł���Ώ����Ö@�ɑ��銴��L���Ă���ꍇ�������C�����Ö@���ēx���݂Ă��悢���C�V�K��܂��܂ގ��Ã��W�����ɕύX���Ă��悢�i�Ĕ��E���������FCQ1�CCQ2�C�G�r�f���X���x��1A�j�B���ÏI����6 �J�������̍Ĕ��E�ĔR�⎡�Ò��̐i�s����̏ꍇ�C������t�i4;14�j�]���Ȃǂ̍����X�N���F�̕a�^��L����ꍇ�ɂ́C�V�K��܂��܂ދ~�����w�Ö@�̑I�������������i�\7�j�B��ܑI���ɂ����Ă͑O���Ã��W�����⊳�҂̗L���鍇���ǂ��@�\��Q�̗L���Ȃǂ��l������K�v������B�ڐA�K���̂���60 �Ζ����̊��҂ɂ����ẮC�~���Ö@���t�������ꍇ�ɂ�2 ��ڂ̎��Ƒ������זE�ڐA���p�̑��MEL �Ö@���s���Ƃ����I��������i�Ĕ��E���������FCQ3�C�G�r�f���X���x��3iiiA�j�B���l�ɋ~���Ö@���t������HLA �K���h�i�[������ꍇ�ɂ́C���푢�����זE�ڐA�Ƃ����I���������邪�C�ڐA�㑁���̎��S���������Ĕ��E�ĔR�����p�x�ł��邱�Ƃ���C�Տ������̔��e�ōs���邱�Ƃ��]�܂����i�Ĕ��E���������FCQ3�j�B
�Q�l����
1�j Kyle RA, et al. A long-term study of prognosis in monoclonal gammopathy of undetermined significance. N Engl J Med. 2002 ; 346�i8�j : 564-9.
2�j Rajkumar SV, et al. Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood. 2005 ; 106�i3�j : 812-7.
3�j Kyle RA, et al. Clinical course and prognosis of smoldering �iasymptomatic�j multiple myeloma. N Engl J Med. 2007 ; 356�i25�j : 2582-90.
4�j Dispenzieri A, et al. Immunoglobulin free light chain ratio is an independent risk factor for progression of smoldering�iasymptomatic�j multiple myeloma. Blood. 2008 ; 111�i2�j : 785-9.
5�j Weber DM. Solitary bone and extramedullary plasmacytoma. Hematology Am Soc Hematol Educ Program. 2005 ; 373-6.
6�j Martinez-Lopez J, et al. Long-term prognostic significance of response in multiple myeloma after stem cell transplantation. Blood. 2011 ; 118�i3�j : 529-34.
7�j Harousseau JL, et al. Achievement of at least very good partial response is a simple and robust prognostic factor in patients with multiple myeloma treated with high-dose therapy : Long-term analysis of the IFM99-02 and 99-04 trials. J Clin Oncol. 2009 ; 27�i34�j : 5720-6.
8�j Gay F, et al. Complete response correlates with long-term progression-free and overall survival in elderly myeloma treated with novel agents : analysis of 1175 patients. Blood. 2011 ; 117�i11�j : 3025-31.
9�j Berenson JR, et al. Efficacy of pamidronate in reducing skeletal events in patients with advanced multiple myeloma. Myeloma Aredia Study Group. N Engl J Med. 1996 ; 334�i8�j : 488-93.�i1iDiii�j
10�j Morgan GJ, et al. First-line treatment with zoledronic acid as compared with clodronic acid in multiple myeloma�iMRC Myeloma IX�j : a randomized controlled trial. Lancet. 2010 ; 376�i9757�j : 1989-99.�i1iiA�j
11�j Henry DH, et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastasis in patients with advanced cancer �iexcluding breast and prostate cancer�j or multiple myeloma. J Clin Oncol. 2011 ; 29�i9�j : 1125-32.�i1iC�j
�y��1.1�ŒNjL�z
12�j Benboubker L, et al. Lenalidomide and dexamethasone in transplant-ineligible patients with myeloma. N Engl J Med. 2014; 371(10):906-17.�i1iiDiii)
�y���nj�����z
| CQ1 | ���nj�����҂ɑ��Đf�f�㒼���ɉ��w�Ö@�����{���邱�Ƃ͑Ó��� |
|---|
-
�����O���[�h�J�e�S���[4
- ���nj�����҂ɑ��Đf�f�㒼���ɉ��w�Ö@�����{���邱�Ƃ́C�����Q�������܂ʼn��w�Ö@�̊J�n��҂헪�ɔ�ׂāC�������Ԃ̉������ʂ͔F�߂�ꂸ�C�����X�N�Q��ΏۂƂ����Տ������ȊO�ł̎��{�͐�������Ȃ��B
�y�� ���z
���nj�����iasymptomatic myeloma�j�̐f�f��C�����Ɏ��É�����s���ꍇ�iinitial therapy�FIT�j�Ƒ����܂ő҂��Ă��牻�w�Ö@���s���ꍇ�ideferred therapy�FDT�j�̃����_������r�������s���Ă���1�j2�j�B
- ①���w�Ö@�F���nj�Durie & Salmon�iD&S�j���ނ̕a��Ⅰ�ɑ�������50 ���̍�����҂�IT �Q��DT �Q�Ƀ����_��������MP �Ö@�iMEL, PSL�j���s���������ł́CDT �Q�ɂ����鎡�ÊJ�n�܂ł̊��Ԓ����l��12 �J���ł�����1�j�B���Q�Ԃ̑t�������C�t�����ԁC�������Ԃɂ͗L�ӂȍ���F�߂Ȃ������BD&S �a��Ⅰ�̍������145 ���i88���͖��njj��2 �Q�Ƀ����_��������MP �Ö@���s���������ł́C65 �J���̃t�H���[�A�b�v��DT �Q�Ɋ���t����ꂽ���҂�48���������̂��ߎ��Â��J�n���C�����܂ł̊��Ԃ̒����l��13 �J���ł�����2�j�B�������Ԓ����l�iMST�j��IT �Q��64 �J���CDT �Q��71 �J���ƗL�Ӎ��͔F�߂Ȃ������ip��0.64�j�B
- ②�Ɖu���ߖ�FTHAL ���^�̑�Ⅲ������������Ă���C�nj�����Ɏ���܂ł̊��ԁiPFS�j�͉������邪OS �����ɂ͊�^���Ȃ������iWitzig TE, Leukemia 2013 ; 27 : 220-25. 1iiDiii�j�B�����X�N�̖��nj�����҂�ΏۂƂ���LEN�{DEX �Ö@�Q�Ɩ����Ìo�ߊώ@�Q�̃����_������r���������{����C�nj�����Ɏ���܂ł̊��ԁiPFS�j���������COS �Ɋւ���x�l�t�B�b�g�ɂ���^����Ƃ̕��Ȃ���Ă��邪�C�{�����̑Ώۊ��҂͋ɂ߂č����X�N�̖��nj�����҂ł��邱�Ƃɒ��ӂ��K�v�ł���3�j�B
���nj�����ɑ��鎡�É���́C�����_�ł͏nj�����ւ̐i�W�����X�N�Q��ΏۂƂ����Տ������̔��e�ł̎��{�Ɍ��肳���ׂ��ł���B
�y�Q�l�����z
1�j Hjorth M, et al. Initial versus deferred melphalan-prednisone therapy for asymptomatic multiple myeloma stage Ⅰ ? A randomized study. Eur J Haematol. 1993 ; 50�i2�j : 95-102.�i2A�j
2�j Riccardi A, et al. Long-term survival of stage I multiple myeloma given chemotherapy just after diagnosis or at progression of the disease : a multicenter randomized study. Br J Cancer. 2000 ; 82�i7�j : 1254-60.�i1iiA�j
3�j Mateos M-V, et al. Lenalidomide plus dexamethasone for high-risk smoldering multiple myeloma. New Engl J Med. 2013 ; 369�i5�j : 438-47.�i1iiDiii/1iiA�j
| CQ2 | ���nj�����҂ɑ���r�X�z�X�z�l�[�g���܂̓��^�͑Ó��� |
|---|
-
�����O���[�h�J�e�S���[3
- ���nj�����ɑ���r�X�z�X�z�l�[�g���܂̓��^�́C�������̍��֘A���ۂ̍����p�x�����������邪�C�nj�����Ɏ���܂ł̊��Ԃ�����Ԃ�������������ʂ͔F�߂�ꂸ�C�ϋɓI�ȓ��^�͐�������Ȃ��B
�y�� ���z
���nj�����҂�ΏۂƂ����]���h�����_4 mg �̌�1 ���1 �N�Ԃ̓��^�Q�Ɩ����ÌQ�̃����_������Ⅲ����r�����in��163�j�ƁC�p�~�h���l�[�g60�`90 mg �̌�1 ���1 �N�Ԃ̓��^�Q�Ɩ����ÌQ�̃����_������Ⅲ����r�����in��177�j�����{����Ă���1�j2�j�B1 �N�Ԃ̃r�X�z�X�z�l�[�g���܂̓��^�͎��{�\�ȃ��W�����ł��邪�C������̎����ł���v�]�����ڂł��鑟���Q�̏o���Œ�`�����nj�����ւ̐i�W�܂ł̊��ԁiTTP�j��S�������ԁiOS�j�ɂ͗L�Ӎ��͂Ȃ������B�nj�����ֈڍs���̕n���C�t��Q�␑�O��ᎌ`���Ȃǂ̔����p�x�ɂ͗��Q�Ԃł̍��͔F�߂��Ȃ��������C���֘A���ہiskeletal-related events�FSRE�j�̔������̓r�X�z�X�z�l�[�g���^�Q�ŗL�ӂɌ������邱�Ƃ�������Ă���i�]���h�����_55.5�� vs 78.8���Fp��0.041�C�p�~�h���l�[�g39.2�� vs 72.7���Fp��0.009�j�B���݃C�^���A�O���[�v�ɂ��C���nj�����҂ɑ���2 �N�Ԃ̃]���h�����_���^�Ɩ����ÌQ�̃����_������r�������i�s���ł���B
�y�Q�l�����z
1�j Musto P, et al. A multicenter, randomized clinical trial comparing zoledronic acid versus observation in patients with asymptomatic myeloma.Cancer. 2008 ; 113�i7�j : 1588-95.�i1iiDiii�j
2�j D'Arena G, et al. Pamidronate versus observation in asymptomatic myeloma : final results with long-term follow-up of a randomized study. Leuk & Lymphoma. 2011 ; 52�i5�j : 771-5.�i1iiDiii�j
�y�ڐA�K���̂��鏉���nj�����z
| CQ1 | ��N�ҏnj�����҂ɂ�����ڐA��O��Ƃ��������Ö@�ł͉������߂��邩 |
|---|
-
�����O���[�h�J�e�S���[1
- �ڐA��O��Ƃ��������Ö@�Ƃ��ă{���e�]�~�u���܂ރ��W�����C���i���h�~�h���܂ރ��W���������������B
�y�� ���z
���Ƒ������זE�ڐA�K���Ǘ�ɂ����鏉�����ÂƂ��āC�{���e�]�~�u�iBOR�j��i���h�~�h�iLEN�j�Ȃǂ̐V�K��܂�p���������Ö@�����������BBD �Ö@�iBOR, DEX�j��BAD �Ö@�iBOR, DXR, DEX�j ��VAD �Ö@�iVCR, DXR, DEX�j �Ƃ̔�r�ŁCBTD �Ö@�iBOR, THAL,DEX�j ��TD �Ö@�iTHAL, DEX�j �Ƃ̔�r�Ŋ�������ю��ƈڐA��̍ŗǕ����t���iVGPR�j�ȏ�̑t���������L�ӂɗD��Ă���1�j2�j�BBTD �Ö@��TD �Ö@�ɔ��grade 3 �ȏ�̖����_�o��Q�iperipheral neuropathy�FPN�j���L�ӂɑ������CBOR ��THAL �̗p�ʂ����ʂ���btD ��BD �Ƃ̔�r�ňڐA���VGPR �ȏ�̑t�������͗L�ӂɍ����C���grade 2 �ȏ��PN �͗L�ӂɏ��Ȃ�����3�j�BLEN �ɂ��Ă�LD �Ö@�iLEN, DEX�j��DEX ��ʂ��L�ӂɗD��4�j�C�����LEN �ƍ��p��DEX�iLD�j��LEN �ƒ�p��DEX�iLd�j�̔�r�ŁC4 �R�[�X���PR �ȏ�̑t��������LD ���L�ӂɗD��Ă������C1 �NOS ��Ld ���L�ӂɗD��Ă���5�j�BTHAL �ɂ��ẮCTAD �Ö@�iTHAL, DXR, DEX�j��VAD �Ö@�Ƃ̔�r�Ŏ��ƈڐA���VGPR �ȏ�̑t��������TAD �Ö@���D��Ă������CCTD �Ö@�iCPA, THAL, DEX�j��CVAD �Ö@�iCPA, VCR, DXR,DEX�j�̔�r�ł͎��ƈڐA���VGPR �ȏ�̑t�������ɗL�Ӎ��͂Ȃ�����6�j7�j�B���̑��CCBD �Ö@�iCPA, BOR, DEX�j��BLD �Ö@�iBOR, LEN, DEX�j�̕��݂��邪�C��Ⅲ�������͂̕Ȃ��B�ȏ���CBD�CBAD�CBT�ibt�jD�CLd �Ö@�����������B�Ȃ��C�{�M�ł͐V�K��܂̏�����ɑ���ی��K�p��BOR �Ɍ�����B
�y�Q�l�����z
1�j Harousseau JL, et al. Bortezomib plus dexamethasone is superior to vincristine plus doxorubicin plus dexamethasone as induction treatment prior to autologous stem-cell transplantation in newly diagnosed multiple myeloma : Results of the IFM2005-01 trial. J Clin Oncol. 2010 ; 28�i30�j : 4621-9.�i1iiDiv�j
2�j Cavo M, et al. Bortezomib with thalidomide plus dexamethasone compared with thalidomide plus dexamethasone as induction therapy before, and consolidation therapy after, double autologous stem-cell transplantation in newly diagnosed multiple myeloma : a ransomized phase Ⅲ study. Lancet. 2010 ; 376�i9758�j : 2075-85.�i1iiDiv�j
3�j Moreau P, et al. Bortezomib plus dexamethasone versus reduced-dose bortezomib, thalidomide plus dexamethasone as induction treatment prior to autologous stem cell transplantation in newly diagnosed multiple myeloma. Blood. 2011 ; 118�i22�j : 5752-8.�i1iiDiv�j
4�j Zonder JA, et al. Lenalidomide and high-dose dexamethasone compared with dexamethasone as initial therapy for multiple myeloma : a randomized Southwest Oncology Group�iS0232�j. Blood. 2010 ; 116�i26�j : 5838-41.�i1iiDiii�j
5�j Rajkumar SV, et al. Lenalidomide plus high-dose dexamethasone versus lenalidomide plus low-dose dexamethasone as initial therapy for newly diagnosed multiple myeloma : an open-label randomized controlled trial.Lancet Oncol. 2010 ; 11�i1�j : 29-37.�i1iiDiv�j
6�j Lokhorst HM, et al. A randomized phase 3 study on the effect of thalidomide combined with adriamycin, dexamethasone, and high-dose melphalan, followed by thalidomide maintenance in patients with multiple myeloma. Blood. 2010 ; 115�i6�j : 1113-20.�i1iiDi/1iiDiv�j
7�j Morgan GJ, et al. Cyclophosphamide, thalidomide, and dexamethasone as induction therapy for newly diagnosed multiple myeloma patients destined for autologous stem-cell transplantation : MRC Myeloma IX randomized trial results. Haematologica. 2012 ; 97�i3�j : 442-50.�i1iiDiv�j
| CQ2 | ��N�ҏnj�����҂ɑ��鎩�Ƒ������זE�ڐA���p��ʃ����t�@�����Ö@�͒ʏ�ʉ��w�Ö@�Ɣ�ׂĐ������Ԃ����������邩 |
|---|
-
�����O���[�h�J�e�S���[1
- ��N�ҏnj�����҂ɑ��Ď��Ƒ������זE�ڐA���p��ʃ����t�@�����Ö@�͒ʏ�ʉ��w�Ö@�Ɣ�ׂĖ������������Ԃ����������邱�Ƃ��琄�������B
�y�� ���z
65 �Ζ����̎�N�ҍ������ΏۂƂ������Ƒ������זE�ڐA���p��ʉ��w�Ö@�ihigh-dose chemotherapy with autologous hematopoietic stem cell transplantation�FHDC/AHSCT�j�ƒʏ�ʉ��w�Ö@�Ƃ̑�Ⅲ����r��������������Ă���B���̌��ʁCHDC/AHSCT �͊��S�t���iCR�j�����C���C�x���g�������ԁiEFS�j�C�S�������ԁiOS�j�̂������HDC/AHSCT ���D��Ă���1�j�`3�j�B�������C���̌���ꂽUS Intergroup �ɂ��S9321 ����4�j��PETHEMA ����5�j�ł́CHDC/AHSCT �ƒʏ�ʉ��w�Ö@��OS �△�����������ԁiPFS�j�ɕK�������L�Ӎ��݂͂��Ă��Ȃ��BS9321 �����ł́C���w�Ö@�Q��IFM90 ����1�j��MRCVII ����2�j�Ɣ�r����苭�͂ł���VBMCP �Ö@�iVCR, BCNU, MEL, CPA, PSL�j�ƃV�N���t�H�X�t�@�~�h��ʗÖ@�ōs���C����ł́C�ڐA�Q�ɂ�����ڐA�O���u�i�S�g�Ǝ˂��܂ރ��W�����j���ォ�����\�����w�E����Ă���B����ɁC���w�Ö@�Q��52�����Ĕ��E�������Ɏ��ƈڐA���Ă���C���̌���OS �ŗL�Ӎ����݂��Ȃ������\�����l������4�j�BPETHEMA �����͏������Âɑt�������Ǘ�������_�������Ă���Ƃ����_��IFM90�CMRC Ⅶ �����ƈقȂ��Ă���5�j�B
����C�����̎������܂�9 �̃����_������r�����ɂ��2,411 ��̃��^�A�i���V�X������Ă���B�Ώ۔N���70 �܂łƂ����������܂܂�Ă��邪�CHDC/AHSCT ��OS �ŕW���ʉ��w�Ö@�ƍ��͂Ȃ��������CPFS �ŗL�ӂɗD��Ă���6�j�BOS �ō����݂��Ȃ��������Ƃ͍Ĕ�����HDC/AHSCT �ɂ��T���x�[�W���ʂŐ�������Ă���B�ȏ���C65 �Ζ����̎�N�҂ɂ�����HDC/AHSCT �́C�ʏ�ʉ��w�Ö@���PFS ������������ƍl����ꐄ���ł���B�������C���Ê֘A���S�iTRM�j�̃��X�N���㏸����̂Œ��ӂ�v����B
�y�Q�l�����z
1�j Attal M, et al. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. N Engl J Med.1996 ; 335�i2�j : 91-7.�i1iiA�j
2�j Child JA, et al. High-dose chemotherapy with hematopoietic stem-cell rescue for multiple myeloma. N Engl J Med. 2003 ; 348�i19�j : 1875-83.�i1iiA�j
3�j Palumbo A, et al. Intermediate-dose melphalan improves survival of myeloma patients aged 50 to 70 : results of a randomized controlled trial. Blood. 2004 ; 104�i10�j : 3052-7.�i1iiA�j
4�j Barlogie B, et al. Standard chemotherapy compared with high-dose chemoradiotherapy for multiple myeloma : Final results of phase Ⅲ US intergroup trial S9321. J Clin Oncol. 2006 ; 24�i6�j : 929-36.�i1iiA�j
5�j Bladé J, et al. High-dose therapy intensification versus continued standard chemotherapy in multiple myeloma patients responding to the initial chemotherapy : Long term results from a prospective randomized trial from the Spanish cooperative group PETHEMA. Blood. 2005 ; 106�i12�j : 3755-9.�i1iiA�j
6�j Koreth J, et al. High-dose therapy with single autologous transplantation versus chemotherapy for newly diagnosed multiple myeloma : A systematic review and meta-analysis of randomized controlled trials. Biol Blood Marrow Transplant. 2007 ; 13�i2�j : 183-96.�i1iiDiii�j
| CQ3 | ��N�ҏnj�����҂ɑ��Ċ����㑁���Ɏ��Ƒ������זE�ڐA���s�����Ƃ͍Ĕ����ɈڐA���s���������߂��邩 |
|---|
-
�����O���[�h�J�e�S���[1
- ��N�ҏnj�����҂ɑ��Ċ����㑁���Ɏ��Ƒ������זE�ڐA���s�����Ƃ͍Ĕ����ɈڐA���s���ꍇ�Ɣ�ׂĖ��Ǐ�E�����Â�����p�̂Ȃ����Ԃ����������邱�Ƃ��琄�������B
�y�� ���z
���ƈڐA�������Ö@�㑁���Ɏ��{���ׂ����C�Ĕ����Ɏ��{���ׂ�����ׂŔ�r���������������t�����X�������Ă���1�j�B�{�����ł�OS �ɂ͍��݂͂��Ȃ����C�����Ɏ��{���邱�ƂŖ��C�x���g�������ԁiEFS�j�i39 �J�� vs 13 �J���j�����TWiSTT�iTime without symptoms�Ctreatment�Cand treatment toxicity�F�����Â�����p�Ȃ����Ǐ�̊��ԁj�i27.8 �J�� vs22.3 �J���j���������邱�Ƃ�������Ă���B����C���ƈڐA�ƒʏ�ʉ��w�Ö@�Ƃ̃����_������r�����ł���US S9321 �����ɂ����ė��Q�Ԃ�OS �ɍ��݂͂��Ȃ��������C����͉��w�Ö@�Q�ł��Ĕ����ɑ��������ƈڐA�������Ƃɂ��ƍl�����C���̂��Ƃ͍Ĕ����̈ڐA���L�p�ł��邱�Ƃ������Ă���2�j�B���ƈڐA�ƒʏ�ʉ��w�Ö@�Ƃ̃����_������r�����̃��^�A�i���V�X�ł����l�̂��Ƃ��w�E����Ă���3�j�B�������C�����ɈڐA���Ȃ��ꍇ�͒����ԉ��w�Ö@���p������邱�ƂɂȂ�C���̌��ʁC�����Q�Ⓑ���̃A���L�����ܔ��I�ɂ��������ٌ`���nj�Q�̃��X�N�����߂邱�ƂɂȂ�B���������āCOS �ɗL�Ӎ����Ȃ��Ƃ������Ɏ��ƈڐA�����{���邱�Ƃ����������B�ߔN�C�{���e�]�~�u��i���h�~�h�Ȃǂ̐V�K��܂�p���������ɂ��t�������̑啝�ȏ㏸���݂��C���ƈڐA�̎��{�����ɂ��Ă�up-front �Ŏ��{����Q�ƐV�K��܂ɂ��n�ł߁E�ێ��Ö@�����{���Ĕ����Ɏ��ƈڐA���s���Q�Ƃ̐V���ȑ�Ⅲ���������i�s���ł���B
�y�Q�l�����z
1�j Fermand JP, et al. High-dose therapy and autologous blood stem cell transplantation in multiple myeloma : Up-front or rescue treatment? Results of a multicenter sequential randomized clinical trial. Blood. 1998 ; 92�i9�j : 3131-6.�i1iiA�j
2�j Barlogie B, et al. Standard chemotherapy compared with high-dose chemoradiotherapy for multiple myeloma : Final results of phase Ⅲ US intergroup trial S9321. J Clin Oncol. 2006 ; 24�i6�j : 929-36.�i1iiA�j
3�j Koreth J, et al. High-dose therapy with single autologous transplantation versus chemotherapy for newly diagnosed multiple myeloma : A systematic review and meta-analysis of randomized controlled trials. Biol Blood Marrow Transplant. 2007 ; 13�i2�j : 183-96.�i1iiDiii�j
| CQ4 | ���Ƒ������זE�ڐA�ɂ�����O���u�Ƃ��đ�ʃ����t�@�����Ö@�͑S�g���ː��Ǝ˂��܂ޑO���u�Ɣ�ׂėD��Ă��邩 |
|---|
-
�����O���[�h�J�e�S���[1
- ���Ƒ������זE�ڐA�ɂ�����O���u�Ƃ��đ�ʃ����t�@�����Ö@�����������B
�y�� ���z
65 �Ζ����̏������ΏۂƂ����t�����X�̃����_���������ł́CVAD �Ö@�iVCR, DXR, DEX�j�ɂ�銰���チ���t�@�����iMEL�j200 mg/m2 �iMEL200�j�Q��MEL 140 mg/m2�{�S�g�Ǝˁi8 Gy�j�Q�Ɋ���t�����Ă���1�j�B���ʂƂ��āC���S�t���iCR�j�����͗��Q�ŗL�Ӎ��݂͂��Ȃ������i35�� vs 29���j��CR�{�ŗǕ����t���iVGPR�j������MEL200 �Q�ŗǍD�Ȍ��ʂł������i55�� vs 43���Cp��0.06�j�B�e�Q20.5 �J����20 �J���̊ώ@���ԂŁC45 �J����̑S���������iOS�j��65.8����45.5����MEL200 �Q���D�ʂɗD��Ă����ip��0.05�j�B����C���C�x���g�������ԁiEFS�j�͂��ꂼ��20.5 �J����20 �J���ŗL�Ӎ��݂͂��Ȃ������B�D���������C���������C���@���ԁC�Ö����R���ܓ��^���Ԃ͂������MEL200 �Q�ŒZ���ip��0.001�j�C��������ѐԌ����A���͂������MEL200 �Q�ŏ��Ȃ������ip��0.001�j�B�������igrade 3�`4�j��MEL200 �Q�ŗL�ӂɏ��Ȃ������i30�� vs 51���Cp��0.001�j�B�ȏ���CMEL 200 mg/m2 ���ڐA�O���u�Ƃ��Đ��������B
MEL200 ����苭���������W�����mMEL200�{�C�_���r�V���iIDR�j42 mg/m2�{�V�N���t�H�X�t�@�~�h�iCPA�j120 mg/kg�n��MEL200 �Ƃ̔�r�����ł��������W�����ŗL�Q���ۂ�����MEL200 �ɏ�����̂ł͂Ȃ�����2�j�B
�X�y�C�������PETHEMA/GEM2000 �����̒��Ńu�X���t�@���iBU�j12 mg/kg�{MEL 140 mg/m2�iBU/MEL�j�����ŏ���225 ������̌��MEL 200 mg/m2 ����542 ��Ɣ�r���Ă��邪�CBU/MEL �Ŋ̒��S�Ö��Ǐǂɂ�鎡�Ê֘A���S�iTRM�j���D�ʂɍ����i8.4��vs 3.5���Cp��0.002�j���ƁC�t�������͓�����PFS �����l�͗L�ӂɒ����i41 �J�� vs 31 �J���Cp��0.009�j��OS �ɍ��͂Ȃ��Ƃ��Ă���3�j�B
�ŋ߁C�{���e�]�~�u�iBOR�j��MEL200 �Ƃ̑g�ݍ��킹����������Ă��邪�C�����_�ł�MEL200 �����������B
�y�Q�l�����z
1�j Moreau P, et al. Comparison of 200 mg/m2 melphalan and 8 Gy total body irradiation plus 140 mg/m2 melphalan as conditioning regimens for peripheral blood stem cell transplantation in patients with newly diagnosed multiple myeloma : Final analysis of the Intergroup Francophone du myelome 9502 randomized trial. Blood. 2002 ; 99�i3�j : 731-5.�i1iiDiv/1iiA�j
2�j Fenk R, et al. High-dose idarubicin, cyclophosphamide and melphalan as conditioning for autologous stem cell transplantation increases treatment-related mortality in patients with multiple myeloma : Results of a randomized study. Br J Haematol. 2005 ; 130�i4�j : 588-94.�i1iiDiv�j
3�j Lahuerta JJ, et al. Busulfan 12 mg/kg plus melphalan 140 mg/m2 versus melphalan 200 mg/m2 as conditioning regimens for autologous transplantation in newly diagnosed multiple myeloma patients included in PETHEMA/GEM2000 study. Haematologica. 2010 ; 95�i11�j : 1913-20.�i3iiiA�j
| CQ5 | ��N�ҏnj�����҂ɑ���2 ��A�����Ƒ������זE�ڐA�i�^���f�����ƈڐA�j���s�����Ƃ�1 ��i�V���O���j�ڐA�Ɣ�ׂĐ������Ԃ����������邩 |
|---|
-
�����O���[�h�J�e�S���[3
- �^���f�����ƈڐA�́C����ڐA�ōŗǕ����t���ɓ��B���Ȃ��Ǘ�ɂ����Ė��C�x���g�����ŃV���O���ڐA���D��邪�C���Ê֘A���S�͑�������B�V�K��܂��o�ꂵ�����݁C�^���f�����ƈڐA�̗L�p���͒ቺ���Ă���B
�y�� ���z
�V���O���ڐA�ƃ^���f���ڐA���r����5 �̗Տ�����������Ă��邪�C�S�������ԁiOS�j�Ń^���f���ڐA���D��Ă����̂�IFM94 �����݂̂ł���1�j�`5�j�B����C���C�x���g�������ԁiEFS�j��4 �̎����Ń^���f���ڐA���D��Ă����B���ɁC����ڐA�ōŗǕ����t���iVGPR�j�iM �`���̌���90���ȉ��j�iIFM94 �����j1�j���邢��near CR �ɓ��B���Ȃ������Ǘ�iBologna96 �����j2�j�Ń^���f���ڐA�̗L�p�������炩�ɂ��ꂽ�B2 ��ڂ̎��ƈڐA�̎����ɂ��Ă�3 �J�����x���߂ǂɎ��{����邱�Ƃ������B����C5 �̔�r�����̃��^�A�i���V�X�ł́C���C�x���g�������Ԃ̓^���f���ڐA�ŗD��Ă����iHR��0.79�j���C��ɓP�ꂽ�`���j�W�A����̕��܂�6 �̔�r�����̃��^�A�i���V�X�ł́C�^���f���ڐA��2 ��ڂ̈ڐA�ɂ����鎡�Ê֘A���S��HR��1.71 �ƍ����Ȃ邱�Ƃ������ꂽ6�j�B���������āC����ڐA��VGPR �B��ɂ����Ă̓^���f���ڐA���l�����Ă悢���C�V�K��܂��g�p�\�ƂȂ������݂ł̓^���f���ڐA�̗L�p���͒ቺ���Ă���B
�y�Q�l�����z
1�j Attal M, et al. Single versus double autologous stem-cell transplantation for multiple myeloma. N Engl J Med. 2003 ; 349�i26�j : 2495-502.�i1iiA�j
2�j Cavo M, et al. Prospective randomized study of single compared with double autologous stem-cell transplantation for multiple myeloma : Bologna 96 clinical study. J Clin Oncol. 2007 ; 25 �i17�j : 2434-41.�i1iiDiv/1iiDi�j
3�j Segeren CM, et al. Overall and event-free survival are not improved by the use of myeloablative therapy following intensified chemotherapy in previously untreated patients with multiple myeloma : A prospective randomized phase 3 study. Blood. 2003 ; 101�i6�j : 2144-51.�i1iiDi�j
4�j Goldschmidt H, et al. Single versus double high-dose therapy in multiple myeloma : second analysis of the GMMG-HD2 study. Hematology J. 2005 ; 90 : 38 PL8.02.�i1iiDiii�j
5�j Fermand JP, et al. Single versus double high dose therapy supported with autologous blood stem cell transplantation using unselected or CD34 enriched ABSC. Results of a two by two designed randomized trial in 230 young patients with multiple myeloma. Hematology J. 2003 ; 4 : S59.�i1iiDiii�j
6�j Kumar A, et al. Tandem versus single autologous hematopoietic cell transplantation for the treatment of multiple myeloma : A systematic review and meta-analysis. J Natl Cancer Inst. 2009 ; 101 �i2�j : 100-6.�i1iiDi�j
| CQ6 | ���Ƒ������זE�ڐA�ɂ�����ڐA��̒n�ł߁E�ێ��Ö@�͐������Ԃ����������邩 |
|---|
-
�����O���[�h�J�e�S���[2B
- �ڐA�㍜����ɑ���n�łߗÖ@�E�ێ��Ö@�̓T���h�}�C�h�ɂ�閳�����������ԁC�S�������Ԃ̉��������҂ł��邪�C�������^�ɂ�閖���_�o��Q�̌��O������B���i���h�~�h�͖������������Ԃ��������邪������̉\������������Ă���B
�y�� ���z
�ڐA�K�����҂ŁC���ƈڐA��ɐV�K��܂ɂ��n�łߗÖ@�C�ێ��Ö@���s�����ƂŁC���S�t���iCR�j�̊l����C�������������ԁiPFS�j�̉��������҂ł���B���ƈڐA��̃T���h�}�C�h�iTHAL�j�ɂ��n�ł߁E�ێ��Ö@�̑�Ⅲ��������5 ����Ă���1�j�`5�j�BIFM9902 �����ł́CTHAL �Q���v���Z�{�Q�ɑ��Ė��C�x���g�������ԁi3 �NEFS�F52�� vs 36���j�C�S�������� �i4 �NOS�F87�� vs 77���j�Ƃ��ɗD��Ă���1�j�B�������C���̌��ʂ͍ŗǕ����t���iVGPR�j�ɒB���Ă��Ȃ��Ǘ�ɂ����Ă̂ݔF�߂��CTHAL ���n�łߗÖ@�I�Ȗ������ʂ����Ă���ƍl������BMRC Myeloma IX �����ł����l�̌��ʂł��邪OS �ɍ��݂͂��Ă��Ȃ�2�j�BALLGMM6 �����ł�12 �J����THAL/PSL ��PSL �P�ƂƂ̔�r�ŁC3 �NEFS�i42�� vs 23���j�COS�i86�� vs 75���j�Ƃ���THAL �Q���D��Ă���3�j�BTT2 �����ł͊�������p���I��THAL �����^����Ă��邪�CEFS ��THAL �Q���D��C8 �NOS ��THAL �Q���D���X�����݂�ꂽ�i57�� vs 44���j4�j�BHOVON �����ł�PFS ��THAL �Q���D���i34 �J��vs 25 �J���j��OS �ł͗L�Ӎ��݂͂��Ȃ������i73 �J��vs 60 �J���j5�j�B������̎����ł�THAL �̒������^�ɂ�镛��p�Ƃ��Ė����_�o��Q�����~���R�̈�ƂȂ��Ă���CNCCN �K�C�h���C���ł�category 1 �Ƃ��Đ������Ă��邪�C�K�������L���������ł͂Ȃ��B
����C���i���h�~�h�iLEN�j�ɂ��ẮCIFM2005-02 �����CCALGB100104 ������PFS �̉������݂��ێ��Ö@�Ƃ��Ă̗L���������ꂽ6�j7�j�B�����CALGB100104 ������OS �̉��������ꂽ���C����œ����㏸����Ƃ̕�����6�j7�j�B���̓_�����m�ɂȂ�܂ňێ��Ö@�Ƃ��Ă̎g�p�͐T�d��v����B
�{���e�]�~�u�iBOR�j�ɂ��Ă�THAL �Ƃ̔�r���s���Ă��邪�C�e�Q�Ŋ����Ö@���قȂ�ێ��Ö@�Ƃ��Ă̕]���͍���ł���8�j�B
�y�Q�l�����z
1�j Attal M, et al. Maintenance therapy with thalidomide improves survival in patients with multiple myeloma. Blood. 2006 ; 108�i10�j : 3289-94.�i1iiDi/1iiA�j
2�j Morgan GJ, et al. The role of maintenance thalidomide therapy in multiple myeloma : MRC Myeloma IX results and meta-analysis. Blood. 2012 ; 119�i1�j : 7-15.�i1iiDiii�j
3�j Spencer A, et al. Consolidation therapy with low-dose thalidomide and prednisolone prolongs the survival of multiple myeloma patients undergoing a single autologous stem-cell transplantation procedure. J Clin Oncol. 2009 ; 27�i11�j : 1788-93.�i1iiA�j
4�j Barlogie B, et al. Thalidomide arm of Total Therapy 2 improves complete remission duration and survival in myeloma patients with metaphase cytogenetic abnormalities. Blood. 2008 ; 112�i8�j : 3115-21.�i1iiDi�j
5�j Lokhorst HM, et al. A randomized phase 3 study on the effect of thalidomide combined with adriamycin, dexamethasone, and high-dose melphalan, followed by thalidomide maintenance in patients with multiple myeloma. Blood. 2010 ; 115�i6�j : 1113-20.�i1iiDi/1iiDiii�j
6�j Attal M, et al. Lenalidomide maintenance after stem-cell transplantation for multiple myeloma. N Engl J Med. 2012 ; 366�i19�j : 1782-91.�i1iiDiii�j
7�j McCarthy PL, et al. Lenalidomide after stem-cell transplantation for multiple myeloma. N Engl J Med. 2012 ; 366�i19�j : 1770-81.�i1iiDiii/1iiA�j
8�j Sonneveld P, et al. Bortezomib induction and maintenance treatment in patients with newly diagnosed multiple myeloma : Results of the randomized phase Ⅲ HOVON-65/GMMG-HD4 trial. J Clin Oncol. 2012 ; 30�i24�j : 2946-55.�i1iiDiii/1iiA�j
| CQ7 | ��N�ҏnj�����҂ɑ���^���f������/ ����i�~�j�j�ڐA�̓^���f������/ ���ƈڐA�Ɣ�ׂĐ������Ԃ����������邩 |
|---|
-
�����O���[�h�J�e�S���[3
- ��N�ҏnj�����҂ɂ����āC�^���f������/ ����i�~�j�j�ڐA�̓^���f������/ ���ƈڐA�Ɣ�ׂėD��Ă���Ƃ̏\���ȍ����͂Ȃ������I���Âł���B
�y�� ���z
��N�ҍ�����ɂ����āC�^���f������/����i�~�j�j�ڐA�ƃ^���f������/���ƈڐA���r����������5 �s���Ă���1�j�`6�j�B���̂����C�C�^���A�̎���2�j��European Group for Blood and Marrow Transplantation�iEMBT�j�̎���4�j�Ń^���f������/����i�~�j�j�ڐA�̗L�p��������Ă��邪�CIFM �̎���1�j����т����Ƃ���K�͂ȕč�����̕�5�j6�j�ł͗��Q�ԂŗL�Ӎ����݂��Ă��Ȃ��B�Ώۂ⓯��ڐA�ɂ�����O���u�������ɂ��قȂ邪�C�^���f������/����i�~�j�j�ڐA�����C�x���g�������ԁiEFS�j�C�S�������ԁiOS�j�Ƃ��ɗD��Ă����Ƃ���C�^���A����̕ł͓���ڐA�O���u��TBI 2 Gy �ƂȂ��Ă���2�j6�j�B�������C���l�̑O���u�ōs��ꂽ�č�����̑�K�͎����̕ł͕W�����X�N�C�����X�N�Q������ɂ����Ă��^���f������/���ƈڐA�Ɠ����̐��тł�����5�j�BEBMT ����̕ł͈ڐA�O���u�̓t���_���r���iFLU�j�{TBI 2 Gy �ł���C���ƈڐA�Q�̓V���O�����邢�̓^���f���ł��������CPFS�COS �Ƃ��Ƀ^���f������/����i�~�j�j�ڐA���D��Ă���4�j�B����CPTHEMA �����ł͎��ƈڐA��near CR �ɓ��B���Ȃ������Ǘ��HLA��v���E�̗L���Ń����_�������Ă��邪�C����ڐA�Q�ō���CR ����PFS ��PFS �̉������݂�ꂽ���̂�OS �ɂ͗L�Ӎ����Ȃ�����3�j�B�ȏ���C�^���f������/����i�~�j�j�ڐA���^���f������/���ƈڐA���OS �ɂ����ėD��Ă���Ƃ͌����Ȃ��B
�y�Q�l�����z
1�j Garban F, et al. Prospective comparison of autologous stem cell transplantation followed by dose-reduced allograft�iIFM99-03 trial�j with tandem autologous stem cell transplantation�iIFM99-04�j in high-risk de novo multiple myeloma. Blood. 2006 ; 107�i9�j : 3474-80.�i2Div�j
2�j Bruno B, et al. A comparison of allografting with autografting for newly diagnosed myeloma. N Engl J Med. 2007 ; 356�i11�j : 1110-20.�i2A�j
3�j Rosiñol L, et al. A prospective PETHEMA study of tandem autologous transplantation versus autograft following by reduced-intensity conditioning allogeneic transplantation in newly diagnosed multiple myeloma. Blood. 2008 ; 112�i9�j : 3591-3.�i2Div�j
4�j Björkstrand B, et al. Tandem autologous/reduced-intensity conditioning allogeneic stem-cell transplantation versus autologous transplantation in myeloma : Long-term follow-up. J Clin Oncol. 2011 ; 29 �i22�j : 3016-22.�i2Diii/2A�j
5�j Krishnan A, et al. Autologous haemopoietic stem-cell transplantation followed by allogeneic or autologous haemopietic stem-cell transplantation in patients with multiple myeloma �iBMT CTN 0102�j : a phase 3 biological assignment trial. Lancet Oncol. 2011 ; 12�i13�j : 1195-203.�i2A�j
6�j Giaccone L, et al. Long-term follow-up of a comparison of nonmyeloablative allografting with autografting for newly diagnosed myeloma. Blood. 2011 ; 117�i24�j : 6721-7.�i2A�j
�y�ڐA��K���̏����nj�����z
| CQ1 | �ڐA��K���̏����nj�����҂ɑ���V�K��ܕ��p�Ö@��MP �Ö@�ɔ�ׂĐ������Ԃ����������邩 |
|---|
-
�����O���[�h�J�e�S���[1
- MP �Ö@�ɐV�K��܁i�T���h�}�C�h�C�{���e�]�~�u�C���i���h�~�h�j�p�������Â�MP �Ö@�ɔ�ׂĖ������������Ԃ���������̂Ő��������B
�y�� ���z
�ڐA��K���̏����nj�����҂ɑ��銰���Ö@�́C�]��MP �Ö@�iMEL, PSL�j���W���Ö@�ł������B�������C�T���h�}�C�h�iTHAL�j��{���e�]�~�u�iBOR�j�Ȃǂ̐V�K��܂��J������CMP �Ö@�ɕ��p����Տ��������s��ꂽ�BTHAL �Ɋւ��ẮC4 ��MPT �Ö@�iMP�{THAL�j��MP �Ö@�̃����_������r�������s��ꂽ�iGIMEMA�CIFM�CNMSG�CHOVON�j1�j�`4�j�BMPT �Ö@�́C���ׂĂ̎����őS�t�������̗D�ʐ����C�܂�3 �̎����Ŗ������������ԁiPFS�j�̗D�ʐ��������ꂽ���C�S�������ԁiOS�j�̗D�ʐ��������ꂽ������IFM �����݂̂ł������B�d��ȍ����ǂł���[���Ö������ǂ̗\�h�͕K�{�ł���BBOR �Ɋւ��ẮCVISTA �����ɂ����āCMPB �Ö@�iMP�{BOR�j��MP �Ö@�ɔ䂵�C�S�t�������CPFS�C�����OS ���L�ӂɗǂ����тł�����5�j�Bupdate ���ꂽ���ʂł́C3 �N����������68.5���ƍ����C�܂��N��C�t��Q�̗L���C�\��s�ǐ��F�́mt (4;14)�Ct (14;16)�Cdel (17p)�n�̗L���ɂ��e������Ȃ������B���i���h�~�h�iLEN�j�Ɋւ��ẮCMM-015 �����ɂ����āCMPL �Ö@�iMP�{LEN�j��MP �Ö@�ɔ䂵�C�t���̑����C�S�t�������C�t���̎��Ƃ��ɗL�ӂɗǂ����тł������B�܂��C65�`75 �̊��҂ɂ����Ă�PFS ���L�ӂɗǂ��������C75 �Έȏ�̊��҂ł͍��͂Ȃ�����6�j�B�ȏ���C����MPT �Ö@��MPB �Ö@��PFS ��L�ӂɉ������C����QOL �̌���Ɋ�^���邱�Ƃ����҂ł��邽�ߐ��������B
�y�Q�l�����z
1�j Palumbo A, et al. Oral melphalan and prednisone chemotherapy plus thalidomide compared with melphalan and prednisone alone in elderly patients with multiple myeloma : randomised controlled trial. Lancet. 2006 ; 367�i9513�j : 825-31.�i1iiDiii�j
2�j Facon T, et al. Melphalan and prednisone plus thalidomide versus melphalan and prednisone alone or reduced-intensity autologous stem cell transplantation in elderly patients with multiple myeloma�iIFM 99-06�j : a randomized trial. Lancet. 2007 ; 370�i9594�j : 1209-18.�i1iiA�j
3�j Waage A , et al. Melphalan and prednisone plus thalidomide or placebo in elderly patients with multiple myeloma. Blood. 2010 ; 116�i9�j : 1405-12.�i1iDiv�j
4�j Wijermans P, et al. Phase Ⅲ study of the value of thalidomide added to melphalan plus prednisone in elderly patients with newly diagnosed multiple myeloma : The HOVON 49 study. J Clin Oncol. 2010 ; 28�i19�j : 3160-6.�i1iiDiii�j
5�j San Miguel JF, et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma. N Engl J Med. 2008 ; 359�i9�j : 906-17.�i1iiDiii/1iiA�j
6�j Palumbo A et al. Continuous lenalidomide treatment for newly diagnosed multiple myeloma. N Engl J Med. 2012 ; 366�i19�j : 1759-69.�i1iiDiii�j
| CQ2 | �ڐA��K���̏����nj�����҂ɑ��ď��w�Ö@�ɂ���ăv���g�[�ɓ��B��������Ĕ��E�ĔR�܂ʼn��w�Ö@���p�����ׂ��� |
|---|
-
�����O���[�h�J�e�S���[4
- ���w�Ö@���v���g�[��Ɍp�����Ă��������Ԃ̉����ɂ͊�^���Ȃ����߁C��������Ȃ��B
�y�� ���z
������������ɑ���MP �Ö@�iMEL, PSL�j�𒆐S�Ƃ��������Ö@��30�`80���̏Ǘ�ɕ��������ȏ�̑t���������邪1�j2�j�C�t����CM �`����������~�܂��Ĉ��艻�i�ő�t������M �`���ʂ���̑�����25���ȓ��ɗ��܂��Ԃ�3 �J���ȏ㎝�����C���̊ԑ����Q�̐i�s��F�߂Ȃ����Ƃ��v���g�[�Ƃ����j�����Ǘ�����ӍĔ��E�đ�������B�����ŁC�v���g�[�Ǘ�ɑ��Ď��Â��p�������ꍇ�ƁC���f���čĔ��E�đ������ɍĊJ�����ꍇ�ł́C�ǂ��炪�������ԉ����Ɋ�^���邩�͏d�v�ł���BMRC�iMedical Research Council�j�̕ł́CMP �Ö@�����MP�{�r���N���X�`���iVCR�j�Ö@�ɂ�芰���Ö@����268 �ᒆ�C226 �Ⴊ�v���g�[�ɒB�����B���������Ò��~�Q111 ��ƌp���Q115 ��ɖ������t�����������Ԃ��r�������C�L�Ӎ��͔F�߂Ȃ�����3�j�B�܂��C�J�i�_�̕ł́CMP �Ö@��Ƀv���g�[�ɒB����185 ������Ò��~�Q92 ��ƌp���Q93 ��ɖ������t���������C���ꂼ��̐������Ԓ����l��51 �J����46 �J���ŗL�Ӎ��͔F�߂Ȃ�����4�j�B�܂��C�A���L�����܂ɂ�鎡�ẤC������C���ɋ}�������������a�⍜���ٌ`���nj�Q�����������Ƃ�����5�j�B���̔����̓A���L�����܂̓��^���Ԃɑ��ւ���Ƃ̕�����6�j�B�����̌��ʂ��C�v���g�[���B��̉��w�Ö@�̌p���͐����ł��Ȃ��B
�������C�V�K��܂��܂ގ��Ã��W�����ł͎��K���^���ԂɊւ���G�r�f���X�͂Ȃ��B���������āC�Ⴆ��MPB �Ö@�iMEL, PSL, BOR�j�̏ꍇ�ɂ́Cpivotal study �ł���VISTA �����Ŏ��{���ꂽ�R�[�X���ł���9 �R�[�X�̎��{�𐄏����Ă���B
�y�Q�l�����z
1�j Cohen HJ, et al. Comparison of two long-term chemotherapy regimens, with or without agents to modify skeletal repair, in multiple myeloma. Blood. 1984 ; 63�i3�j : 639-48.�i1iiA�j
2�j Boccadoro M, et al. Multiple myeloma : VMCP/VBAP alternating combination chemotherapy is not superior to melphalan and prednisone even in n high risk patients. J Clin Oncol. 1991 ; 9�i3�j : 444-8.�i1iiA�j
3�j Medical Research Council working Party on Leukemia in Adults. Objective evaluation of the role of vincristine in induction and maintenance therapy for myelomatosis. Br J Cancer. 1985 ; 52�i2�j : 153-8.�i1iiA�j
4�j Belch A, et al. A randomized trial of maintenance versus no maintenance melphalan and prednisone in responding multiple myeloma patients. Br J Cancer. 1988 ; 57�i1�j : 94-9.�i1iiA�j
5�j Bergsagel DE, et al. The chemotherapy on plasma-cell myeloma and the incidence of acute leukemia. N Engl J Med. 1979 ; 301�i14�j : 743-8.
6�j Cuzick J, et al. A comparison of the incidence of the myelodysplastic syndrome and acute leukemia following melphalan and cyclophosphamide treatment for myelomatosis. A report to the Medical Research Council's working party on leukaemia in adults. Br J Cancer. 1987 ; 55�i5�j : 523-9.
| CQ3 | �������҂Ƀf�L�T���^�]���𓊗^����ꍇ�͏��ʓ��^�@����������邩 |
|---|
-
�����O���[�h�J�e�S���[1
- ���ʃf�L�T���^�]���Ö@�́C��ʃf�L�T���^�]���Ö@�ɔ�ׂĕ���p�����Ȃ��C�������Ԃ�����������̂Ő��������B
�y�� ���z
�����nj�����҂ɑ���f�L�T���^�]���iDEX�j���^�ʂ̔�r�́C���i���h�~�h�iLEN�j�ɑ��DEX �Ö@�Ə��ʗÖ@�p����ECOG E4A03 �����ōs��ꂽ�BLEN ��25 mg ��21 ���Ԍo�����^���C1 �T�ԋx���B���DEX �Ö@�ł́C�]���ʂ�40 mg ���1�`4 ���C��9�`12 ���C��17�`20 ���ɓ��^���C���ʗÖ@�ł́C40 mg ���1�C8�C15�C22 ���ɓ��^�����B�����ŁC1 �J����DEX �����^�ʂ�1/3 �ƂȂ�B1 �N�̒��ԉ�͎��_�ŁC���ʗÖ@�̐���������96���ŁC��ʗÖ@�Q��87���ɔ䂵�ėL�ӂɗǍD�ł������B���ɁC65 �Έȏ�̍���҂ł́C���ʗÖ@��94���́C��ʗÖ@��83���ɔ䂵�L�ӂɗǍD�ł������B����́C��ʗÖ@�Q�ł͊����ǂ𒆐S�Ƃ����L�Q���ۂɂ�鎀�S�������������Ƃɂ��1�j�B�܂��C�ڐA��K����ɑ���MP �Ö@�iMEL, PSL�j��TD �Ö@�iTHAL�CDEX�j�̃����_������r�����̌��ʂ�����Ă���BMP �Ö@�ł́CMEL 0.25 mg/kg�CPSL 2 mg/kg ��4 ���ԓ��^��28�`42 ���T�C�N���œ��^�����BTD �Ö@�ł́CTHAL 200 mg �A���CDEX 40 mg �̑�1�`4 ���C15�`18 �����^��28 ���T�C�N���œ��^�����BTD �Ö@�̑S�t�������́CMP �Ö@�ɔ䂵�L�ӂɍ����������i68�� vs 50���j�C�������������ԁiPFS�j�͓����ŁC�S�������ԁiOS�j�͗L�ӂɒZ�������i41.5 �J�� vs 49.4 �J���j�B����͗L�Q���ۂ�TD �Q�ŗL�ӂɑ����C����75 �Έȏ�̍���҂Ŕ����p�x�������������߂ł���2�j�B�ȏ���C�������������҂ɂ͏���DEX �Ö@�����������B
�y�Q�l�����z
1�j Rajkumar SV, et al. Lenalidomide plus high-dose dexamethasone versus lenalidomide plus low-dose dexamethasone as initial therapy for newly diagnosed multiple myeloma : an open-label randomized controlled trial. Lancet Oncol. 2010 ; 11�i1�j : 29-37.�i1iiDiv/1iiA�j
2�j Ludwig H, et al. Thalidomide-dexamethasone compared with melphalan-prednisolone in elderly patientas with multiple myeloma. Blood. 2009 ; 113�i15�j : 3435-42.�i1iiDiii/1iiA�j
�y�Ĕ��E���������z
| CQ1 | �Ĕ��E���������҂ɑ���V�K��ܗÖ@�͑�ʃf�L�T���^�]���Ö@�ɔ�ׂĐ������Ԃ����������邩 |
|---|
-
�����O���[�h�J�e�S���[1
- �Ĕ��E���������҂ɑ���V�K��ܗÖ@�́C��ʃf�L�T���^�]���Ö@�Ɣ�r���C�������������Ԃ�����Ԃ�����������̂Ő��������B
�y�� ���z
�Ĕ��E���������������̎��Âɂ����ẮC �T���h�}�C�h�iTHAL�j ��{���e�]�~�u�iBOR�j�C���i���h�~�h�iLEN�j�Ȃǂ̐V�K��܂���������C���Ð��т̌��オ����Ă���B����܂łɁCBOR �P�ܗÖ@��LEN�{���DEX ���p�Ö@�͑��DEX �Ö@�Ƃ̑�Ⅲ����r�������s���Ă���C���̗L�p����������Ă���B
BOR �Ö@�Ƒ��DEX �Ö@�Ƃ��r����APEX �����ł́C�����t���iPR�j�ȏ�̑S�t�������i38�� vs 18���Cp��0.001�j�C�������������ԁiPFS�j�̒����l�i6.22 �J�� vs 3.49 �J���Cp��0.001�j�C1 �N�������i80�� vs 66���Cp��0.003�j�ɂ�����BOR �Q���L�ӂɗD��Ă���1�j�B���̌�̒ǐՒ����ɂ����ẮCBOR �Q�̑S�t��������43���ɏ㏸���Ă��邱�Ƃ����炩�ɂ���C�������Ԃ̒����l�i29.8 �J�� vs 23.7 �J���Cp��0.027�j�C1 �N���������i80�� vs 67���Cp��0.001�j�ɂ����đ��DEX �Q�����L�ӂɗD��Ă��邱�Ƃ��m�F���ꂽ2�j�B
LEN �ɂ��Ă�LEN�{���DEX ���p�Ö@���v���Z�{�{���DEX �Ö@�Q�Ɣ�r���ꂽ�iMM-009 �����CMM-010 �����j�B2 �̎����̐��т͂قړ����ŁC�S�t��������PFS�C�S�������ԁiOS�j�ɂ�����LEN�{���DEX ���p�Ö@�Q���L�ӂɗD��Ă���3�j4�j�B���̌�̒ǐՒ����̌��ʂɂ����Ă��CLEN �Q�͑S�t�������i60.6�� vs 21.9���Cp��0.001�j�C���S�t�������i15.0�� vs 2.0���Cp��0.001�j�CPFS�i�����l13.4 �J�� vs 4.6 �J���Cp��0.001�j�C�t�����ԁi�����l15.8 �J�� vs 7.0 �J���Cp��0.001�j�ɂ����ėL�ӂɗD��Ă��邱�Ƃ����炩�ɂ��ꂽ5�j�B�܂��CDEX �Q�ł͑�������LEN ���Â��{�s���ꂽ�ɂ�������炸�CLEN �Q�̕���OS �ɂ����ėL�ӂɗD��Ă����i�����l38.0 �J�� vs 31.6 �J���Cp��0.045�j5�j�B
�y�Q�l�����z
1�j Richardson PG, et al. Bortezomib or high-dose dexamethasone for relapsed multiple myeloma. N Engl J Med. 2005 ; 352�i24�j : 2487-98.�i1iiA�j
2�j Richardson PG, et al. Extended follow-up of a phase 3 trial in relapsed multiple myeloma : final time-to-event results of the APEX trial. Blood. 2007 ; 110�i10�j : 3557-60.�i1iiA�j
3�j Weber DM, et al. Lenalidomide plus dexamethasone for relapsed multiple myeloma in North America. N Engl J Med. 2007 ; 357�i21�j : 2133-42.�i1iA�j
4�j Dimopoulos M, et al. Lenalidomide plus dexamethasone for relapsed or refractory multiple myeloma. N Engl J Med. 2007 ; 357�i21�j : 2123-32.�i1iA�j
5�j Dimopoulos MA, et al. Long-term follow-up on overall survival from the MM-009 and MM-010 phase Ⅲ trials of lenalidomide plus dexamethasone in patients with relapsed or refractory multiple myeloma. Leukemia. 2009 ; 23�i11�j : 2147-52.�i1iA�j
| CQ2 | �Ĕ��E�������҂ɑ���V�K��܂��܂ޕ��p�Ö@�͐V�K��܂̒P�ܗÖ@�ɔ�ׂč������ʂ����҂ł��邩 |
|---|
-
�����O���[�h�J�e�S���[2A
- �Ĕ��E���ɑ���V�K��܂��܂ޕ��p�Ö@�́C�V�K��܂̒P�ܗÖ@�Ɣ�r���C��荂���t�������������炷���C�Ő��̑������F�߂��邱�ƂȂǂɗ��ӂ��ׂ��ł��낤�B�������Ԃ̉������ʂɂ��Ă͍���̌�����҂K�v������B
�y�� ���z
�Ĕ��E���ɑ���V�K��܂Ƃ��ă{���e�]�~�u�iBOR�j�C�T���h�}�C�h�iTHAL�j�C���i���h�~�h�iLEN�j���g�p����Ă���B�����̐V�K��܂́C�P�ܗÖ@�����f�L�T���^�]���iDEX�j�Ƃ̕��p�Ö@�Ƃ��ėp�����C�����t������������Ă����B����ɁC���Ăł͂����̐V�K��܂ƃV�N���z�X�t�@�~�h�iCPA�j��pegylated liposomal doxorubicin�iPLD�j�ȂǂƂ̕��p�����݂��Ă���C��荂���t�������������Ă���B
BOR �ɂ����ẮCBOR�{PLD �Ƃ̕��p��BOR �P�܂Ƃ̑�Ⅲ����r�������s���CBOR�{PLD �Q�ɂ����閳�������ԁiTTP�j�̗L�ӂȉ����i�����l��9.3 �J��vs 6.5 �J���Cp��0.000004�j�Ɛ������Ԃ̉����i15 �J���̐���������76�� vs 65���Cp��0.03�j���F�߂��Ă��邪�C������grade 3 �ȏ�̗L�Q���ۂ̑����i80�� vs 64���j��������Ă���1�j�B����CBOR�{DEX�{CPA �̕��p�Ö@�̂����CCPA 50 mg/day�i�A���j�̕��p�ɂ����ẮC�S�t�������iCR�{PR�{MR�j��90���ŁC�������Ԃ̒����l��22 �J���ƗǍD�Ȑ��тł�����2�j�B�܂��CCPA 500 mg/day�idays 1, 8, 15�j�̕��p�Ö@�iBOR�{CPA�{DEX�j�̌�����I��͂ł́C�S�t�������iCR�{PR�j��75���ɒB���CBOR �P�܂�27���CBOR�{DEX ��47���ɑ��Ă̏�悹���ʂ��F�߂�ꂽ3�j�B
THAL �ɂ����ẮCTHAL�{DEX�{PLD�iThalDD�j�Ö@��THAL�{DEX�iTD�j�Ö@�̔�r���s���Ă���C�S�t��������TD �Q��63.5���ɑ��CThalDD �Q�ł�92���ƗL�ӂȉ��P��F�߂��ip��0.0001�j4�j�B�܂��C�������Ԃɂ��Ă͒����l35.5 �J��vs 20 �J����ThalDD �Q�ɂ����ėL�ӂȉ�����F�߂��ip��0.0124�j�B
LEN �ɂ����ẮCLEN�{�h�L�\���r�V���iDXR�j�{DEX�iLAD�j�Ö@�̑�Ⅰ/Ⅱ���������s���C�S�t��������73���ƗD��Ă���5�j�B�܂��CLEN�{CPA�i600 mg ��day1, 8 �ɓ��^�j�{DEX �̕��p�Ö@�̑�Ⅰ/Ⅱ���������s���Ă���C�S�t��������81����30 �J���̑S����������80���ł��������Ƃ����ꂽ6�j�B
���̂悤�ɁC�Ĕ��E���������ɑ��ĐV�K��܂�DEX �⑼�̉��w�Ö@�܂Ƃ̕��p�Ö@����������Ă���C���̑t�������△�������Ԃ̌��オ���҂ł���B�������C���p�ɂ���ēŐ��̑�����������Ă��邱�ƁC�܂��������ԉ������ʂ̗L���ɂ��Ă͖��m��ł��邱�Ƃ���C�����_�ł̓��X�N�ƃx�l�t�B�b�g���l�������I�����Ȃ����ׂ��ł��낤�B
�y�Q�l�����z
1�j Orlowski RZ, et al. Randomized phase Ⅲ study of pegylated liposomal doxorubicin plus bortezomib compared with bortezomib alone in relapsed or refractory multiple myeloma : combination therapy improves time to progression. J Clin Oncol.2007 ; 25�i25�j : 3892-901.�i1iiA�j
2�j Kropff M, et al. Bortezomib in combination with intermediate-dose dexamethasone and continuous low-dose oral cyclophosphamide for relapsed multiple myeloma. Br J Haematol. 2007 ; 138 �i3�j : 330-7.�i3iiiDiii�j
3�j Davies FE, et al. The combination of cyclophosphamide, velcade and dexamethasone induces high response rates with comparable toxicity to velcade alone and velcade plus dexamethasone. Haematologica. 2007 ; 92�i8�j : 1149-50.�i3iiiDiv�j
4�j Offidani M, et al. Thalidomide-dexamethasone plus pegylated liposomal doxorubicin vs. thalidomidedexamethasone : a case-matched study in advanced multiple myeloma. Eur J Haematol. 2007 ; 78�i4�j : 297-302.�i3iiiA�j
5�j Knop S, et al. Lenalidomide, adriamycin, and dexamethasone�iRAD�j in patients with relapsed and refractory multiple myeloma : a report from the German Myeloma Study Group DSMM �iDeutsche Studiengruppe Multiples Myelom�j. Blood. 2009 ; 113�i18�j : 4137-43.�i3iiiDiv�j
6�j Schey SA, et al. The addition of cyclophosphamide to lenalidomide and dexamethasone in multiply relapsed/refractory myeloma patients ; a phase �T/Ⅱ study. Br J Haematol. 2010 ; 150�i3�j : 326-33.�i3iiiDiv�j
| CQ3 | �Ĕ��E���������҂ɑ��鎩�Ƒ������זE�ڐA�⓯�푢�����זE�ڐA�͐������Ԃ����������邩 |
|---|
-
�����O���[�h�J�e�S���[2B
- �Ĕ��E���������҂ɑ��鎩�Ƒ������זE�ڐA�͓K�Ȋ��ґI�����s�����ƂŐ������Ԃ̉��������҂ł���B
-
�����O���[�h�J�e�S���[2B
- ���푢�����זE�ڐA�ɂ����Ă͖������������Ԃ̉������F�߂��邪�C�������Ԃ̉����͖��炩�łȂ��B
�y�� ���z
���Ƒ������זE�ڐA�̗L�����́C���w�Ö@�Ɋ���L�����Ɖ��w�Ö@�ɒ�R��Ƃ̔�r�ɂ����āC1 �N���������������iPFS�j�ł͉��w�Ö@���Q��83���C���Ò�R�Q��70���ƗL�Ӎ���F�߂Ȃ������ip��0.65�j1�j�B�܂��C�S�������ԁiOS�j�ɂ����Ă��L�Ӎ���F�߂Ȃ��������Ƃ���C���ƈڐA�͉��w�Ö@���Ò�R����ɂ����Ă��L���Ȏ��Ö@�ł���ƍl������B�܂��C���ƈڐA��Ĕ���ɑ���2 ��ڂ̎��ƈڐA�̗L�����́C�Ĕ��㉻�w�Ö@�݂̂̌Q�Ɣ�r����ƁC4 �N����������32�� vs 22���Ŏ��ƈڐA�Q�ɂ����ėL�ӂɗD��Ă����ip��0.0001�j2�j�B����ɁC���̌����ł͔N��55 �Ζ����C���f����2 �~�N���O���u����2.5 mg/L �����C����ڐA��̑t�����Ԃ�9 �J���ȏ�C����ڐA��̐[�������ɂ����āC2 ��ڂ̎��ƈڐA�ɂ�閳�������ԁiTTP�j��OS�@�̉������ʂ��F�߂��Ă���C�Ĕ���ɂ����鎩�ƈڐA�̈Ӌ`��������Ă���B
����C����ڐA�ɂ����ẮC�ߔN�C�ڐA�O���u��������j��I�ɂ��邱�ƂŁC���Ê֘A���S�iTRM�j���������Ă��Ă���B���ƈڐA��̍Ĕ�169 ��ɂ����āC�ڐA�h�i�[�̗L���ɂ�肻�̌�̌o�߂��r�����ł́C�h�i�[��L����75 �ᒆ68 �Ⴊ������j��I����ڐA���{�s���C2 �NPFS �ł̓h�i�[��L�����Q��42���C�h�i�[��L���Ȃ������Q��18���ŁC����ڐA�Q���L�ӂɗD��Ă����ip��0.0001�j3�j�B�������Ȃ���C2 �N���������ł̓h�i�[��L�����Q��54���ɑ��C�h�i�[��L���Ȃ������Q��53���ƗL�Ӎ��͂Ȃ������ip��0.329�j�B���l�ɁC���ƈڐA��Ĕ���ɂ����鍜����j��I����ڐA��HLA �K���x�ɂ���r�ł́C1 �N��̔�Ĕ����S����HLA ��K���Q��53���ɑ��CHLA �K���Q�ł�10���ƗL�ӂɗD��Ă����ip��0.001�j4�j�B���̂悤�ɁC������j��I����ڐA�ɂ��Ă�TTP �̉������ʂ������ꂽ���̂́C�������Ԃ̉������ʂɂ��Ă͖��炩�ɂ���Ă��Ȃ��B����CHLA �K���h�i�[�̑I����ڐA�㎡�Â̐i���ɂ��C����Ȃ鐬�т̌��オ���҂����B
�y�Q�l�����z
1�j Kumar S, et al. High-dose therapy and autologous stem cell transplantation for multiple myeloma poorly responsive to initial therapy. Bone Marrow Transplant. 2004 ; 34�i2�j : 161-7.�i3iiiDiii�j
2�j Cook G, et al. Factors infl uencing the outcome of a second autologous stem cell transplant�iASCT�j in relapsed multiple myeloma : a study from the British Society of Blood and Marrow Transplantation Registry. Biol Blood Marrow Transplant. 2011 ; 17�i11�j : 1638-45.�i3iiiA�j
3�j Patriarca F, et al. Allogeneic Stem Cell Transplantation in Multiple Myeloma Relapsed after Autograft : A Multicenter Retrospective Study Based on Donor Availability. Biol Blood Marrow Transplant. 2012 ; 18�i4�j : 617-26.�i3iiiDiii�j
4�j Kröger N, et al. Unrelated stem cell transplantation after reduced intensity conditioning for patients with multiple myeloma relapsing after autologous transplantation. Br J Haematol. 2010 ; 148 �i2�j : 323-31.�i3iiiDiii�j
�y������̍����ǂƎ��Ê֘A�Ő��ɑ���x���Ö@�z
| CQ1 | ���a�ς�L���銳�҂ɑ���r�X�z�X�z�l�[�g���܂̓��^�͍��֘A���ۂ̔�����}�����邩 |
|---|
-
�����O���[�h�J�e�S���[1
- ���a�ς�L���鍜����҂ɑ���]���h�����_��2 �N�Ԃɂ킽�锽���p�����^�́C������a�ςɔ������ɂ̊ɘa�ƂƂ��ɍ��܂ȂǍ��֘A���ۂ̔����}�����ʂ�F�߂邽�ߐ��������B
�y�� ���z
D/S ��Ⅲ�Տ��a���ō��Z��a�ς�L���銳�҂ɁC���w�Ö@�ɉ����ăp�~�h���l�[�g90 mg ��4 �T����9 ��ɂ킽��_�H�Ò������Q�ł́C���֘A���ۂ̏o���p�x�̓v���Z�{�Q��41���ɑ�24���ɂ܂Œቺ����1�j�B���ɂ̌����������C�i�s��������҂ɂ�����QOL �̉��P���ʂ������ꂽ�B����ɁC��Ⅲ�Տ��a���ō��Z��a�ς�L���銳�҂ɁC���w�Ö@�ɉ����ăp�~�h���l�[�g90 mg ��4 �T����21 ��_�H�Ò����������ώ@�ɂ����āC21 �J���̎��_�ł̍�Ca ���ǂ��������֘A���ۂ̏o�������́C�v���Z�{�Q��51���ɑ��p�~�h���l�[�g�Q�ł�38���ƒ�l�ł�����2�j�B�����ŁC���a�ς�L�����Ⅲ�Տ��a���̍�����Ɠ������҂ɑ��C3�`4 �T��12 �J���Ԃ̓��^�Ń]���h�����_4 mg ��15 ���Ö������^���p�~�h���l�[�g��90 mg ��2 ���ԓ_�H�Ò��Ɠ����̗Տ����ʂ��������Ƃ����ꂽ3�j�B�܂��C25 �J���Ԃ̓��^�Ń]���h�����_4 mg ��15 ���Ö������^�́C�p�~�h���l�[�g90 mg ��2 ���ԓ_�H�Ò��Ɠ��l�̗Տ����ʂ������C�t��Q�o�����̈��S���ɖ��͂Ȃ��E�e�����m�F���ꂽ4�j�B�]���h�����_�Q�ł̓p�~�h���l�[�g�Q�ɔ���֘A���ۂ̏o����16���������Ă���C�]���h�����_�̗L�p�����m�F���ꂽ4�j�B
�����̗Տ������ł͂�������C��Ⅲ�Տ��a���ō��Z��a�ς�L���銳�҂�ΏۂƂ��CPS ��3 �ȏ�C12 mg/dl �ȏ�̍��J���V�E�����ǂ��邢�͌����N���A�`�j���l��3 mg/dl ����t��Q�Ȃǂ�L����S�g��Ԃ̒ቺ���Ă��銳�҂͏��O����Ă���B�܂��C�]���h�����_�̓��^�Q�ɂ̓J���V�E����r�^�~��D �p���Ă��邱�Ƃɂ����ӂ��K�v�ł���B���������āC�]���h�����_�̓��^�Ώۊ��ҁC�J�n�����C���^���ԂⓊ�^���@�i�ێ��Ö@�̕K�v���j�ȂǂɊւ��Ă͖��m�łȂ������������c����Ă���B���݁C�V�K���Ǎ�����҂ɑ���]���h�����_�ƃN���h���l�[�g�̒������^�̌��ʂ��r�����K�͗Տ������iMRC Myeloma �\ trial�j���p���Ői�s���ł���5�j�B���łɖ{�����ɂ����ẮC�N���h���l�[�g���^�Q�ɑ���]���h�����_���^�Q�̖������������ԁiPFS�j�iHR��0.88�F0.80-0.98�Cp��0.0179�j����ёS�������ԁiHR��0.84�F0.74-0.96�Cp��0.0118�j�̉������ʂɊւ���D�z���ɂ��Ă�������Ă���B
�y�Q�l�����z
1�j Berenson JR, et al. Efficacy of pamidronate in reducing skeletal events in patients with advanced multiple myeloma. N Engl J Med. 1996 ; 334�i8�j : 488-93.�i1iC�j
2�j Berenson JR, et al. Long-term pamidronate treatment of advanced multiple myeloma patients reduces skeletal events. J Clin Oncol. 1998 ; 16�i2�j : 593-602.�i1iC�j
3�j Rosen LS, et al. Zoledronic acid versus pamidronate in the treatment of skeletal metastases in patients with breast cancer or osteolytic lesions of multiple myeloma : a phase Ⅲ, double-blind, comparative trial. Cancer J. 2001 ; 7�i5�j : 377-87.�i1iC�j
4�j Rosen LS, et al. Long-term efficacy and safety of zoledronic acid compared with pamidronate disodium in the treatment of skeletal complications in patients with advanced multiple myeloma or breast carcinoma : a randomized, double-blind, multicenter, comparative trial. Cancer. 2003 ; 98�i8�j : 1735-44.�i1iC�j
5�j Morgan GJ, et al. First-line treatment with zoledronic acid as compared with clodronic acid in multiple myeloma�iMRC Myeloma �\�j : a randomised controlled trial. Lancet. 2010 ; 376�i9757�j : 1989-99.�i1iiA�j
| CQ2 | ���a�ς�L���銳�҂ɑ���f�m�X�}�u�̓��^�͍��֘A���ۂ̔�����}�����邩 |
|---|
-
�����O���[�h�J�e�S���[2B
- ���a�ς�L���鍜����҂ɑ���f�m�X�}�u�̓��^�́C�]���h�����_�Ɠ����̍��֘A���ۂ̔����}�����ʂ�F�߁C���������B�������C�������ԂɊւ��Ă̓]���h�����_�ɕC�G������ʂ�������Ă��炸�C�t��Q���ɂ��]���h�����_�̓��^������Ȋ��҂Ɍ��肵�Ďg�p���邱�Ƃ����������B
�y�� ���z
�j���זE�̌`���E�@�\�́C�Ԏ��זE�⍜��זE�ɗU�������j���זE�������q�ireceptor activator of nuclear factor-��B ligand�FRANKL�j �ƁC ���̂��Ƃ��e�̂őj�Q���q�ł���osteoprotegerin �Ƃ̃o�����X�ɂ�蒲�߂���Ă���B������ł͍�������RANKL �̔��������i���Costeoprotegerin �̔������ቺ���Ă���B�f�m�X�}�u��RANKL �ɑ��銮�S�q�g�����m�N���[�i���R�̂ŁCRANKL �Ɍ������邱�Ƃɂ��RANKL �̍�p��j�Q���C���z�������͂ɗ}������B
�摜��C���Ȃ��Ƃ�1 �����ȏ�̗n�����a�ς�L����r�X�z�X�z�l�[�g���܂̎��×��̂Ȃ�������҂ɑ��C�]���h�����_4 mg �̓_�H�Ò��܂��̓f�m�X�}�u120 mg �牺����4 �T���Ƃɍs���Q�ɖ���ׂɊ���t������d�ӌ���Ⅲ���Տ������i�]���h�����_�Q93 ��C�f�m�X�}�u�Q87 ��j�ł́C���֘A���۔��ǂ܂ł̊��Ԃ͍����Ȃ��C�f�m�X�}�u�ƃ]���h�����_�̍��֘A���ۂ̔����}�����ʂ͓����ƍl����ꂽ1�j�B�܂��C�E�e����{���̔��ǂ������ł������B�f�m�X�}�u�́C���^�o�H���牺���˂ƊȕւŁC�]���h�����_�Ɣ�r�����M��ߒɂȂǂ̋}�����������Ȃ��t�@�\�ɂ��e����^���ɂ����Ƃ������_��L����B�������C���ÊJ�n���������J���V�E�����ǂ��N����₷�����߁C�J���V�E������уr�^�~��D �̕�[����������Ă���B�S���������iOS�j�ɂ����Ă̓f�m�X�}�u�Q���]���h�����_�Q�ɔ�ח���Ă���Ƃ������ʂł������B�{�����ł͉�͊��Ґ������Ȃ��C�\��ɉe����^���郊�X�N���q�⎡�Ó��e��������������t�����s���Ă��Ȃ��Ƃ̎w�E������C���ݐi�s���̍�����҂ɑ��鍑�ۋ�����K�͑�Ⅲ���Տ������ōēx�C���ڍׂɉ�͂����\��ł���B
�y�Q�l�����z
1�j Henry DH, et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastasis in patients with advanced cancer �iexcluding breast and prostate cancer�j or multiple myeloma. J Clin Oncol. 2011 ; 29�i9�j : 1125-32.�i1iC�j
| CQ3 | �r�X�z�X�z�l�[�g���܂𓊗^���銳�҂ɑ�����o���\�h���u�͊{���̔�����}�����邩 |
|---|
-
�����O���[�h�J�e�S���[2A
- �Ö����˗p�r�X�z�X�z�l�[�g�̓��^�O�Ɏ��Ȉ�t�ɂ����o���̃`�F�b�N���K�v�Ȏ��ȏ��u���܂��s���C���^�J�n��͌��o���P�A���s���ƂƂ��ɐN�P�I���ȏ��u������C�S����̋��Ȃ����Ȏ��Â��Ȃ��悤�ɂ��邱�Ƃɂ��C�r�X�z�X�z�l�[�g�֘A�{���iBRONJ�j�������}�������B
�y�� ���z
�{���̔��ǂ̕p�x�C�����C�댯���q�𖾂炩�ɂ���ړI�ŁC1997 �N�ȍ~�r�X�z�X�z�l�[�g�𓊗^����Ă��鍜����ƍ��]�ڂ�L���銳��252 ���2003 �N���ǐՒ��������ł́C�S�̂�17 ��i6.7���j�C����������҂ł�111 �ᒆ11 ��i9.9���j�Ɋ{�������ǂ��Ă���1�j�B�{���ǂ������҂̃r�X�z�X�z�l�[�g�̓��^�͕���35 ��ł���C13 ��̓��^�܂łł͔��ǎ҂͂��Ȃ������B�]���h�����_�̌p�����^�Q�ł̓p�~�h���l�[�g�Q�ɔ�חL�ӂɔ��ǎ҂����������B�܂��C�r�X�z�X�z�l�[�g�֘A�{���ibisphosphonate-related osteonecrosis of the jaw�FBRONJ�j�́C�Ö����˗p�r�X�z�X�z�l�[�g�̓��^���������҂��قƂ�ǂł���BBRONJ �̑������������̎��ȏ��u��Ǐ������Ɋ֘A���Ĕ������Ă���C�r�X�z�X�z�l�[�g�̓��^�C�����^�ʂ������Ȃ�Ɣ��Ǖp�x�͑������Ă���B
���o���\�h���u�Ƃ��āC①�]���h�����_�̓��^�O�Ɏ��Ȉ�t�ɂ����o���̃`�F�b�N���C�K�v�Ȏ��ȏ��u���s���C②�N�P�I���ȏ��u�̏ꍇ�͏��u��6�`8 �T��ɑn���̎������m�F���ꂽ�ꍇ�Ƀ]���h�����_�̓��^���J�n����C③�]���h�����_�̓��^�J�n��͌��o���P�A���\���ɍs���C�S����̋��Ȃ����Ȃ���f�����Â��Ȃ��悤�ɂ��邱�Ƃ��s���ƁC�]���h�����_���Ɏg�p�i6 ��ȏ�j���Ă��鍜����҂�BRONJ �̔��ǂ�1/3 �ȉ��Ɍ������C�d�Ǘ�istage 3�j�͂Ȃ������ƕ���Ă���2�j�BBRONJ �͎��������ɍ���Ȏ����ƍl�����Ă������CBRONJ ���������Ȃ������Ǘ��24���ŁC12�������P��ĔR�C62�������P�E�������Ă���Ƃ̕�����3�j�B�܂��C��������12 ��Ƀr�X�z�X�z�l�[�g���ĊJ����C6 ���BRONJ ���Ăє��ǂ��Ă���B
�V�K���Ǎ�����҂ɑ���]���h�����_�ƃN���h���l�[�g�̒������^�̌��ʂ��r�����K�͗Տ������iMRC Myeloma Ⅸ trial�j���p���Ŏ��{���ꂽ���C�{�����ł͌��o���\�h�[�u���s��ꂽ�B�{�����̒��ԕ�4�j�ł́C���o���\�h�[�u���s���Ă��N�Ԗ�4���̊��҂�ONJ ���������Ă��邽�߁C�\�h�[�u�ɉ������Ӑ[���ώ@��BRONJ �̑��������ƑΉ����K�v�ł���B
�y�Q�l�����z
1�j Bamias A, et al. Osteonecrosis of the jaw in cancer after treatment with bisphosphonates : incidence and risk factors. J Clin Oncol. 2005 ; 23�i34�j : 8580-7.�i3iiiC�j
2�j Dimopoulos MA, et al. Reduction of osteonecrosis of the jaw �iONJ�j after implementation of preventive measures in patients with multiple myeloma treated with zoledronic acid. Ann Oncol. 2009 ; 20�i1�j : 117-20.�i3iiiC�j
3�j Badros A, et al. Natural history of osteonecrosis of the jaw in patients with multiple myeloma. J Clin Oncol. 2008 ; 26�i36�j : 5904-9.�i3iiiC�j
4�j Morgan GJ, et al. First-line treatment with zoledronic acid as compared with clodronic acid in multiple myeloma�iMRC Myeloma �\�j : a randomised controlled trial. Lancet. 2010 ; 376�i9757�j : 1989-99.�i1iiA�j
| CQ4 | �t��Q��L���銳�҂ɑ���V�K��܂̎g�p�̓f�L�T���^�]���P�Ɠ��^�ɔ�ׂĐt�@�\�̉����҂ł��邩 |
|---|
-
�����O���[�h�J�e�S���[2A
- �t��Q��L���銳�҂ɑ��{���e�]�~�u�Ȃǂ̐V�K��܂p����f�L�T���^�]���P�Ƃ������������ɐt�@�\�̉��P���F�߂��邽�ߐ��������B
�y�� ���z
�t��Q�͐i�s��������҂ɔ�r�I�悭�݂���B�t��Q�͑����̏ꍇ�C������ɑ��鎡�Â��t������Ή��P���邽�߁C������ɑ��ϋɓI�ɍR��ᇗÖ@���s�����Ƃ���ł���B�{���e�]�~�u�iBOR�j�Ȃǂ̐V�K��܂p����f�L�T���^�]���iDEX�j�P�Ƃ������������ɐt�@�\�����P����1�j�B�������CBOR �ɂ���ᇕ���nj�Q����N�����Ɛt��Q����������\��������̂Œ��ӂ�v����B�܂��C�T���h�}�C�h�iTHAL�j�������ꕔ�t�r�������̂ŁC�t��Q��L���銳�҂ɓ��^���鎞�ɂ͐t�@�\�̕ω��ɒ��ӂ���B���i���h�~�h�iLEN�j���̂��̂ɂ͗Տ�����ƂȂ�t�Ő��͏��Ȃ��ƍl�����Ă��邪�CLEN �̎�v�Ȕr���o�H�͔A���r���ł��邽�߁C�t�@�\��Q��L���銳�҂ł͌����Z�x���������CLEN �Ɋ֘A�����d�ĂȌ��t�Ő��Ȃǂ̗L�Q���ۂ��N����₷���Ȃ�B���̂��߁C�N���A�`�j���N���A�����X�ɉ����āCLEN �̐������^�ʂ��ݒ肳��Ă���B�N���A�`�j���N���A�����X�� 60 mL/���̊��҂ł͌��ʂ̕K�v�͂Ȃ��B�r�X�z�X�z�l�[�g���p���͐t�@�\�̃��j�^�����O�����I�ɍs���C�t�@�\��c�����Ă����B�E���C���J���V�E�����ǁCNSAIDs �Ȃǂ̖��t�@�\�������q�ƂȂ邽�߁CLEN �̗p�ʂ̒��߂ƂƂ��ɂ����̑������q�ɑ���Ή����d�v�ł���B������ɑ��鎡�Â��t������Ɛt��Q�����P���邱�Ƃ��������߁C�t�@�\�ɉ������������^�ʂ����炵LEN �����܂��g�p���邱�Ƃ��̗v�ł���B
�y�Q�l�����z
1�j Kastritis E, et al. Reversibility of renal failure in newly diagnosed multiple myeloma patients treated with high dose dexamethasone-containing regimens and the impact of novel agents. Haematologica. 2007 ; 92�i4�j : 546-9.�i3iiDiv�j
| CQ5 | �{���e�]�~�u���^���̊��҂ɑ���A�V�N���r�������͑я��v�]�̔����������������邩 |
|---|
-
�����O���[�h�J�e�S���[2A
- �{���e�]�~�u���^���̊��҂ɑ���A�V�N���r���̗\�h�����͑я��v�]�̔����������������邽�ߐ��������B
�y�� ���z
�{���e�]�~�u�iBOR�j���^���̊��҂ł́C�я��v�]�̔��ǂ���r�I�����ɏo�����邱�Ƃ��w�E����Ă���B���ɁC�f�L�T���^�]���iDEX�j�p����ꍇ�͒��ӂ��K�v�ł���BBOR ���^�ɂ��_�o��Q���u�ɂ��������Ă���ꍇ�C�я��v�]�̔��ǂ͐_�o��Q���u�ɏǏ�������C���҂̐����̎�������ɒቺ������BAPEX �����ł́CBOR �P�܂����DEX �̕��p�Q��331 �ᒆ42 ��i13���j�ɑя��v�]���������CDEX �P�ƌQ�i5���j���BOR ���^�Q�őя��v�]�̔��ǂ��L�ӂɑ�������1�j�BBOR ��MP �Ö@�iMEL, PSL�j�p����VISTA �����ł́CMP �Ö@�Q�ɔ��BOR ���p�Q�őя��v�]�̔��ǂ����p�x�ł������i13�� vs 4���j2�j�B�܂��C�A�V�N���r���iACV�j�̗\�h���������Ȃ�����250 ��ł�43 ��i17.2���j�ɑя��v�]�����������̂ɑ��C�\�h����������90 ��ł͑я��v�]������3 ��i3.3���j�݂̂Ɍ������Ă���CACV �̗\�h�����ɂ��я��v�]�̔��������������邱�Ƃ������ꂽ2�j�B�܂��CACV 200 mg/���̒�p�ʂ̗\�h�����ɂ��я��v�]�̔��������������邱�Ƃ�������Ă���3�j�B�������C�����Ԃɂ킽��R�E�C���X�^�ɂ��t��Q��_�o��Q�ɂ����ӂ��K�v�ł���B
�y�Q�l�����z
1�j Chanan-Khan A, et al. Analysis of herpes zoster events among bertezomib-treated patients in the phase Ⅲ APEX study. J Clin Oncol. 2008 ; 26�i29�j : 4784-90.�i1iiA�j
2�j San Miguel JF, et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma. N Engl J Med. 2008 ; 359�i9�j : 906-17.�i1iiA�j
3�j Aoki T, et al. Efficacy of continuous, daily, oral, ultra-low-dose 200 mg acyclovir to prevent herpes zoster events among bortezomib-treated patients : a report from retrospective study. Jpn J Clin Oncol. 2011 ; 41�i7�j : 876-81.�i3iiiC�j
| CQ6 | �{���e�]�~�u���^���̊��҂ɑ���{���e�]�~�u�̓��^�@�̕ύX�͖����_�o��Q���y�������邩 |
|---|
-
�����O���[�h�J�e�S���[1
- �K���g�p�K�C�h�ɂ��{���e�]�~�u�̗p�ʒ��߂ɂ�薖���_�o��Q�̏d�lj����}������C�܂����ܕ��p�Ö@�ɂ����ă{���e�]�~�u�̐Ö������^���T2 ��T1 ��Ɍ��ʂ��邱�Ƃ�牺���^�ɕύX���邱�Ƃ͍R��ᇌ��ʂ�ቺ�������ɖ����_�o��Q������������B
�y�� ���z
�{���e�]�~�u�iBOR�j�Ö������^�̐_�o��Q�́C�O���Âɂ�閖���_�o��Q�̗L���ɊW�Ȃ��o�����邪�CBOR �̗ݐϓ��^�ʂƑ��ւ��O���Âɂ�閖���_�o��Q��L����ꍇ�͔����p�x�������d�lj����₷���BNCI-CTCAE �̃O���[�h�ɂ��L�ڂ��ꂽ�{�܂̓K���g�p�K�C�h1�j��ڈ��ɁC���퐶��������ɂȂ�O�ɖ{�܂����ʁE���~����B���̂悤�ȏ��u�ɂ��C�Ĕ�������҂ɑ���BOR �̑�Ⅲ�������ɂ����āC91 ���grade 2 �ȏ�̖����_�o��Q������̂���64�������P�E���������ƕ���Ă���2�j�B�������Ȃ���C�����_�o��Q��BOR �̌p�����^������ɂ��Ă��邽�߁CBOR �̏T2 ���1 ��̐Ö������^�̗L�����ƕ���p����r���ꂽ3�j�B�����t�@�����iMEL�j�{�v���h�j�]�����iPSL�j�{BOR�{�T���h�}�C�h�iTHAL�j�Ö@��BOR�{THAL �ɂ��ێ��Ö@���s���Q��MEL�{PSL�{BOR �Ö@�Q�̂����CBOR �̓��^��372 ��ɏT1 ��C139 ��ɏT2 ��s�����Ƃ���C�S�t�������͓����ł���C3 �N�̖��������������iPFS�j�͂��ꂼ��50����47���C�S���������iOS�j�͂��ꂼ��88����89���Ɨ��҂ɍ����Ȃ������BGrade 3 �ȏ�̖����_�o��Q�͏T1 ��Q��8���C�T2 ��Q��28���ƗL�ӂɏT1 ��Q�Ō������Ă����B�܂��C�����_�o��Q�̂���BOR �̓��^�𒆎~������͏T1 ��Q��5���C�T2 ��Q��15���ł������B�����ŁCBOR �̏T2 �^�̔牺���i2.5 mg/mL �ɗn���j�ƐÖ������^�̃����_������r���������{���ꂽ4�j�B������1�`3 ���W������L����Ĕ��E����������222 ����Ώۂɂ���BOR�{�f�L�T���^�]���iDEX�j�Ö@�ɂ����āC�ώ@���Ԓ����l11.8 �J���ŁC�S�t�������͐Ö������^�Q�i74 ���j�Ɣ牺���^�Q�i148 ���j ��42�� vs 42���C1 �N����������76.7�� vs 72.6�� �ip��0.504�j�ƗL�����ɍ��͂Ȃ������B�������C�����_�o��Q�̍����p�x���Ö������^�Q�Ɣ牺���^�Q��53�� vs 38���ip��0.044�j�C����grade 2 �ȏオ41�� vs 24���ip��0.012�j�Cgrade 3 �ȏオ16�� vs 6���ip��0.026�j�Ɣ牺���^�Q�Œ�p�x�ł������B���̂悤�ɁC���ܕ��p�Ö@�ɂ�����BOR �̐Ö������^���T2 ��T1 ��ɂ��邱�Ƃ�BOR �ʔ牺���^���邱�Ƃ́C�R��ᇌ��ʂ�ቺ�������ɖ����_�o��Q�����������邱�Ƃ�������Ă���B
�y�Q�l�����z
1�j ��4.0 �Ńx���P�C�h®�K���g�p�K�C�h. 2011 �N9 ���쐬
2�j Richardson PG, et al. Frequency, characteristics, and reversibility of peripheral neuropathy during treatment of advanced multiple myeloma with bortezomib. J Clin Oncol. 2006 ; 24�i19�j : 3113-20.�i3iiiA�j
3�j Bringhen S, et al. Efficacy and safety of once-weekly bortezomib in multiple myeloma patients. Blood. 2010 ; 116�i23�j : 4745-53.�i3iiA�j
4�j Moreau P, et al. Subcutaneous versus intravenous administration of bortezomib in patients with relapsed multiple myeloma : a randomized, phase 3, non-inferiority study. Lancet Oncol. 2011 ; 12�i5�j : 431-440.�i1iiDiv�j
| CQ7 | �T���h�}�C�h�C���i���h�~�h���^���҂ɑ���A�X�s�����̓����͐[���Ö������ǂ̔�����}�����邩 |
|---|
-
�����O���[�h�J�e�S���[2A
- �T���h�}�C�h��i���h�~�h���܂ޕ��p�Ö@�ł͐[���Ö������ǁiDVT�j���ǂ̑������F�߂��C��p�ʃA�X�s�����i81�`100mg/���j�̗\�h������DVT ���ǂ̗\�h�ɐ��������B������DVT ���ǂ̊댯���q��L���銳�҂ł͂�茵�i�ȊǗ����K�v�ł���B
�y�� ���z
������҂ł͐[���Ö������ǁideep vein thrombosis�FDVT�j�̔��ǂ������X��������BDVT ���������₷��������҂̊댯���q�Ƃ��āC����C��s����Ìňُ��DVT �̊����C�G���X���|�G�`���̎g�p�C���p�ʃf�L�T���^�]���iDEX�j�̎g�p�C�h�L�\���r�V���iDXR�j���܂ޕ��p���w�Ö@�C�����珰�C���S�Ö��J�e�[�e���̎g�p�C��ᇗʂ��������ƁC����ъ����≊�ǂ̑��݂Ȃǂ��w�E����Ă���C���̂悤�Ȋ댯���q������CDVT ���ǂɑ���\�h����Ƃ邱�Ƃ����Ƃ��Ɛ�������Ă���1�j�B
�T���h�}�C�h�iTHAL�j��i���h�~�h�iLEN�j���܂ޕ��p�Ö@�ł͐Ö������ǐ��ǁivenous thromboembolism�FVTE�j���ǂ���������B�����×�ɑ���THAL ��DEX �̕��p��DEX �P�Ɠ��^���r���������_������r�����ɂ����āCDEX �P�Ɠ��^�ł�DVT �̔��ǂ�3���ł��������CTHAL �̕��p��17���ɑ�������2�j�B�Ĕ����������ɑ���LEN ��DEX �̕��p��DEX �P�ƗÖ@���r����MM009�CMM010 �����ł́CDVT �̔��Ǘ��́CLEN ��DEX �̕��p�Q�̂ق���DEX �Q��荂���ł������i���ꂼ��14.7�� vs 3.4���C11.4�� vs 4.6���j3�j4�j�B��ᇗʂ��������߂��V�K���Ǘ�̕����Ĕ�����DVT �̊댯�������CDVT ���ǂ�THAL ��LEN ���܂ގ��ÊJ�n��5 �J���ȓ��ɑ����BTHAL ��LEN ���܂ޕ��p�Ö@�ł�VTE �̔��Ǘ\�h�ɁCDVT �̔��ǃ��X�N���Ⴂ���҂ɑ��Ă͒�p�ʃA�X�s�����i81�`100 mg/���j�̗\�h�������C�܂����X�N���������҂ɑ��Ă͒ᕪ�q�փp�����̗\�h���^�����ÊJ�n����Œ�4�`6 �J���ԍs�����Ƃ���������Ă���BTHAL ���܂ފ����Ö@�iMPBT�CBTD ���邢��TD�j�in��220�j�̑O�����I�����ɂ����āC��p�ʃA�X�s�����i100 mg/���j�̗\�h������DVT �̔��ǂ��ŏ���6 �J���Ԃ�6.4���ɗ}������5�j�B�Ȃ��CMM009�CMM010 �������ɂ�����T�u�O���[�v��͂ł́CLEN�{DEX �Q�ɂ����Č����ǂ̔��ǂ̗L������ь����Ǘ\�h�̂��߂̍R����Ö@�̗L����OS�CTTP �ȂǂƂ̑��ւ͔F�߂��Ȃ��������Ƃ�����Ă���6�j�B���������āC��L�̌����Ǘ\�h���LEN �ɂ��R��ᇌ��ʂɕ��̉e���͋y�ڂ��Ȃ��ƍl������BDVT �̃��X�N�ɂ͐l�퍷�����邽�߁C�{�M�ł̑�K�͎����ɂ�����G�r�f���X���]�܂��B
�y�Q�l�����z
1�j Palumbo A, et al. Prevention of thalidomide- and lenalidomide-associated thrombosis in myeloma. Leukemia. 2008 ; 22�i2�j : 414-23.�i���r���[�j
2�j Rajkumar SV, et al. Eastern Cooperative Oncology Group. Phase Ⅲ clinical trial of thalidomide plus dexamethasone compared with dexamethasone alone in newly diagnosed multiple myeloma : a clinical trial coordinated by the Eastern Cooperative Oncology Group. J Clin Oncol. 2006 ; 24�i3�j : 431-6.�i1iiA�j
3�j Weber DM, et al. Lenalidomide plus dexamethasone for relapsed multiple myeloma in North America. N Engl J Med. 2007 ; 357�i21�j : 2133-42.�i1iA�j
4�j Dimopoulos M, et al. Lenalidomide plus dexamethasone for relapsed or refractory multiple myeloma. N Engl J Med. 2007 ; 357�i21�j : 2123-32.�i1iA�j
5�j Palumbo A, et al. Aspirin, warfarin, or enoxaparin thromboprophylaxis in patients with multiple myeloma treated with thalidomide : a phase Ⅲ, open-label, randomized trial. J Clin Oncol. 2011 ; 29 �i8�j : 986-93.�i1iiA�j
6�j Zangari M, et al. Survival Effect of Venous Thromboembolism in Patients With Multiple Myeloma Treated With Lenalidomide and High-Dose Dexamethasone. J Clin Oncol. 2010 ; 28�i1�j : 132-5.�i1iA�j
2
������������̗މ�����
�y���̌Ǘ����`���זE��E���O���`���זE��z
�����_
���ۍ������ƕ���iInternational Myeloma Working Group�FIMWG�j�̕��ނł́C���̌Ǘ����`���זE��́C①���������/�܂��͔A����M �`�������o���Ȃ��i���ɏ��ʂ�M �`�������o���邱�Ƃ�����j�C②�P�N���[�����̌`���זE�̑����ɂ��1 �����݂̂̍��j��C③��a�ϕ��̍����̏����ō����ɂ�����`���זE�̂т܂��B���Ȃ�������������ɑ������Ȃ��C④�S�g��X ���������킨��ѐҒłƍ��Ղ�MRI ������C�����⑤�`���זE�̑��B�Ɋ֘A��������E�g�D��Q���Ȃ��i�Ǘ������a�ψȊO�̑����Q���Ȃ��j���Ƃƒ�`����Ă���1�j�B�܂��C���O���`���זE��́C①��������єA��M �`�������o���Ȃ��i���ɏ��ʂ�M �`�������o���邱�Ƃ�����j�C②�P�N���[�����̌`���זE�ɂ�鐑�O��ᎂ̑��݁C③���퍜���C④����ȑS�g�����������⑤�����Q���Ȃ����Ƃƒ�`����Ă���1�j�BWHO ���ށi2008�j�ł͍�����э����ȊO���甭�������`���זE��𐑊O���`���זE��Ƃ��Ă���B
���O���`���זE��͕@�o�C���@�o�C�����ǁC�x�C�b��B�C���|�C�����p�߂Ȃǂɔ�������B80���ȏオ�㕔�C����㕔�����ǂɕ��z���C�㕔�C���ł͕��@�o�������B�����Ǐ��Տ����͎�ᇂ̔������ʂňقȂ�B�Ǘ������O���`���זE��̌o�߂͈�ʂɊɖ��ŁC������������ւ̐i�W�͋H�ł��邪�C���̌Ǘ����`���זE��͑�����������ɐi�W���₷���B��r�I�ŋ߂̕ł́C���̌Ǘ����`���זE��f�f��5 �N�̑S���������iOS�j�C���a���������iDFS�j�͂��ꂼ��70����46���ł���C5 �N�Ŗ���������������ֈڍs���Ă���2�j�B������������ֈڍs���������͐f�f���畽��21 �J���ł������Ƃ���Ă���B����������������i�W����Ƃ��̗\��́C������������̗\��Ɠ����Ɉ����Ȃ�B��ʂɑ�����������ւ̐i�W���\������߂�ƍl������B�܂��C�č���1998�`2004 �N�̊Ԃɐf�f���ꂽ�Ǘ����`���זE���1,472 ��̗\�����͂����ł́C��N�Q�ق�OS�C�������ٓI���������Ƃ��ɍ����C���̌Ǘ����`���זE��Ɛ��O���`���זE��̗\����r�����OS�C�������ٓI���������Ƃ��ɍ��̌Ǘ����`���זE��̂ق�����l�ł���3�j�B�������ٓI���������́C���̌Ǘ����`���זE�50���C���O���`���זE�80���Ńv���g�[�ɂȂ��Ă���C���a�^�̊ԂŎ������ɑ傫�ȍ������邱�Ƃ�������Ă���B
�Ǐ��Ö@�Ƃ��ĕ��ː��Ö@�ƊO�ȓI�؏�����ɍs����B�܂��C�a�ς̕��ʂ⎡�Ìo�߂ɂ�艻�w�Ö@�����������B��ʂɕ��ː�����������ᇂƍl�����Ă��邪�C�ǗႪ���Ȃ����Ƃ�������ː��Ö@�̎��K�Ǝ˗ʂȂǂ̏\���Ȍ��������Ȃ��C�W���I���Ö@�͊m������Ă��Ȃ��B�\��ǍD���q�Ƃ��āC��N�҂���ю�ᇌa5 cm �����ł��邱��4�j���C�܂�������������ւ̐i�W������������q�Ƃ��āC�f�f���̎�ᇂ̑傫����`������ł�M �`���̑��ݓ����������Ă���5�j�B
�y�Q�l�����z
1�j International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders : a report of the International Myeloma Working Group. Br J Haematol. 2003 ; 121�i5�j : 749-57.
2�j Knobel D, et al. Prognostic factors in solitary plasmacytoma of the bone : a multicenter Rare Cancer Net-work study. BMC Cancer. 2006 ; 6 : 118.�i3iiiA�j
3�j Dores GM, et al. Plasmacytoma of bone, extramedullary plasmacytoma, and multiple myeloma : incidence and survival in the United States, 1992-2004. Br J Haematol. 2009 ; 144�i1�j : 86-94.�i3iA�j
4�j Nanni C, et al. 18F-FDG PET/CT in myeloma with presumed solitary plasmocytoma of bone. In Vivo. 2008 ; 22�i4�j : 513-7.�i3iiDiv�j
5�j Holland J, et al. Plasmacytoma. Treatment results and conversion to myeloma. Cancer. 1992 ; 69 �i6�j : 1513-7.�i3iiiDiv�j
| CQ1 | �Ǘ����`���זE��ɂ����ĕ��ː��Ö@�ɂ�鏉�����Ì�̕⏕���w�Ö@�͑�����������ւ̐i�W��x�点�邩 |
|---|
-
�����O���[�h�J�e�S���[2B
- �Ǘ����`���זE��ɑ��Ǐ����ː��Ö@�ɉ����C���ܕ��p���w�Ö@�̒lj��ɂ�鑽����������ւ̐i�W�}�����ʂ͎�����Ă��Ȃ��B�t�ɓ������a�Ȃǂ̃��X�N�����܂邱�Ƃ����O����C���ː��Ö@�ɂ�鏉�����Ì�̑��ܕ��p���w�Ö@�ɂ��⏕���w�Ö@�͐�������Ȃ��B
�y�� ���z
�Ǘ����`���זE��瑽����������ւ̐i�W���������Ɨ\�オ�s�ǂɂȂ�B�Ǘ����`���זE��258 ��i���̌Ǘ����`���זE��206 ��C���O�Ǘ����`���זE��52 ��j�̂���214 �Ⴊ���ː��Ö@�̂݁C34 �Ⴊ���ː��Ö@�Ɖ��w�Ö@�m22 �ႪMP �Ö@�iMEL, PSL�j�C7 �ႪVAD �Ö@�iVCR,DXR, DEX�j�C5 �Ⴊ���̑��̑��ܕ��p�Ö@�j�𒆉��l��6 �R�[�X���p�����ώ@�ŁC���ϊώ@���Ԃ�56 �J���ő�����������ւ̐i�s�܂ł̊��Ԃ̒����l��21 �J���ł�����1�j�B10 �N��̑�����������ւ̐i�W���͕��ː��Ö@�P�ƌQ��64���C���w�Ö@���p�Q��74���Ɖ��w�Ö@��lj�����L�p�����F�߂��Ă��Ȃ��B�܂��C��ᇌa��4 cm �����̏ꍇ��4 cm �ȏ�ɔ�ח\��ǍD�ł������B���̂悤�ɁC�Ǘ����`���זE��ɑ��Ǐ����ː��Ö@��MP �Ö@�Ȃǂ̑��ܕ��p���w�Ö@��lj�����L�p���͎�����Ă��Ȃ��B�t�ɓ������a�Ȃǂ̃��X�N�����܂邱�Ƃ����O�����B���ۍ������ƕ���iInternational Myeloma Working Group : IMWG�j�̐f�f�K�����o�����ȑO�̕ł́C�ō��ƒ�����MRI �̕]�����s���Ă��Ȃ����߁C���ݎ��s�\��MRI ��PET/CT �ŏڍׂȕ]�����s���Έꕔ�̏ǗႪ������������Ɛf�f�����\��������B�܂��C����܂ł̕ł͐V�K��܂�p�����������Ȃ��B����CPET/CT ��MRI �Ȃǂ̉摜�f�f�ɂČǗ������ǂ����̂�茵���Ȑf�f���s����������ŁC�f�f���̌Ǘ�����ᇂ̑傫���CM �`���̑��݂⒰���̍������h�ł̑�����������̐f�f�K�������Ȃ��P�N���[�����̌`���זE�̑��ݓ���������������ւ̐i�W�ւ̃��X�N���q�ɂȂ�̂��ǂ����C�܂����̂悤�ȃ��X�N���q������ꍇ�̐V�K��܂�p�����⏕���w�Ö@��������������ւ̐i�W�̗}�����ʂ�����̂��ǂ����Ȃǂ̌������]�܂��B
�y�Q�l�����z
1�j Ozsahin M, et al. Outcomes and patterns of failure in solitary plasmacytoma : a multicenter Rare Cancer Network study of 258 patients. Int J Radiat Oncol Biol Phys. 2006 ; 64�i1�j : 210-7.�i3iiA�j
�y�S�g��AL �A�~���C�h�[�V�X�z
�����_
AL �A�~���C�h�[�V�X�́C�ُ�`���זE���Y������郂�m�N���[�i���Ɖu�O���u�����iM �`���j�̌y���iL ���j�ɗR������A�~���C�h�`�����S�g������ɒ������C�����Q�������������ł���1�j2�j�B�Ɖu�O���u�����d���iH ���j�ɗR��������̂�AH �A�~���C�h�[�V�X�ƌĂ�邪�ɂ߂ċH�ŁC���҂����킹�ĖƉu�O���u�������A�~���C�h�[�V�X�Ƃ��ĂԁB������������⌴�����}�N���O���u�������ǂȂǂ̊�b������Ȃ��ꍇ���������C��b�����ɔ����ꍇ���AL �A�~���C�h�[�V�X�ƌĂԁB�������C���ۂɂ͗��҂̊ӕʍ���ȏǗ���݂��C WHO ���ށi2008�j�ł͗��҂��܂Ƃ߂Č������A�~���C�h�[�V�X�Ƃ��Ă���3�j�B�܂��C�a�ς������̑���ɂ킽��ꍇ��S�g���C�ꑟ��Ɍ��ǂ���ꍇ�����ǐ��ƌĂԁB�{�ǂ͋H�ȕa�C�ł���C1998 �N�̑S���u�w�����ł͐��芳�Ґ��͖�510 ��ł���B�A�~���C�h�`���̒����͐S���C�̑��C�t���C�����ǁC�����_�o�ȂǑ�����ɂ킽��C���ʂȗՏ��Ǐ��悷��B�f�f�m��͕a���w�I�����Ɋ�Â��CCongo red ���F�Ş�ԐF�ɐ��܂�C�Ό����������ŗΐF�̕����܂��������Ƃ��K�{�ł���B����ɍR�Ɖu�O���u�����y���R�̂�p�����Ɖu���F�ŃA�~���C�h�̕a�^���m�肷��BM �`���̌��o�ɂ͌����E�A�̒`���d�C�j���C�Ɖu�d�C�j�����s���邪�C�V���y���ifree light chain�FFLC�j�̑���͊��x�������L�p�ł���B�{�ǂ̗\��͕s�ǂł���C�����×�ł̐f�f����̐������Ԓ����l�iMST�j�͂��悻13 �J���C���ɐS�a�ς�L����Ǘ�͗\��s�ǂł���B���ÖڕW�̓A�~���C�h�`���̌����ƂȂ��Ă��郂�m�N���[�i����FLC �̎Y���𑬂₩�ɗ}�����C����@�\���������邱�Ƃɂ���B���Ɩ��������זE�ڐA�͑����Q�̂��ߎ��Ê֘A���S�iTRM�j�������̂œK����T�d�Ɍ������C���X�N�ɉ������O���u�̌��ʂ��l�������{���邱�Ƃ��d�v�ł���4�j�`6�j�B���Ɩ��������זE�ڐA�̓K���̂Ȃ��Ǘ�ł�MD �Ö@�iMEL, DEX�j���邢�͌���DEX �Ö@�iLD-DEX�j����������邪�C�ŋ߂ł͑�����������ɗp������V�K��܂̗L�p������������C�����ł�BMD �Ö@�iBOR, MEL, DEX�j�̗Տ��������i�s���ł���7�j�`9�j�B
�y�Q�l�����z
1�j Falk RH, et al. The systemic amyloidosis. N Engl J Med. 1997 ; 337�i13�j : 898-909.
2�j Merlini G, et al. Dangerous small B-cell clones. Blood. 2006 ; 108�i8�j : 2520-30.
3�j Mckenna RW, et al. Plasma cell neoplasms. Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, IARC ; 2008 : pp200-13.
4�j Jaccard A, et al. High-dose melphalan versus melphalan plus dexamethesone for AL amyloidosis. N Engl J Med. 2007 ; 357�i11�j : 1083-93.�i1iiA�j
5�j Comenzo R, et al. Autologous stem cell transplantation for primary systemic amyloidosis. Blood. 2002 ; 99�i12�j : 4276-82.
6�j Skinner M, et al. High-dose melphalan and autologous stem cell transplantation in the patients with AL amyloidosis : An 8-year study. Ann Intern Med. 2004 ; 140�i2�j : 85-93.�i3iiiA�j
7�j Palladini G, et al. Association of melphalan and high-dose dexamethasone is effective and well tolerated in patients with in AL �iprimary�j amyloidosis who are ineligible for stem cell transplantation. Blood. 2004 ; 103�i8�j : 2936-8.�i3iiiDiv�j
8�j Kastritis E, et al. Bortezominb with or without dexamethasone in primary systemic�ilight chain�j amyloidosis. J Clin Oncol. 2010 ; 28�i6�j : 1031-7.�i3iiiDiv�j
9�j �����q�C���D������AL �A�~���C�h�[�V�X�ɑ���{���e�]�~�u�E�����t�@�����E�f�L�T���^�]���Ö@�̈��S���ƗL�p���Ɋւ��錤���F�Տ���T/Ⅱ�������̐i���iⅡ�j�D�����J���ȓ������������������.�A�~���C�h�[�V�X�Ɋւ��钲�������ǁD����24 �N�x������v���O�����E���^�W�D2013�Gp70.
���A���S���Y��
MEL/DEX : melphalan/dexamethasone, LD-DEX : low-dose dexamethasone, BOR : bortezomib, LEN : lenalido- mide,
BMD : bortezomib/melphalan/dexamethasone, BCD : bortezomib/cyclophosphamide/dexamethasone,
CTD : cyclophosphamide/thalidomide/dexamethasone
*�ی��K�p�O
�܂��C���ƈڐA�̓K�������邩�ۂ���T�d�Ɍ�������iAL�FCQ1�C�G�r�f���X���x��2A�j�B���ƈڐA�̓K����������X�N�ɉ����ă����t�@�����iMEL�j�̌��ʂ��l�����Ď��{����B���S�t���iCR�j��������Όo�ߊώ@����B�ڐA�̓K�����Ȃ��ꍇ�́C�W���Ö@�Ƃ���MEL/DEX�CLD-DEX�C�����������iAL�FCQ2�C�G�r�f���X���x��1iiA�j�B�ŗǕ����t���iVGPR�j�����B���邢�͍Ĕ����̓{���e�]�~�u�iBOR�j�C���i���h�~�h�iLEN�j�Ȃǂ̐V�K��܂���������B
| CQ1 | �S�g��AL �A�~���C�h�[�V�X�ɑ��鎩�Ƒ������זE�ڐA���p��ʃ����t�@�����Ö@�͗\������P�����邩 |
|---|
-
�����O���[�h�J�e�S���[2B
- ���Ɩ��������זE�ڐA�͓K����T�d�ɍl�������X�N�ɉ����ă����t�@���������ʂ��Ď��{���邱�Ƃ����������B
�y�� ���z
AL �A�~���C�h�[�V�X�ɑ��鎩�Ɩ��������זE�ڐA�̌�����I��͂ł́C���ϑS�������ԁiOS�j��4.6 �N�C1 �N�ȏ㐶�������S�t���iCR�j���OS ��10 �N���z���Ă���1�j�B���t�w�ICR ������40���ɂ݂��C�����̏Ǘ��66����1 ����ȏ�̉��P�������Ă���B�{���Â̗L�p���ɂ��ẮC�Ǘ�Ώƌ����ŕW�����w�Ö@���D��Ă���ƕ��ꂽ2�j�B�������C�B��̃����_������r�����ł���IFM �̎����ł͎��ƈڐA�ƃ����t�@�����iMEL�j/�f�L�T���^�]���iDEX�j�Ƃ̔�r���s���COS �ł͈ڐA�Q22.2 �J���C���w�Ö@�Q56.9 �J���Ɖ��w�Ö@�Q���D�ʂɗD��Ă����ip��0.04�j3�j�B�����X�N�Q�ł�OS �ɗL�Ӎ��͂Ȃ��C��X�N�Q�ł�3 �NOS ���������ꂼ��58���C80���ł������B�������C�{�����ł͈ڐA�̓K���K������邭�ڐA�Q�ɏd�ǗႪ�܂܂�Ă������ƁC���̌��ʈڐA�Q�ɂ����鎡�Ê֘A���S�iTRM�j��24���ƍ������ƁC�ڐA�Q�ɂ�����ڐA���{�������Ȃ����ƁC�ώ@���Ԃ��Z�����ƂȂǎ�����̖��_���w�E����Ă���C���ƈڐA��ے肷�鍪���ɂȂ��Ă��Ȃ��BPS 2 �ȉ��C������o��40���ȏ�C�_�f�O�a�x95���ȏ�C��ʂł̎��k������90mmHg �ȏ�ł��邱�ƂȂǂ̈ڐA�K���K�������炵�C���X�N�ɉ������O���uMEL �̌��ʂ��s�����Ƃɂ��TRM ��5�����x�Ɍ������Ă���C�o���L�x�Ȏ{�݂ɂ����Ď��{���������ׂ��ł���1�j4�j5�j�B
�y�Q�l�����z
1�j Skinner M, et al. High-dose melphalan and autologous stem cell transplantation in the patients with AL amyloidosis : An 8-year study. Ann Intern Med.2004 ; 140�i2�j : 85-93.�i3iiiA�j
2�j Dispenzieri A, et al. Superior survival in primary systemic amyloidosis patients undergoing peripheral blood stem cell transplantation : A case-control study. Blood.2004 ; 103�i10�j : 3960-3.�i2A�j
3�j Jaccard A, et al. High-dose melphalan versus melphalan plus dexamethesone for AL amyloidosis. N Engl J Med. 2007 ; 357�i11�j : 1083-93.�i1iiA�j
4�j Comenzo R, et al. Autologous stem cell transplantation for primary systemic amyloidosis. Blood. 2002 ; 99�i12�j : 4276-82.�i���r���[�j
5�j Wechalekar AD, et al. Perspectives in treatment of AL amyloidosis. Br J Haematol. 2008 ; 140 �i4�j : 365-77.�i���r���[�j
| CQ2 | �ڐA�K���̂Ȃ��S�g��AL �A�~���C�h�[�V�X���҂ɂ͂ǂ̂悤�Ȏ��Â���������邩 |
|---|
-
�����O���[�h�J�e�S���[2B
- MD �Ö@�iMEL, DEX�j�����������B
�y�� ���z
�ڐA�K���̂Ȃ�AL �A�~���C�h�[�V�X�ɑ���W�����Â͊m������Ă��Ȃ��BMP �Ö@�iMEL,PSL�j�ƃR���q�`���Ƃ̃����_������r������MP �Ö@�̗D�ʐ������炩�ɂ��ꂽ���C���ϐ������Ԃ�18 �J���ł��萄���ł�����̂ł͂Ȃ�1�j�B���̌�CVAD �Ö@�iVCR, DXR, DEX�j����DEX ���s���Ă������r���N���X�`���iVCR�j�ɂ��_�o�Ő��C�h�L�\���r�V���iDXR�j�ɂ��S�Ő��C���DEX �ɂ��Ő��̖�肪���萄������Ă��Ȃ��C���݂����Ƃ��p�p����Ă���̂�MD �Ö@�iMEL/ ��p��DEX�j�ł���B96 ���ΏۂƂ���������67���ɕ����t���iPR�j�ȏ�̌��t�w�I�t�����݂��C���ʔ�����4.5 �J���ȓ��Ƒ����C������ʂ�48���ɂ݂��Ă���2�j�B�{�Ö@�͔E�e���������C���̌�̒����ώ@���ʂł͕��ϐ�������5.1 �N�C��������������3.8 �N�ł�����3�j�BMD �Ö@�Ǝ��ƈڐA�Ƃ̃����_������r�����ł��C�������Ԃ̒����l��56.9 �J���Ƃ��̗L�p�����m�F����Ă���4�j�B�������C�d�ĂȐS��Q��L����Ǘ�ɑ�����ʂ͌����Ă���B�ŋ߂ł́C�T���h�}�C�h�iTHAL�j�C���i���h�~�h�iLEN�j�C�{���e�]�~�u�iBOR�j�Ȃǂ̐V�K��܂���������C���̗L�p����������邪�C���S�����܂߂��\���ȃf�[�^���Ȃ�����ɂ���B
�y�Q�l�����z
1�j Kyle RA, et al. A trial of three regimens for primary amyloidosis : Colchicine alone, melphalan and prednisone, and melphalan, prednisone and colchicines. N Engl J Med. 1997 ; 336�i17�j : 1202-7.�i1iA�j
2�j Palladini G, et al. Association of melphalan and high-dose dexamethasone is effective and well tolerated in patients with in AL �iprimary�j amyloidosis who are ineligible for stem cell transplantation. Blood.2004 ; 103�i8�j : 2936-8.�i3iiiDiv�j
3�j Palladini G, et al. Treatment with oral melphalan plus dexamethasone produces long-term remission in AL amyloidosis. Blood. 2007 ; 110�i2�j : 787-8.�i3iiiDiv�j
4�j Jaccard A, et al. High-dose melphalan versus melphalan plus dexamethesone for AL amyloidosis. N Engl J Med. 2007 ; 357�i11�j : 1083-93.�i1iiA�j
�yPOEMS �nj�Q�z
�����_
POEMS �nj�Q�́CPolyneuropathy, Organomegaly, Endocrinopathy, M-protein, Skin lesion ���咥�Ƃ���nj�Q�ł���B�a�Ԃ̍���ɂ́C���m�N���[�i���Ȍ`���זE�̑���������B
�f�f�K�����\1 �Ɏ����B
| Major criteria | 1�F���_�o�� 2�F���m�N���[�i���Ȍ`���זE���� �i�قڏ�����^��M �`���j |
|---|---|
| Other major criteria | 3�F�L���b�X���}���a 4�F�d�������a�� 5�FVEGF �㏸ |
| Minor criteria | 6�F������ �i�B��C�̎�C�����p�ߎ�j 7�F���NJO�̉t�R�o �i����C�����C�����j 8�F������ُ� �i���t�C�b��B�C�����́C���B�C���b��B�C�X���j 9�F�畆�ُ� �i�F�f�����C���сC���ǎ�C��[�`�A�m�[�[�C���ԁj 10�F�������� 11�F���������C������ |
| Other symptoms and signs | �����w�`���C�̏d�����C�����C�x�������C���ǐ��x�����C�ǐ��ǁC �����C�r�^�~��B12 ��l |
POEMS �́CMajor criteria �����ׂĖ�����
Other major criteria ��1 �ȏ�
Minor criteria ��1 �ȏ�݂�������
�y�Q�l�����z
1�j Dispenzieri A. POEMS syndrome : 2011 update on diagnosis, risk-stratification, and management. Am J Hematol. 2011 ; 86�i7�j : 591-601.�i���r���[�j
| CQ1 | POEMS �nj�Q���҂ɑ��鎡�É���͗\������P�����邩 |
|---|
-
�����O���[�h�J�e�S���[2B
- POEMS �nj�Q���҂ɑ��鎡�É���͗\������P������B
�y�� ���z
POEMS �nj�Q�̎��ẤC�`���זE��W�I�Ƃ���������ɏ��������Â����݂��Ă����B�������C����܂łɁC�����_������r�����͍s���Ă��炸�C������̕��ΏیQ��Ȃ�������I�����ɂƂǂ܂��Ă���B
���Ö@�Ƃ��ẮC①�`���זE����݂���ꍇ�͊O�ȓI�E�o�C②�`���זE��ւ̕��ː��ƎˁC③������ɏ��������w�Ö@�C④���זE�ڐA���p��ʉ��w�Ö@��4 ������Ă���B�قƂ�ǂ͏Ǘ�ł��邪�C���̒���Despenzieri ��̕�������𒆐S�Ƃ���������I�Ȃ��̂ł�����̂�99 ����W�ς����ő�̂��̂ł���1�j�B
����ɂ��ƁC①���ǂ������d�����a�ρiosteosclerotic lesion�j�ɂ͕��ː��Ǝ˂��L���ł���C�Ǝˎ{�s�Q�́C���{�s�Q�ɔ�ׂė\�オ�ǂ��B② MP �Ö@�iMEL, PSL�j�͖�40���̏Ǘ�Ɍ��ʂ������B③���������זE�ڐA���p�����t�@�����iMEL�j��ʗÖ@27 ��̌����ł́C�S�t��������100���ł���C5 �N����������80���ȏ�ł���B���̌��ʂ́C���É�����\������P����\���������Ă���B�T���h�}�C�h�iTHAL�j�ɂ�鎡�Ì��ʂ����9 ��̏Ǘ�ł́C6 ��ɏǏ�̉��P���݂��Ă���2�j�B
POEMS �nj�Q�͐��E�I�ɂ��H�������ł���C�{�ǂɂ̓K�C�h���C�������݂��Ȃ����߁C�����ÌQ�Ǝ��É���Q�̒��ڔ�r�͂ł��Ȃ��B�������C�����Âł���Εa��͐i�s���邽�߁C�Ȃ�炩�̎��É���͍����I�ł���B�G�r�f���X���x���͒Ⴂ���̂́C���ː��ƎˁC�A���L�����܁C���זE�ڐA�̎O�҂��ɉ����Ďg�p����̂������I�Ǝv����B����C������ɏ������{���e�]�~�u�iBOR�j�CTHAL�C���i���h�~�h�iLEN�j�ɂ�鎡�×�̏W�ς����҂����B
�y�Q�l�����z
1�j Dispenzieri A, et al. POEMS syndrome : definitions and long-term outcome. Blood. 2003 ; 101�i7�j : 2496-506.�i3iiiA�j
2�j Kuwabara S, et al. Thalidomide reduces serum VEGF levels and improves peripheral neuropathy in POEMS syndrome. J Neurol Neurosurg Psychiatry. 2008 ; 79�i11�j : 1255-7.