�X����@�`�f�ÃK�C�h���C��
�K�C�h���C�������̕����ԍ�����C�Y�����镶�����X�g�փ����N����܂�
�f�f
�܂�����
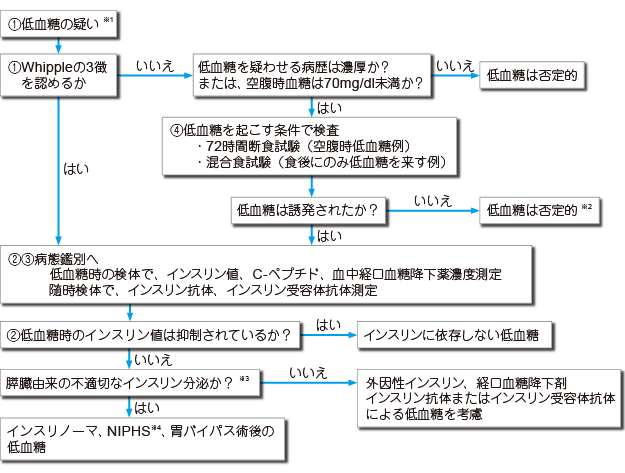
�X�E������ NET �͋@�\���̏ꍇ�Ɣ�@�\���̏ꍇ�Ŕ����̌_�@�┭�����̏�Ԃ��قȂ�B�@�\���̏ꍇ�͓��ٓI�ȏǏ�f�f����邱�Ƃ������A��r�I��������ᇂŌ����邱�Ƃ�����A���̏ꍇ��ᇂ̋Ǎ݂������ɂ����B�������Ȃ���A�����R��NET �ɂ��J���`�m�C�h�nj�Q�̏ꍇ�̂悤�ɁA�̓]�ڂȂǂ��N�����ď��߂ďǏo������ꍇ������B
����A��@�\���̏ꍇ�͓��ٓI�ȏǏ�Ȃ��i�s����Ⴊ�����A�傫���Ȃ�����≓�u�]�ڌ�ɔ�������邱�Ƃ������A�d��Ȗ��ƂȂ邱�Ƃ�����B���̏ꍇ�̔���ٓI�Ǐ�Ƃ��ĕ����c�����A���ɁA�C���E�X�Ǐ�Ȃǂ������邱�Ƃ����邪�A�摜�f�f�ŋ��R���������ꍇ������B�Ƒ����̏Ǘ�̏ꍇ������̂ŁA���ɑ����� NET �̏ꍇ��\��w���K�X �g���m�[�}�̏ꍇ�ɂ͉Ƒ����̒���ƌ����J���V�E���Z�x�̑��肪���������BMEN1 �̊ӕʂɂ́A�A���u�~����������J���V�E���Z�x�ƃC���^�N�gPTH �̑��肪���������B��������NET �̏ꍇMEN1 ���ӕʂ���K�v������B
CQ1-1�@�@�\���y�є�@�\��NET �̐f�f
| CQ1-1-1 | A �C���X���m�[�}���^���Ǐ�͉����H |
| B ���ɐ�������錟���͉����H |
����
A �Ǐ�
���̒ጌ�����삪��v�ȏǏ�ł���B
�����_�o�Ǐ�A�����_�o�Ǐ�����B�����_�o�@�\��Q������ꍇ��A�ጌ��������J��Ԃ��ꍇ�͎����_�o�Ǐ���������Ƃ�����B�܂��A�ጌ���Ǐ��o���ꂸ�A��T�^�I�ȏǏ�i�������A�F�m�ǂȂǁj�������Ǐ�̂��Ƃ����i�O���[�hA�j�B
B ����
���L�̃X�e�b�v�Œጌ���̊ӕʐf�f���s�����Ƃ����������i�ጌ���̐f�f�̃t���[�`���[�g���Q�Ɓj�i�O���[�hA�j�B�C���X���m�[�}�̊m��f�f�́A72 ���Ԑ�H�����⍬���H����������������i�O���[�hA�j�B�Ǎݐf�f�̂��߁AUS�ACT�AMRI�AEUS ���������������i�f�fCQ1-2�Q�Ɓj�i�O���[�hA�j�B�摜�����ŋǍ݂��m��f�f�ł��Ȃ��ꍇ�ɁA�J���V�E���n�t��p����SASI �e�X�g������������i�O���[�hA�j�BMEN1 �̍����̗L����f�f���邽�߂ɁA������J���V�E���Z�x����ƃC���^�N�gPTH ���肪����������i�O���[�hA�j�B
�y�� ���z
- A�C���X���m�[�}�̒ጌ������͋����������A�H��̒ጌ���̏ꍇ������B�����_�o�Ǐ�Ƃ��ĕ����A���̂�������Ō�����A�����A�ُ�s���A���Y������B�i�s����ƈӎ���Q�A�����Ɋׂ�A�����Ԃɋy�Ԃƕs�t�I�]��Q��������B����������邱�Ƃ�����B�����_�o�Ǐ�Ƃ��Ĕ����A���A���E�A�k���A�q�C�A�s�����A�������݂���B�����_�o�Ǐ�ɑO�삵�ċN���邱�Ƃ��������A�Ȃ��ꍇ������B�ጌ���Ǐ��o���ꂸ�A��T�^�I�ȏǏ�i�������A�F�m�ǂȂǁj�������Ǐ�̂��Ƃ�����1�j�B�Ƃ��Ɏ����_�o�@�\��Q������ꍇ��A�ጌ��������J��Ԃ��ꍇ2�j�͎����_�o�Ǐ���������Ƃ�����B
���_�Ǐ��낢��ł���A�����Ԑf�f�ɂ�����Ȃ����Ƃ�����̂Œ��ӂ��K�v�ł���i�R�����Q�Ɓj�B - B�ጌ���̊ӕʐf�f��3�j
- 1)Whipple ��3 ���A①�ጌ���ɍ��v����Ǐ���A②�Ǐ���Ƃ��̌����l���Ⴍ�A③�����㏸���u�ɂ��Ǐ��P���邱�Ƃ��m�F�����i�O���[�hA�j�B
- 2)�����l���ቺ���Ă���ɂ�������炸�i55 �r/dL �����A���ٓx�������߂邽�߂ɂ�45 mg/dL�i2.5 mmol/L�j�����j�A�C���X���������o�����i���芴�x�ȉ��ɗ}������Ȃ��j���Ƃ��m�F�����i�O���[�hA�j�B��������ɂ��āA�ȈՖ@�ő��肵�������l�͌덷���傫�����ߔ��f�ɗp���Ȃ��B
- 3)�O�����̃C���X�����A�o�������~���܁A�������̃C���X�����ُ핪��i�������̃C���X��������j�A�C���X�������ȖƉu�ǂ��ӕʂ��邽�ߕa���C-�y�v�`�h����уv���C���X����������s���i�O���[�hA�j�B
- 4)�m��f�f�̂��߂ɒጌ����U����������Ō������s���B���ጌ���������Ǘ�ł�72 ���Ԑ�H�������s���B�H��ɂ̂ݒጌ���������Ǘ�ł͍����H�����imixed meal test�j���s���i�O���[�hA�j�B72 ���Ԑ�H�����̎��{������ȏǗ�ŁAC�y�v�`�h�}���������L�p�Ȃ��Ƃ�����4�j�i�����O���[�hB�j�B
��H�����ȂǂŔے肳��Ă��ጌ�����J��Ԃ���ȂǂɁA�J���V�E���n�t��p����SASI �e�X�g�ōŏI�f�f�������邱�Ƃ�����5,6)�B������ᇂ��X�ɋǍ݂���B
�ጌ���̐f�f�̃t���[�`���[�g
- ��1���Ò��̓��A�a���҂ł͓��A�a�̎��Ó��e�߂��A�ጌ�������������鑼�̕a�ԁi�d�ĂȎ����A�R���`�]�[�����R�ǁA�C���X���m�[�}�ȊO�̎�ᇁAIGF-Ⅱ�Y����ᇂȂǁj�̑��݂��^����Ǘ�ł́AWhipple ��3 �����m�F��A�e�a�Ԃ̐f�f�E���Â��s���B
- ��2�U�������Ŕے肳��Ă��J��Ԃ��Ǐ��悵�ėՏ��I�ɋ^�킵���ꍇ�ɁAC-�y�v�`�h�}��������A���ɂ�SASI �e�X�g��p���ăC���X���m�[�}��NIPHS �̐f�f��������ꍇ������B
- ��3C-�y�v�`�h���}�����ꂸ�A�o�������~���܁E�C���X�����R�́E�C���X������e�̍R�̂����o����Ȃ����̂��Y������B
- ��4Noninsulinoma pancreatogenous hypoglycemia syndrome�i�@�\���̃��זE��Q�j�B
�y�� ���z
1�j Service FJ, Dale AJD, Elveback LR, Jiang N-S. Insulinoma- Clinical and diagnostic features of 60 consecutive cases. Mayo Clin Proc. 1976; 51(7): 417-429.�i���x��Ⅴ�j.
2�j Cryer PE, Axelrod L, Grossman AB, Heller SR, Montori VM, Seaquist ER, Service FJ. Evaluation and management of adult hypoglycemic disorders: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2009; 94(3): 709-728.�i���x��Ⅴ�j.
3�j Cryer PE: Glucose homeostasis and hypoglycemia. Williams Textbook of Endocrinology 11th Ed. (Kronenberg HM et al ed.), Saunders Elsevier, Philadelphia, 2008, pp1503-1533.�i���x��Ⅴ�j
4�j Service FJ, O'Brien PC, Kao PC, Young WF Jr. C-peptide suppression test: effects of gender, age, and body mass index; implications for the diagnosis of insulinoma. J Clin Endocrinol Metab. 1992; 74(1): 204-210.�i���x��Ⅴ�j.
5�j Placzkowski KA, Vella A, Thompson GB, Grant CS, Reading CC, Charboneau JW, Andrews JC, Lloyd RV, Service FJ.Secular trends in the presentation and management of functioning insulinoma at the Mayo Clinic, 1987-2007.J Clin Endocrinol Metab. 2009; 94(4): 1069-1073.�i���x��Ⅴ�j
6�j Guettier JM, Kam A, Chang R, Skarulis MC, Cochran C, Alexander HR, Libutti SK, Pingpank JF, Gorden P. Localization of insulinomas to regions of the pancreas by intraarterial calcium stimulation: the NIH experience. J Clin Endocrinol Metab. 2009; 94(4): 1074-1080.�i���x��Ⅴ�j
| CQ1-1-2 | A �K�X�g���m�[�}���^���Ǐ�͉����H |
| B ���ɐ�������錟���͉����H |
����
A �Ǐ�
�ݎ_�ߏ蕪��ɂ���������ᇂ�t�����H�����i�o���A���ɁA���₯�j�ƁA�X�y�f�s�������ɂ�鉺��������B��ᇂ̓����Ƃ��āA����ɂ����A�e�ՂɍĔ�����A��������ᇁA�\��w�����s�r�ȍ~�̒�ᇁA���E�Ȃǂ������i�O���[�hA�j�B
B ����
�ӕʐf�f�̂��߂ɁA�������K�X�g�����Z�x�ƁA�ݎ_���呪�茟�����邢��24 ����pH ���j�^�[�������K�{�ł����i�O���[�hA�j�A�J���V�E���Ò������܂��̓Z�N���`���Ò��������L�p�ł����i�O���[�hA�j�BMEN1 �̍����̗L����f�f���邽�߂ɁA������J���V�E���Z�x����ƃC���^�N�gPTH ���肪����������i�O���[�hA�j�B�Ǎݐf�f�̂��߁AUS�ACT�AMRI�AEUS �����iCQ1-2���Q�Ɓj�ASASI �e�X�g������������i�O���[�hA�j�B
�y�� ���z
�K�X�g���m�[�}�ł͏�������ᇂ�9 ���ȏ�̊��҂ɔF�߂��A1 �p�����̒P������ᇂ������B�\��w���̋���(75��)�A�����ŏ\��w�����ʁi14���j�A�i11���j�ɑ����������A�Ĕ����₷���B���ɁA���b���������悭������1, 2)�B
�m��f�f�ɂ́A�����K�X�g�����Z�x�̍��l�ƈݎ_�̉ߏ蕪�傪�������邱�Ƃ��ؖ�����B���̂��ߋ������K�X�g�����Z�x�̑���ƈݎ_����̕]�����s��1)�B
���K�X�g�������ǂ𗈂������E�a�Ԃɂ́A�w���R�o�N�^�[�E�s�����ۊ����A�����t�s�S�A�ޏk���݉��Ȃǂɂ��G �זE�ߌ`���APPI ���������Ȃǂ�����BPPI �� H2 ��e�̝h�R��g�p���̍��K�X�g�����l�ɂ��ẮA�f�f�̗L�p���͂Ȃ��BPPI �g�p���҂ł́A���Ȃ��Ƃ�1 �T�ԑO����PPI �𒆎~���āA�����K�X�g�����Z�x�𑪒肷��K�v�����邪�A��ᇍĔR�Ȃǂ̃��X�N�����邱�Ƃ𒍈ӂ��Ȃ���Ȃ�Ȃ��iPPI ���~��ɒ�ᇍĔR��ݎ_�ߏ蕪��Ǐ����Ȃ������҂ɂ� H2 ��e�̝h�R��𓊗^���A�����48 ���ԑO�ɒ��~���đ��肷��)�B�����K�X�g�����Z�x�́A�K�X�g���m�[�}���҂�2/3 �Ő������l��10 �{�ȉ��ł���3)�B1,000 pg/mL �ȏ�̏Ǘ�ł̓K�X�g���m�[�}�������^���邪�A�ݎ_����}���p���Ȃ��A�ޏk���݉����Ȃ����҂Ō����K�X�g�����Z�x��150 �ȏ�1,000 pg/mL �����̏Ǘ�ł́A�ӕʂ̂��ߕ��������s�����Ƃ��]�܂���3�A4)�B�ݐ؏���̊��҂ł�80 pg/mL �ȏ�ō��K�X�g�������ǂƔ��f����B�킪���ł͔̔����I�������Z�N���`��4)�ɑ���J���V�E���Ò�����5)���s���Ă���A�f�f���͂قړ����ł���B
�ݎ_�����24 ���Ԉݓ�pH ���j�^�����O�������͋��̈ݓ�pH �𑪒肵�A24 ���ԃ��j�^�����O�ł�pH<2 holding time ��90���ȏ�̂Ƃ��A��pH �ł�pH <2�������ĉߎ_��ԂƔ��f����B�K�X�g���m�[�}���҂�99 ���ŋ��ݓ�pH ��2 �ȉ��ł���6)�B�Ǎݐf�f�Ƃ��ĉ摜�f�f�iUS�ACT�AMRI�A�\��w���������j���s���iCQ1-2���Q�Ɓj�B�����ȃK�X�g���m�[�}�̋@�\���Ǎݐf�f�Ƃ��ăZ�N���`�����邢�̓J���V�E���n�t��p����SASI �e�X�g���L�p�ł���7�C8)�B������ᇂ��X�A�\��w���ɑ������ُ����K�X�g�����Y����ᇂ̕�����B
�y�� ���z
1�j Jensen RT, Cadiot G, Brandi ML, deHerder WW, Kaltsas G, Komminoth P, Scoazec JY, Salazar R, Sauvanet A, Kianmanesh R. ENETS consensus guidelines for the management of patients with digestive neuroendocrine neoplasms: Functional pancreatic endocrine tumor syndromes.Neuroendocrinology. 2012; 95(2): 98-119.�i���x��Ⅵ�j
2�j Roy PK, Venzon DJ, Shojamanesh H, AbouSaif A, Peghini P, Doppman JL, Gibril F, Jensen RT. Zollinger-Ellison syndrome. Clinical presentation in 261 patients. Medicine (Baltimore). 2000; 79(3): 379-411.�i���x��Ⅳb�j
3�j Berna MJ, Hoffmann KM, Serrano J, Gibril F, Jensen RT. Serum gastrin in Zollinger-Ellison syndrome: I. Prospective study of fasting serum gastrin in 309 patients from the National Institutes of Health and comparison with 2229 cases from the literature. Medicine (Baltimore). 2006; 85(6): 295-330.�i���x��Ⅳa�j
4�j Berna MJ, Hoffmann KM, Serrano J, Gibril F, Jensen RT. Serum gastrin in Zollinger-Ellison syndrome: II. Prospective study of gastrin provocative testing in 293 patients from the National Institutes of Health and comparison with 537 cases from the literature, evaluation of diagnostic criteria, proposal of new criteria, and correlations with clinical and tumoral features. Medicine (Baltimore). 2006; 85(6): 331-364.�i���x��Ⅳa�j.
5�j Wada M, Komoto I, Doi R, Imamura M. Intravenous calcium injection test is a novel complementary procedure in differential diagnosis for gasrinoma. World J Surgery 2002; 26(10): 1291-1296.�i���x��Ⅴ�j
6�j Roy PK, Venzon DJ, Feigenbaum KM, Koviack RD, Bashir S, Ojeaburu JV, Gibril F, Jenmsen RT. Gastric secretion in Zollinger-Ellison syndrome. Correlation with clinical expression, tumor extent and role in diagnosis - a prospective NIH study of 235 patients and a review of 984 cases in the literature. Medicine (Baltimore). 2001; 80(3): 189-222.�i���x��Ⅳb�j
7�j Imamura M, Takahashi K, Adachi H, Minematsu S, Shimada Y, Naito M, Suzuki T, Tobe T, Azuma T. Usefulness of selective arterial secretin injection test for localization of gastrinoma in the Zollinger-Ellison sundrome. Ann Surg. 1987; 205(3): 230-239.�i���x��Ⅴ�j
8�j Imamura M. Recent standardization of treatment strategy for pancreatic neuroendocrine tumors. World J Gastroenterol. 2010; 16(36): 4519-4525.�i���x��Ⅵ�j.
| CQ1-1-3 | A �O���J�S�m�[�}���^���Ǐ�͉����H |
| B ���ɐ�������錟���͉����H |
����
A �Ǐ�
�V�������g���A�ϓ��\��Q�ⓜ�A�a�A��A�~�m�_���ǁA��A���u�~�����ǁA�̏d�����A�n���Ȃǂ�����B�܂��A�Ö������ǂ�_�_�o�Ǐ�(�����Ǐ�A�F�m�ǁA���_�o�ޏk�A�߈ʋ؋ؗ͒ቺ���F�߂����i�O���[�hA�j�B�V�������g�����Ȃ��ꍇ������B
B ����
�����O���J�S������ƌ����A�~�m�_�Z�x���肪����������i�O���[�hA�j�BMEN1 �̍����̗L���̐f�f���߂ɁA������J���V�E���Z�x����ƃC���^�N�gPTH ���肪����������i�O���[�hA�j�B�Ǎݐf�f�̂��߁AUS�ACT�AMRI�AEUS ���������������iCQ1-2���Q�Ɓj�B
�y�� ���z
�O���J�S�m�[�}�̐f�f�͏Ǐ�^�����Ƃ����������1-3�j�B�V�������g���i80 ���j�͓����I�ł��邪�A�h�{��Q�A�Z���nj�Q�Ȃǂ̃O���J�S�m�[�}�ȊO�̌����ɂ���Ă��N����4�j�B�f�f�ɂ͌����O���J�S���l���L�p�ł���B�O���J�S�m�[�}�Ǘ�̃O���J�S�������Z�x��500 pg/mL ���邱�Ƃ������B�Ȃ��A�����O���J�S���l�͗l�X�Ȍ����Ő����I�͈͓��̏㏸���F�߂���B�ጌ���A�A�s���ǁA�O���A������p�A�}���X���A�N�b�V���O�nj�Q�A �t�s�S�A�̕s�S�Ȃǂł���B�����̏ꍇ�A�����O���J�S���l�̏㏸500 pg/mL �����ɂƂǂ܂鎖������3, 5�j�B������ᇂ��X�ɋǍ݂��邱�Ƃ������B
�y�� ���z
1�j Parker CM, Hanke CW, Madura JA, Liss EC, Glucagonoma syndrome: case report and literature review. J Dermatol Surg Oncol. 1984; 10(11): 884-889.�i���x��Ⅴ�j
2�j Soga J, Yakuwa Y, Glucagonomas/diabetico-dermatogenic syndrome (DDS): a statistical evaluation of 407 reported cases. J Hepatobiliary Pancreat Surg. 1998; 5(3): 312-319.�i���x��Ⅴ�j
3�j Wermers RA, Fatourechi V, Wynne AG, Kvols LK, Lloyd RV. The glucagonoma syndrome. Clinical and pathologic features in 21 patients. Medicine(Baltimore). 1996; 75(2): 53-63.�i���x��Ⅴ�j
4�j Mullans EA, Cohen PR. Iatrogenic necrolytic migratory erythema: a case report and review of nonglucagonoma-associated necrolytic migratory erythema. J Am Acad Dermatol. 1998; 38(5 Pt 2): 866-873.�i���x��Ⅵ�j
5�j Wermers RA, Fatourechi V, Kvols LK.Clinical spectrum of hyperglucagonemia associated with malignant neuroendocrine tumors.Mayo Clin Proc. 1996; 71(11): 1030-1038.�i���x��Ⅴ�j
| CQ1-1-4 | A VIP �I�[�}���^���Ǐ�͉����H |
| B ���ɐ�������錟���͉����H |
����
A �Ǐ�
��ʂ̐��l�����ƒ�J���E�����ǁA��N���[�����ǁA��Ӑ��A�V�h�[�V�X�Ȃǂł���B�܂��A��J���E�����ǂ�E���ɂ���J���A�ؗ͒ቺ�A����A�ؓ��̂������A��A���̑��ɁA�f���C�A�q�f�A�畆���g�⍂�����A���J���V�E�����ǂ������i�O���[�hA�j�B
B ����
����VIP �Z�x���肪���������i�ی������ځj�i�O���[�hA�j�B�ӕʐf�f�ɕւ�osmotic gap �̑��肪�L�p�ł����i�O���[�hA�j�BMEN1 �̍����̗L���̐f�f���߂ɁA������J���V�E���Z�x����ƃC���^�N�gPTH ���肪����������i�O���[�hA�j�B�Ǎݐf�f�̂��߁AUS�ACT�AMRI�AEUS ���������������iCQ1-2���Q�Ɓj�i�O���[�hA�j�B
�y�� ���z
- AVIP �I�[�}�̉����͕��含�����ň��700 mL �ȏ�ł���A��H��Ԃł�������̂������ł���B7 ���̊��҂ň��3,000 mL �ȏ�̉������N����B�ւ͍g���F�ŁA�ɂ������Ȃ��Aosmotic gap ���Ⴂ�Ȃǂ̕��含�����̓����������B���ɂ͂Ȃ����A�y�x�ł���1-7�j�B�����P���ʐ^�Ŋg���������ǂ��F�߂���B
- BVIP �I�[�}������ᇂ́A���l�ł��X������3 cm �ȏ�̎�ᇂƂ��Č����邱�Ƃ�����4�j���A�����ǂɂ���������B�����ł�2-4 �ɑ����A�����_�o�߂╛�t�ɔ������邱�Ƃ�����5�j�B
�y�� ���z
1�j Grier JF. WDHA (watery diarrhea, hypokalemia, achlorhydria) syndrome: clinical features, diagnosis, and treatment. South Med J. 1995; 88(1): 22-24.�i���x��Ⅵ�j
2�j American Gastroenterological Association medical position statement: guidelines for the evaluation and management of chronic diarrhea. Gastroenterology. 1999; 116(6): 1461-1463.�i���x��Ⅵ�j
3�j Fine KD, Schiller LR. AGA technical review on the evaluation and management of chronic diarrhea. Gastroenterology. 1999; 116(6): 1464-1486.�i���x��Ⅵ�j
4�j Kirkwood KS, Debas HT. Neuroendocrine tumors: common presentations of uncommon diseases. Compr Ther. 1995; 21(12): 719-725.�i���x��Ⅵ�j.
5�j Davies RP, Slavotinek JP, Dorney SF. VIP secreting tumours in infancy. A review of radiological appearances. Pediatr Radiol. 1990; 20(7): 504-508.�i���x��Ⅴ�j
6�j Krejs GJ. VIPoma syndrome. Am J Med. 1987; 82(5B): 37-48.�i���x��Ⅴ�j
7�j Mekhjian HS, O'Dorisio TM. VIPoma syndrome. Semin Oncol. 1987; 14(3): 282-291.�i���x��Ⅴ�j
| CQ1-1-5 | A �J���`�m�C�h�nj�Q���^���Ǐ�͉����H |
| B ���ɐ�������錟���͉����H |
����
A �Ǐ�
�����A�畆���g�A�b�A�S�s�S�i���ɉE�S�n�j�A�y���O���Ǐ�irough scaly skin, �㉊, ���p���j�Ȃǂ�����A������悷�邱�Ƃ������i�O���[�hA�j�B
B ����
�Z���g�j���̑�ӎY���ł���A��5-HIAA�i24 ���Ԓ~�A�j�̑��肪����������i�O���[�hA�j�BUS�ACT�AMRI�AEUS ���������������i�f�fCQ1-2�Q�Ɓj�i�O���[�hA�j�BMEN1 �̍����̗L���̐f�f���߂ɁA������J���V�E���Z�x����ƃC���^�N�gPTH ���肪����������i�O���[�hA�j�B
�y�� ���z
- A�����A�~���i�Z���g�j���A�q�X�^�~���j�A�^�L�L�j���A�v���X�^�O�����W���Ȃ�NET ���Y���A���傷�镡���̐������������ɂ���đ��ʂȏǏo������1-3)�B�Ȃ��ł����NJg���ɂ��畆�g���͓����I�Ŋ�ʑO�����𒆐S�ɏo�����A������Ȃ��idry flushing�j�B
����������Ɗ�ʂ̖э��NJg���̓`�A�m�[�[�l�ƂȂ�B�̓]�ڂ������R��NET �ł́A��q�̏Ǐ�����1)�A��NET �̓q�X�^�~�����Y�����邽���y�]�����^�I�Ȕ畆���g�������A��������ᇂ�����2)�B�nj�Q���N����������ᇂ́A�����ɋC�ǎx�A�x�A���ǂɔ�������B���ǂł͏����������������A�咰�Ȃǂ�NET �ł���������B���ɂ��X�A���B�A�b��B�ɔ������邱�Ƃ�����B - B�A��5-HIAA ����̊��x��60-73���A���ٓx��90-100���ł���B�����̐H�i�i�A�{�K�h�A�o�i�i�A�`���R���[�g�Ȃǁj�̐ێ���i�i�A�Z�g�A�~�m�t�F���A�A�Z�g�A�j���h�A�J�t�F�C���Ȃǁj�̕��p�ɂ���ċU�z���ɂȂ邱�Ƃ�����̂Œ��ӂ��K�v�ł���B�����N�����O���j��A ���肪�L�p�ł��邪�{�M�ł͖����F�ł���B
�y�� ���z
1�j Norheim I, Oberg K, Theodorsson-Norheim E, Lindgren PG, Lundqvist G, Magnusson A, Wide L, Wilander E. Malignant carcinoid tumors. An analysis of 103 patients with regard to tumor localization, hormone production, and survival. Ann Surg. 1987; 206(2): 115-125.�i���x��Ⅴ�j
2�j Ahlman H, Wangberg B, Nilsson O, Grimelius L, Granerus G, Modlin IM, Stenqvist O, Schersten T. Aspects on diagnosis and treatment of the foregut carcinoid syndrome.Scand J Gastroenterol. 1992; 27(6): 459-471.�i���x��Ⅴ�j
3�j Pellikka PA, Tajik AJ, Khandheria BK, Seward JB, Callahan JA, Pitot HC, Kvols LK. Carcinoid heart disease. Clinical and echocardiographic spectrum in 74 patients. Circulation. 1993; 87(4): 1188-1196.�i���x��Ⅴ�j
| CQ1-1-6 | A �\�}�g�X�^�`�m�[�}���^���Ǐ�͉����H |
| B ���ɐ�������錟���͉����H |
����
A �Ǐ�
�̏d�����A���ɂ̂ق��A���A�a�A�_�ΏǁA���b�ցA�����A�n���Ȃǂ�����B���Ǐ�̏ꍇ�������i�O���[�hA�j�B
B ����
�����\�}�g�X�^�`���Z�x�̑��肪����������i�O���[�hA�j�B�Ǎݐf�f�̂��߁AUS�ACT�AMRI�AEUS ���������������iCQ1-2���Q�Ɓj�i�O���[�hA�j�BMEN1 �̍����̗L���̐f�f���߂ɁA������J���V�E���Z�x����ƃC���^�N�gPTH ���肪����������i�O���[�hA�j�B
�y�� ���z
�\�}�g�X�^�`���̗L�����X�̃z����������}����p�Ɋ֘A�����Ǐ�����B�ł������Ǐ�͕��ɂƑ̏d�����ł���B�X�\�}�g�X�^�`�m�[�}�ɂ�����3 �咥�ł��铜�A�a�A�_�ΏǁA�����������͎��b�ւ�������1, 2)�B����A�\��w���R���̃\�}�g�X�^�`�m�[�}�ł͓T�^�I�ȏǏ�͔F�߂��Ȃ����Ƃ������A�苒���a�ςƂ��Ă̕��ɂ≩�t�Ȃǂ̏Ǐ�ł���2-4)�B�_�o���ێ��1 �^(NF1; von Recklinghausen �a)�ŏ\��w���\�}�g�X�^�`�m�[�}���������邱�Ƃ�����2, 3, 5)�B
�f�f�ɂ́A�������\�}�g�X�^�`���Z�x�𑪒肷��1, 2, 4)�B160 pg/mL �ȏ�ł���ꍇ�ɋ^����B�\�}�g�X�^�`�m�[�}�nj�Q��ł͍��l�ł��邪�A�\��w���\�}�g�X�^�`�m�[�}�ł͐���͈͂̂��Ƃ������B�Ǎݐf�f�Ƃ��ĉ摜�f�f(US�ACT�AMRI�A�\��w��������)���s��1, 2)�iCQ1-2���Q�Ɓj�B��ᇂ��X�Ə\��w���̗����ɋǍ݂���B
�y�� ���z
1�j Krejs GJ, Orci L, Conlon JM, Ravvazzola M, Davis GR, Raskin P, Collins SM, McCarthy DM, Baetens D, Rubenstein A, Aldor TAM, Unger RH. Somatostatinoma syndrome. Biochemical, morphologic and clinical features. N Engl J Med. 1979; 301(6): 285-292.�i���x��Ⅴ�j.
2�j Soga J, Yakuwa Y. Somatostatinoma/inhibitory syndrome: a statistical evaluation of 173 reported cases as compared to other pancreatic endocrinomas. J Exp Clin Cancer Res. 1999; 18(1): 13-22.�i���x��Ⅳb�j.
3�j Garbrecht N, Anlauf M, Schmitt A, Henopp T, Sipos B, Raffel A, Eisenberger CF, Knoefel WT, Pavel M, Fottner C, Musholt TJ, Rinke A, Arnold R, Berndt U, Plockinger U, Wiedenmann B, Moch H, Heitz PU, Komminoth P, Perren A, Kloppel G. Somatostatin-producing neuroendocrine tumors of the duodenum and pancreas: incidence, types, biological behavior, association with inherited syndromes, and functional activity. Endocr Relat Cancer. 2008; 15(1): 229-241.�i���x��Ⅳb�j.
4�j Tanaka S, Yamasaki S, Matsushita H, Ozawa Y, Kurosaki A, Takeuchi K, Hoshihara Y, Doi T, Watanabe G, Kawaminami K. Duodenal somatostatinoma: a case report and review of 31 cases with special reference to the relationship between tumor size and metastasis. Pathol Int. 2000; 50(2): 146-152.�i���x��Ⅴ�j.
5�j Mao C, Shah A, Hanson DJ, Howard JM. Von Rechlinghausen�fs disease associated with duodenal somatostatinoma: contrast of duodenal versus pancreatic somatostatinomas. J Surg Oncol 1995; 59(1): 67-73.�i���x��Ⅴ�j.
| CQ1-1-7 | A ��@�\��NET �Ɍ�����Ǐ�͉����H |
| B ��@�\��NET �̐f�f�ɗL�p�Ȍ����͉����H |
����
A �Ǐ�
�Ǐ�Ƃ��ẮA���ٓI�Ȃ��̂͂Ȃ��i�O���[�hA�j�B
B ����
US�ACT�AMRI�AEUS �����iCQ1-2���Q�Ɓj�Ɗӕʐf�f�̂��߂ɁA�g�D�f�A�זE�f�i�a���̍����Q�Ɓj������������i�O���[�hA�j�BMEN1 �̍����̗L���̐f�f���߂ɁA������J���V�E���Z�x����ƃC���^�N�gPTH ���肪����������i�O���[�hA�j�B
�y�� ���z
- A���ٓI�ȏǏ�͂Ȃ��B��ᇑ���ɔ�������ٓI�Ǐ�Ƃ��ĕ����c�����A���ɁA�C���E�X�Ǐ�Ȃǂ������邱�Ƃ�����1�j�B
- B�p�O�ɑg�D�f�f���s���K�v������ꍇ�ɂ�EUS-FNA �����߂���i�a���̍����Q�Ɓj�B�f�f��o�ߊώ@�ɂ��Ă͌����N�����O���j��A ����̗L�p��������Ă���2)�B
�y�� ���z
1�j Ito T, Sasano H, Tanaka M, Osamura RY, Sasaki I, Kimura W, Takano K, Obara T, M Ishibashi, K Nakao, R Doi, A Shimatsu, Nishida T, Komoto I, Hirata Y, Imamura M, Kawabe K, Nakamura K. Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan. J. Gastroenterol. 2010; 45(2): 234-243. �i���x��Ⅳb�j
2�j Modlin IM, Gustafsson BI, Moss SF, Pavel M, Tsolakis AV, Kidd M.Chromogranin A-biological function and clinical utility in neuro endocrine tumor disease. Ann Surg Oncol. 2010; 17(9): 2427-2443.�i���x��Ⅵ�j
| CQ1-2 | A ��@�\������ы@�\���XNET �̋Ǎݐf�f�ɐ�������錟���͉����H |
| B ��@�\������ы@�\���XNET �̉摜�����̓����͉����H |
����
A ����
US�ACT�AMRI�AEUS����������������i�O���[�hA�j�B�@�\��NET �ɂ�SASI �e�X�g������������i�O���[�hB�j�B
B ����
��@�\���XNET �͉摜������A���E���ĂȁA�������[������ᇂƂ��Ă̓������������Ƃ������B
�y�� ���z
- A�̊O��US �̌��o����80�����x�ƕ���Ă���BEUS ���s���Ό��o����92���܂Ō��シ��1)�B��ᇂ��X�����̏ꍇ�ɂ�US �ł͌��o������ȏꍇ������BCT�ł�MDCT�ɂ�鑢�e�_�C�i�~�b�NCT ���s�����Ƃ�83���̌��o��������Ă���2)�B���Ƀ��[�h���e�ܐÒ��J�n�����40 �b��ɎB�e�������������i�X�������Ƃ��Ă��j�̌��o�����ł�����2)�BMRI �Ɋւ��Ă͑��e�_�C�i�~�b�NMRI ���ł��D��Ă���A�_�C�i�~�b�NCT �Ɠ����̌��o��������Ă���3)�B�@�\��NET ���摜�����Őf�f�Ɏ���Ȃ��ꍇ��A����NET �������A�Ǎݐf�f���K�v�ȏꍇ��SASI �e�X�g���L�p�ł���B
- BUS �ł́A���E���Ăȉ~�^���邢�͗��~�`�̒�G�R�[��ᎂł���B�����G�R�[�͋ψ�ł��邪�A���ɕs�ψ�ƂȂ邱�Ƃ�����4), 5)�B
CT �ł́A���e�_�C�i�~�b�NCT �̓��������璘���Ȏ�ᇔZ����F�߁A���t���܂ő��e���ʂ�F�߂�2,6)�B�傫�Ȏ�ᇂł͓������s�ψ�ł���A嚢�E�ϐ��icystic change�j�A�inecrosis�j�A�ΊD���icalcification�j�A���ۉ��ifibrosis�j���p�x�������Ȃ�A���e�p�^�[�����ω����Ă���5, 7)�B5-10���̕p�x�ōL�͂�嚢�E�ϐ��ɂ��P�[���X嚢�E����ᇂ̌`�Ԃ�����8)�B�����X嚢�E����ᇂƂ̊ӕʂɂ�hypervascular rim �i�ǂ̋����Z���j�̏������L�p�ł���9)�B
MRI �ł́AT1 �������Œ�M���AT2 �������ł��X�NJ���荂�M����悷��X���ɂ���10)�BSRS�i111In-octroetide�A68Ga-DOTATOC/PET-CT�j��NET�Ƒ��̎�ᇂƂ̐f�f�ɗL�p�ȉ摜�����ł��邪�A�{�M�ł͕ی������ڂł���BFDG-PET�i�ی������ځj��NET �iG1, G2�j���X�������ᇂ̌��o���͒Ⴍ�A�ϋɓI�Ɋ��߂��錟���ł͂Ȃ��BNEC�ł͏W�ς�F�߂�11)�B
�y�� ���z
1�j Bean SM, Baker A, Eloubeidi M, Eltoum I, Jhala N, Crowe R, Jhala D, Chhieng DC.EUS is still superior to multidetector computerized tomography for detection of pancreatic neuroendocrine tumors. Gastrointest Endosc. 2010; 73(4): 691-696.�i���x��Ⅳb�j
2�j Fidler JL, Fletcher JG, Reading CC, Andrews JC, Thompson GB, Grant CS, Service FJ. Preoperative detection of pancreatic insulinoma on multiphasic helical CT. AJR Am J Roentgenol. 2003; 181(3): 775-780.�i���x��Ⅳa�j
3�j Ichikawa T, Peterson MS, Federle MP, Baron RL, Haradome H, Kawamori Y, Nawano S, Araki T. Islet cell tumor of the pancreas: biphasic CT versus MR imaging in tumor detection. Radiology. 2000; 216(1): 163-171.�i���x��Ⅳb�j
4�j Atiq M, Bhutani MS, Bektas M, Lee JE, Gong Y, Tamm EP, Shah CP, Ross WA, Yao J, Raju GS, Wang X, Lee JH. EUS-FNA for Pancreatic Neuroendocrine Tumors: A Tertiary Cancer Center Experience. Dig Dis Sci. 2012; 57(3): 791-800.�i���x��Ⅳb�j
5�j Lewis RB, Lattin GE, Paal E. Pancreatic endocrine tumors: radiologic clinicopathologic correlation. RadioGraphics. 2010; 30(6): 1445-1464.�i���x��Ⅴ�j
6�j Van Hoe L, Gryspeerdt S, Marchal G, Baert AL, Mertens L. Helical CT for the preoperative localization of islet cell tumors of the pancreas: value of arterial and parenchymal phase images. AJR Am J Roentgenol. 1995; 165(6): 1437-1439.�i���x��Ⅳb�j
7�j Buetow PC, Miller DL, Parrino TV, Buck JL. Islet cell tumors of the pancreas: clinical, radiologic, and pathologic correlation in diagnosis and localization. RadioGraphics. 1997; 17(2):453-472.�i���x��Ⅴ�j
8�j Volkan Adsay N. Cystic lesions of the pancreas. Mod Pathol. 2007; 20(suppl 1): S71-S93. �i���x��Ⅴ�j
9�j Ligneau B, Lombard-Bohas C, Partensky C, Valette PJ, Calender A, Dumortier J, Gouysse G, Boulez J, Napoleon B, Berger F, Chayvialle JA, Scoazec JY. Cystic endocrine tumors of the pancreas: clinical, radiologic, and histopathologic features in 13 cases. Am J Surg Pathol. 2001; 25(6): 752-760.�i���x��Ⅳb�j
10�j Thoeni RF, Mueller-Lisse UG, Chan R, Do NK, Shyn PB. Detection of small, functional islet cell tumors in the pancreas: selection of MR imaging sequences for optimal sensitivity. Radiology. 2000; 214 (2): 483-490.�i���x��Ⅳb�j
11�j Rufini V, Calcagni ML, Baum RP. Imaging of neuroendocrine tumors. Semin Nucl Med. 2006; 36(3): 228-247.�i���x��Ⅴ�j
| CQ1-3 | A ������NET �̓����������̓����͉����H |
| B ���ɐ�������錟���͉����H |
����
A ����
������NET �̓����I�����������́A�މ~�`�̔S������ᇗl���N�ł���A���傷��Β��S�����ᇌ`�����i�O���[�hB�j�B
B ����
�����������̎��ɐ�������錟���́A�������������AEUS�ACT�AMRI �����ł����i�O���[�hA�j�B
�y�� ���z
������NET �̓����������͔������ʂɂ���̍��͔F�߂邪�A�S���[�w�ɂ��������זE��蔭�����c�����ɔ��炷�邽�߁A�T�^�I�ɂ͕\�ʕ����ŗމ~�`�A���s���̔S������ᇗl���N��悷��1-3)�i�}�P�j�B�F���͉��F���ł��邱�Ƃ��������A����F���ł��邱�Ƃ�����1-3)�B����ɔ����A�\�ʂɒ��S�����ᇌ`����1-3)�B���N�̗����オ��͖��s���ł��邱�Ƃ��������A���L�s���̗����オ����������Ƃ�����1-3)�B�\�ʂ̊g���������Ǔ�������r�I�悭�����鏊���ł���1)�B
������NEC �͊T���Đi�s������ԂŔ�������A2 �^�A3 �^�i�s���̌`�Ԃ��Ƃ�ꍇ�������A�܂��A���N���ɂ͔S������ᇗl�̗v�f��F�߂�ꍇ�������B
������������������NET ���^��ꂽ�ꍇ�́A�f�f�m��̂��ߓ��������������s���BNET �͔S������ᇗl�̌`�Ԃ��������A�S���[�w���甭�������a�ςł��邽�߁A�������������ɂ��g�D�w�I�f�f���͍���3)�B�����ʼnA���̏ꍇ�AEUS-FNA ��Asm �܂łɂƂǂ܂�a�ςł���A�������I�؏��ɂ�鎡�ÓI�f�f�����������B
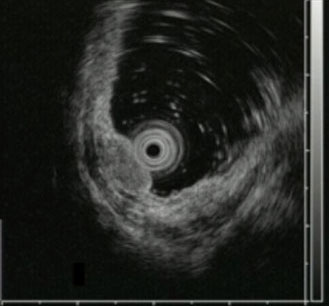
���Õ��j����̂��ߐ[�B�x�f�f�A��ᇃT�C�Y�v�����d�v�ł��邪�A����ɂ�EUS ���L�p�ł���4)�BEUS ��A������NET �͋��E���ĂȒ�G�R�[�̎�ᎂƂ��ĕ`�o����i�}�Q�j�A�[�B�x�f�f�\�͍���4)�B�����p�ߓ]�ڂ≓�u�]�ڂ̗L���̐f�f�ɂ�CT ���L�p�ł���5)�B�̓]�ڂ̌��̐f�f�\���r�����MRI ���ł��D��Ă����B
�y�� ���z
1�j ���эL�K, ���㒉�F, �Óc���Y, ���{��V, ���썎��, �c�����F, �e�r�z��, �a�c�z�q, �����P��, �≺����, �H���N�i, �ѓc�O�Y, �������j, ���R��. �����J���`�m�C�h��ᇂ̉摜�f�fX ���E�������EEUS: �]�ڗ�Ɣ�]�ڗ�̔�r�𒆐S�� �݂ƒ� 2005; 40(2): 163-174.�i���x��Ⅳb�j
2�j Kim BN, Sohn DK, Hong CW, Han KS, Chang HJ, Jung KH, Lim SB, Choi HS, Jeong SY, Park JG. Atypical endoscopic features can be associated with metasitasis in rectal carcinoid tumors. Surg Endosc 2008;22:1992-1996.�i���x��Ⅳb�j
3�j Shim KN, Yang SK, Myung SJ, Chang HS, Jung SA, Choe JW, Lee YJ, Byeon JS, Lee JH, Jung HY, Hong WS, Kim JH, Min YI, Kim JC, Kim JS. Atypical endoscopic features of rectal carcinoids. Endoscopy. 2004; 36(4): 313-316.�i���x��Ⅳa�j
4�j Ishii N, Noriki N, Itoh T, Maruyama M, Matsuda M, Setoyama T, Suzuki S, Uchida S, Ueyama M, Iizuka Y, Fukuda K, Suzuki K, Fujita Y. Endoscopic submucosal dissection and preoperative assessment with endoscopic ultrasonogoraphy for the treatment of rectal carcinoid tumor. Surg Endosc. 2010; 24(6): 1413-1419.�i���x��Ⅴ�j
5�j Fujimoto Y, Oya M, Kuroyanagi H, Ueno M, Akiyoshi T, Yamaguchi T, Muto T. Lymph-node metastasis in rectal carcinoids. Langenbecks Arch Surg. 2010; 395(2): 139-142.�i���x��Ⅴ�j
| CQ1-4 | A �ǂ̂悤��NET ��MEN1 �������^�����H |
| B ��������錟���͉����H |
����
A �Ǐ�
CQ1-5�Q�ƁB
B ����
�A���u�~��������J���V�E���Z�x�ƃC���^�N�gPTH ���肪����������i�O���[�hA�j�iMEN1 �̍����Q�Ɓj1�j�B���v�����N�`�����ǂ��^����ꍇ�͌����v�����N�`���l�̑��肪���������2�j�B��[����ǂ̏Ǐ�����ꍇ�́A����GH ��IGF1 �̑���A���������ł�GH �̒�l�̑��肪���������3�j�B
�y�� ���z
- A���J���V�E�����ǂŋ��R������ǗႪ�����B�@�\��NET �̏Ǐ�̑��ɕ��ɂ⌌�A�Ȃǂ̔A�H���Δ���̏Ǐ���������ᇂ������邱�Ƃ�����B���v�����N�`�����ǂɂ�閳���o�A���`����A���@�\��Q�������邱�Ƃ�����BGH �Y����ᇂ�GHRH �Y����ᇂɂ���[����ǂ⋐�l�ǂ̏Ǐ����邱�Ƃ�����B
- B�����J���V�E���Z�x����̓A���u�~������s�����Ƃ��d�v�ł���BPTH ����̓C���^�N�gPTH ���肪�ӂ��킵���AC ���[PTH �̑���⍂���xPTH ����Ȃǂ͕s�K�ł���B
�y�� ���z
1�j Brandi ML, Gagel RF, Angeli A, Bilezikian JP, Beck-Peccoz P, Bordi C, Conte-Devolx B, Falchetti A, Gheri RG, Libroia A, Lips CJ, Lombardi G, Mannelli M, Pacini F, Ponder BA, Raue F, Skogseid B, Tamburrano G, Thakker RV, Thompson NW, Tomassetti P, Tonelli F, Wells SA Jr, Marx SJ.Guidelines for diagnosis and therapy of MEN type 1 and type 2. J Clin Endocrinol Metab. 2001; 86(12): 5658-5671.�i���x��Ⅵ�j
2�j �Ԕ]�����̋@�\��Q�Ɋւ��钲�������� �v�����N�`���iPRL�j����ߏ�ǂ̐f�f�Ǝ��Â̎�����i����21 �N�x�����j�����J���Ȋw������⏕��������������������ƕ���21 �N�x�����E���S������, 2010 �N3 ��
3�j �Ԕ]�����̋@�\��Q�Ɋւ��钲�������� ��[����ǂ���щ����̐����l�ǂ̐f�f�Ǝ��Â̎�����i����21 �N�x�����j�����J���Ȋw������⏕��������������������ƕ���21 �N�x�����E���S������, 2010 �N3 ��
CQ1-5�@NET �̓]�ڂ̌����ɐ��������摜�����͉����H
����
�摜�����Ƃ��� 1�j CT�A2�j MRI�A3�j US�A4�j FDG-PET ������������i�O���[�hB�j�B�̓]�ڌ����ړI��CT�ł́A���������܂ޑ��eCT������������i�O���[�hB�j�B
�y�� ���z
�̓]�ڂ̕p�x���ł������A�����Ń����p�ߓ]�ڂ����A���]�ڂ���r�I�p�x������1)�B
CT�F�̈ȊO�̓]�ڑ�����ɂ�CT ��SRS �����D��Ă���A�̓]�ڂ̓����CT ��SRS �ō����Ȃ�����2)�B�܂��A�P���A�������A�喬���ł́A���������ł���ᇕ`�o�\�ɗD��Ă���ACT �ł͓������{�s�����߂���3)�B
MRI�FNET �̊̓]�ڂ�ł������́AMRI�ACT�ASRS �̏��Ԃɑ����AMRI �ł̓������CT�ASRS ���L�ӂɑ�������4)�B
US�F�̓]�ړ��藦��46-68���ƕ���Ă��邪�A���e�܂̎g�p�ɂ�蓯�藦���㏸����5)�B
FDG-PET�i�ی������ځj�FNET �̂悤�ɔ��炪�x����ᇂ̓���ɂ͌����Ă��炸�A�̓]�ڑ����܂ލĔ����̓��藦�͒Ⴂ���A�������ő��B�\�͂̒�����NEC �̍Ĕ������ɂ͗L�p�ł���6), 7)�BFDG-PET �ŗz���̎�ᇂ͋}���ɔ��炷��\���������A���̂悤�Ȏ�ᇂ�SRS ��CT �ɂ�錟�o����PET �������6)�B
SRS�i�\�}�g�X�^�`����e�̃V���`�O���t�B�[�j�i�ی������ځj�F�K�X�g���m�[�}�ɂ����āASRS �P�Ƃł̊̓]�ڂ̓��藦�́AMRI�ACT �ȂǑ��̌����P�Ƃ��������A���̌����̑g�ݍ��킹�Ɠ����x�ł�����8)�B�܂��ASRS �́A���̉摜�f�f�œ���ł��Ȃ������]�ڑ���ł���9)�B�Ĕ�������̊��A���ِ��A���x�A���ׂĂ�SRS ��CT ��MRI �̑g���������ǍD�ł�����10)�B���̂悤�ɒP�ƌ����ł�SRS �̍����]�ڑ����藦������Ă��邪�A�{�M�ł͕ی��K�����F�߂��ĂȂ��B
�XNET �̓]�ڂ�86-100�����������ł���5), 11)�B�摜�f�f��AMRI �ł�T1 �����摜�Œ�M���AT2 �����摜�ō��M���̎�ᇁACT �ł͑��e�����ɔZ��������ᇁA�Ƃ��đ������邱�Ƃ�����3), 5)�B
������NET �̓]�ڏǗ�ɂ����āACT �ɂ��`�o���ꂽ�]�ڐ��͒P���A�������A�喬���A��3 ���ō����Ȃ��������A�P���A�������A�喬���A�̊e���P�Ƃŕ`�o���ꂽ��ᇐ��͓������ōł������A�������̓]�ڌ��o�ɂ�����L�p�����������Ă����B������NET �̓]�ڏǗ��MRI �摜�����������Ƃ���A�S�]�ڌ���75����T1 �����摜�Œ�M���AT2 �����摜�ō��M���ł�����12)�B
�摜�f�f�ł͂Ȃ�������NSE �ƃN�����O���j��A�i�ی������ځj�̑���͍Ĕ��̊m�F�ɗL�p�ł���B
�y�� ���z
1�j Kim SJ, Kim JW, Han SW, Oh DY, Lee SH, Kim DW, Im SA, Kim TY, Heo DS, Bang YJ. Biological characteristics and treatment outcomes of metastatic or recurrent neuroendocrine tumor: tumor grade and metastatic site are important for treatment strategy. BMC Cancer. 2010; 10: 448-458.�i���x��Ⅳb�j
2�j Kumbasar B, Kamel IR, Tekes A, Eng J, Fishman EK, Wahl RL. Imaging of neuroendocrine tumors: accuracy of helical CT versus SRS. Abdom Imaging. 2004; 29(6): 696-702.�i���x��Ⅳb�j
3�j Paulson EK, McDermott VG, Keogan MT, DeLong DM, Frederick MG, Nelson RC. Carcinoid metastases to the liver: role of triple-phase helical CT. Radiology. 1998; 206(1): 143-150.�i���x��Ⅳb�j
4�j Dromain C, de Baere T, Lumbroso J, Caillet H, Laplanche A, Boige V, Ducreux M, Duvillard P, Elias D, Schlumberger M, Sigal R, Baudin E. Detection of liver metastases from endocrine tumors: a prospective comparison of somatostatin receptor scintigraphy, computed tomography, and magnet ic resonance imaging. J Clin Oncol. 2005; 23(1): 70-78.�i���x��Ⅳb�j
5�j Hoeffel C, Job L, Ladam-Marcus V, Vitry F, Cadiot G, Marcus C. Detection of hepatic metastases from carcinoid tumor: prospective evaluation of contrast-enhanced ultrasonography. Dig Dis Sci. 2009; 54(9): 2040-2046. �i���x��Ⅳb�j
6�j Pasquali C, Rubello D, Sperti C, Gasparoni P, Liessi G, Chierichetti F, Ferlin G, Pedrazzoli S. Neuroendocrine tumor imaging: can 18F-fluorodeoxyglucose positron emission tomography detect tumors with poor prognosis and aggressive behavior? World J Surg. 1998; 22(6): 588-592.�i���x��Ⅳb�j
7�j Adams S, Baum R, Rink T, Schumm-Dräger PM, Usadel KH, Hör G. Limited value of fluorine-18 fluorodeoxyglucose positron emission tomography for the imaging of neuroendocrine tumours. Eur J Nucl Med. 1998; 25(1): 79-83.�i���x��Ⅳb�j
8�j Gibril F, Reynolds JC, Doppman JL, Chen CC, Venzon DJ, Termanini B, Weber HC, Stewart CA, Jensen RT. Somatostatin receptor scintigraphy: its sensitivity compared with that of other imaging methods in detecting primary and metastatic gastrinomas. A prospective study. Ann Intern Med. 1996; 125(1): 26-34.�i���x��Ⅳb�j
9�j Lebtahi R, Cadiot G, Sarda L, Daou D, Faraggi M, Petegnief Y, Mignon M, le Guludec D. Clinical impact of somatostatin receptor scintigraphy in the management of patients with neuroendocrine gastroenteropancreatic tumors. J Nucl Med. 1997; 38(6): 853-858.�i���x��Ⅳb�j
10�j Scigliano S, Lebtahi R, Maire F, Stievenart JL, Kianmanesh R, Sauvanet A, Vullierme MP, Couvelard A, Belghiti J, Ruszniewski P, Le Guludec D. Clinical and imaging follow-up after exhaustive liver resection of endocrine metastases: a 15-year monocentric experience. Endocr Relat Cancer. 2009; 16(3): 977-990.�i���x��Ⅳb�j
11�j Eriksson B, Arnberg H, Lindgren PG, Loerelius LE, Magnusson A, Lundqvist G, Skogseid B, Wide L, Wilander E, Oeberg K. Neuroendocrine pancreatic tumors: clinical presentation, biochemical and histopathological findings in 84 patients. J Intern Med. 1990; 228(2): 103-113.�i���x��Ⅳb�j
12�j Bader TR, Semelka RC, Chiu VCY, Armao DM, Woosley JT. MRI of carcinoid tumors: spectrum of appearances in the gastrointestinal tract and liver. J Magn Reson Imaging. 2001; 14(3): 261-269.�i���x��Ⅳb�j
�R����
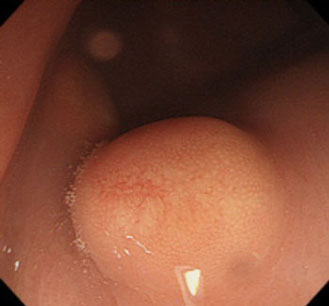
- �����������ጌ���̔�T�^�I�ȏǏ�
�����ɔ��������ጌ���ł́A�ጌ���ɔ��������_�o�h���Ǐ��蒆���_�o�ǏO�ʂɂ��B�����_�o�Ǐ�ɂ͗l�X�ȕ\���������A�������ɋL�ڂ������̂̑��Ɋe�Ǘ�ʂ̏Ǐ���B���̖ڊo�߂��x��Ēx������A�L���͂��ቺ����A�����̋������C�A�X����ԁA�����A���炢�炵�ċ��т����Ȃ�A�Ȃǂ̈ꌩ�ጌ���Ǐ�ƋC�t���ɂ����Ǐ�Ǐ�̏ꍇ������B�ጌ������̏Ǐ�̑��l����m���Ă������Ƃ��d�v�ł���B
- SASI �e�X�g
�C���X���m�[�}�̏ꍇ�ɂ́A�h����Ƃ��ăO���R���_�J���V�E�����g�p���邪�A�O�l�Ɣ�ׂ�200���ȏ�̏㏸������ꂽ���̂��h�{�����Ɣ��f����B��Ƒ����C���X���m�[�}�͂قƂ�ǂ��P�����ł���̂ŁA�摜�f�f�Ŏ�ᇂ��`�o�������ꂪ�C���X���m�[�}�ł���ꍇ���������A�摜�f�f�Ŏ�ᇂƂ��ĉ����`�o����Ȃ��ꍇ�ioccult sporadic insulinoma�j�ɂ́ASASI �e�X�g�͋ɂ߂ėL�p�ł���1)�B���̏ꍇ�A�؏��W�{�ɒP�����̃C���X���m�[�}��������ꍇ�̑��ɁA�����C���X���m�[�}���������Ă���ꍇ��nesidioblastosis �������̉ߌ`�������������A������NIPHS �ɑ�����ꍇ������(�R����3.�Q��)�B�K�X�g���m�[�}�ł́ASASI �e�X�g�Ŏh����Ƃ��ăO���R���_�J���V�E�����g�p���邪�A�O�l���20���ȏ�̏㏸������A��Βl��80 pg/mL �̏㏸������ꂽ�ꍇ�ɉh�{�����Ɣ��f���ċǍݐf�f����2)�B�ŋ߁A�\��w���K�X�g���m�[�}���X�K�X�g���m�[�}���p�x���������Ƃ����炩�ɂȂ��Ă���B�\��w���K�X�g���m�[�}�́A��Ƒ����̏ꍇ�͒P�������������AMEN1 �̏ꍇ�͔����ȏ�ő������A�����ɔ������Ă���ꍇ������B
- Non-insulinoma pancreatogenous hypoglycemia syndromes�FNIPHS
��C���X���m�\�}�X�����ጌ���ǁB�V������nesidioblastosis �Ɨގ����郉���̑�����V���Ȃǂ̕a���w�I�ω��ɂ��ጌ���Ǐ��l�ɂ����Ĕ��ǂ���ꍇ������3-5)�B�C���X�����l�̗}���̂Ȃ��ጌ�����������̂́A�摜�f�f�ŃC���X���m�[�}���`�o����Ȃ��ꍇ�Ɋӕʂ��ׂ������ł���B�a���I�ɂ��X���̓�����זE�̂т܂̉ߌ`����nesidioblastosis ���F�߂��A���l�^�l�W�f�B�I�u���X�g�[�V�X���邢��NIPHS �ƌĂ��B���̏ꍇ�ɂ́A��ᇌ`���������Ȃ��̂ŁASASI �e�X�g���B��̋Ǎݐf�f�@�Ƃ��āA�ُ탉���������ʂ̓���ɗL�p�ł��邱�Ƃ��������Ă���BSASI �e�X�g�ł͑O�l��� 100���ȏ�̃C���X�����l�̏㏸������ꍇ���������A50-70���ȏ�̏㏸�ɂƂǂ܂�ꍇ������A�ӕʐf�f�ɋꗶ���邱�Ƃ�����B����̐f�f�����߂Ăق���3-5)�B
�y�� ���z
1�j Abboud B, Boujaoude J. Occult sporadic insulinoma:localization nd surgical strategy. World J Gastroentel. 2008; 14(5): 657-665.�i���x��Ⅵ�j
2�j Imamura M, Komoto I, Ota S, Hiratsuka T, Kosugi S, Doi R, Awane M, Inoue N. Biochemically curative surgery for gastrinoma in multiple endocrine neoplasia type 1 patients World J Gastroenterol. 2011; 17(10); 1343-1353.�i���x��Ⅴ�j
3�j ServiceFJ, Natt N, Thompson GB, Grant CS, van Heerden JA, Andrews JC, Lorenz E, Terzic A, Lloid RV. Noninsulinoma pancreeatogenous hypoglycemia: a novel syndrome of hyperinsulinemic hypoglycemia in adults independent of mutations in Kir6.2 and SUR1 genes. J Clin Endocrinol Metab. 1994; 84(5); 1582-1589.�i���x��Ⅴ�j
4�j Raffel A, Krausch M, Anlauf M, Wieben D, Braunstein S, Kloppel G, Roher HD, Knoefel WT. Diffuse nesidiobalastosis as a cause of hyperinsulinemis hypoglycemia in adults: a diagnostic and therapeutic challenge. Surgery. 2007; 141(2): 179-184.�i���x��Ⅴ�j
5�j Ouyang D, Dhall D, Yu R, Pathologic pancreatic endocrine cell hyperplasia. World J Gastroentel. 2011; 17(2): 137-143.�i���x��Ⅴ�j
�a��
�܂�����
WHO �ł�2000 �N�ɁA1907 �N�ȗ��g�p����Ă����J���`�m�C�h�̖��̂���߁A�_�o�������ᇁiNeuroendocrine tumor; NET�j�̖��̂����߂Ďg�p�����B���̌��2010 �N�̉����ł́A�X�E������NET ��NET G1�ANET G2�ANEC�AMANEC�AHyperplasia and preneoplastic lesions �Ȃǂɕ��ނ��A�S�̂�Neuroendocrine neoplasia�iNEN�j�ƌď̂��邱�ƂƂ����BNET G1�ANET G2�A NEC �̕��ނ́A�j�������AKi67 �w���ɂ���ċK�肳��A���ꂼ��NET G1�i��2/10HPF�A��2���j�ANET G2�i2-20/10HPF�A3-20���j�ANEC�i��20/10HPF�A��20���j�ɐݒ肵�Ă���BTNM ���ށiENETS �܂���AJCC/UICC�j�����p�����BPreneoplastic lesion �Ƃ��āAA �^�݉��ɔ���NE �זE�̑��B�͗L���ł���AMEN1�AVHL�ANF-1�ATSC �Ȃ��XNET/NEC ��predispositoin �Ƃ��Ă悭�m���Ă���B�]�ڐ��X�E������NET/NEC �̎��ÂɊւ��ẮA�I�N�g���I�`�h�i�\�}�g�X�^�`���A�i���O�j���p�����A���Ì��ʂ̗\���̂��߁A��ᇍזE�ł̃\�}�g�X�^�`�����Z�v�^�[�iSSTR�j�̖Ɖu�g�D���w�I��͂����������BNET/NEC �ɂ����ĕa���f�f�̉ʂ��������͋ɂ߂đ傫���B
CQ2-1�@�X�E������NET�ɐ����f�f�͕K�v���H�@�����łǂ��܂ŕ����邩�H
����
�X�E������NET�̐����f�f�́A�f�f�̊m��̂��߂ɐ���������i�O���[�hB�j�B
�XNET �̐����ɂ�鈫���x�f�f��Ki67 �w�����L�p�ł����i�O���[�hC1�j�B�̎悵����ᇗʂ����Ȃ��ŁAKi67 �w���������ꍇ�͍Č������������AKi67 �w�����Ⴂ�ꍇ�̍Č����͒Ⴂ�i�O���[�hC1�j�B
�y�� ���z
�XNET�ɑ��鐶���̖����͑g�D�f�f�A�����x�f�f�A�\��\������������B�g�D�f�f1-4)�Ɋւ��Ă͑����̕��Ȃ���Ă���A���̊��x��82.6-100���A���f����83.3-93���ƗǍD�ł���A�XNET �����̎�ᇂ��̊ӕʐf�f���\�ł���B������NET�͒ʏ���������ł̐f�f����60-90���Ɣ�r�I����5)�A���Õ��j����ɗL�p�ł���B
EUS-FNA ���̂�p�����XNET�ɑ��鈫���x�f�f��\��\���Ɋւ��Ă͐��҂̕�����BKi67 �w����p���������ł́A��p���̂�89-92.3���ƍ�����v����������6, 7)���������A2����cutoff �l�Ƃ��Ă��]�ڂ̗L���̎w�W�ɂȂ炸�ACox ���n�U�[�h���f���ł��AKi67 �w���͎��S�̃��X�N���q�ɂ͂Ȃ�Ȃ�8)�Ƃ̕�����B���̗��R�Ƃ��āAKi67 �w���͎�ᇓ��ł��������A�K������hot spot�����h����Ă���킯�ł͂Ȃ����Ƃ��������Ă���A�����_�ł�Ki67 �w���ɂ�鈫���x�f�f��controversial �ƍl������9)�B��p���̂���j�Ő����Ɠ��l�̑傫���̌��̂����o���A����WHO2010 ���ނ��r�����_���ł́A�j����3 �{�����1 �{�Ŕ��肳�ꂽWHO2010 ���ނ̎�p���̂ł̍Č����͂��ꂼ��64.7���A59.5���ł���A�����g�D�Ŕ��肳�ꂽWHO2010 ���ނ͉ߏ��]������Ă���\�������蒍�ӂ�v����BKi67 �w���ȊO�̈����x�f�f�ɂ́A�}�C�N���T�e���C�g�}�[�J�[��p�����w�e���ڍ��������iloss of heterozygosity; LOH�j�̉�͂�p����������10)�B���ʑΗ���`�q�r���iFractional allelic loss; FAL�j��cutoff �l��0.2 �Ƃ����Ƃ���A���Ĕ����ԁA5 �N�������Ƃ��ɗL�Ӎ���F�߂��ƕ��Ă��邪�A�]���͂܂��m�肵�Ă��Ȃ��B�\��\���Ɋւ��ẮAEUS-FNA ����77 ���WHO2000 ���ނ̐f�f���p����WDNET 30 ��AWDNEC 21 ��APDNEC 26 ��ɕ����ė\��������������ʁA5 �N�������͂��ꂼ��A100���A68���A30���ƗL�Ӎ����������ƕ��Ȃ���Ă���2)���AWHO2010 ���ނɂ����錟���͖����Ȃ���Ă��Ȃ��B
������NET �ɑ��鐶���ɂ�鈫���x�f�f�E�\��\���Ɋւ���͂Ȃ��A����̉ۑ�ł���B
�y�� ���z
1�j Ardengh JC, de Paulo GA, Ferrari AP. EUS-guided FNA in the diagnosis of pancreatic neuroendocrine tumors before surgery. Gastrointest Endosc. 2004; 60(3): 378-384.�i���x��Ⅳa�j
2�j Figueiredo FA, Giovannini M, Monges G, Bories E, Pesenti C, Caillol F, Delpero JR. EUS-FNA predicts 5-year survival in pancreatic endocrine tumors. Gastrointest Endosc. 2009; 70(5): 907-914.�i���x��Ⅳa�j
3�j Pais SA, Al-Haddad M, Mohamadnejad M, Leblanc JK, Sherman S, McHenry L, DeWitt JM. EUS for pancreatic neuroendocrine tumors: a single-center, 11-year experience. Gastrointest Endosc. 2010; 71(7): 1185-1193.�i���x��Ⅳa�j
4�j Gornals J, Varas M, Catalá I, Maisterra S, Pons C, Bargallo D, Serrano T, Fabregat J. Definitive diagnosis of neuroendocrine tumors using fine-needle aspiration-puncture guided by endoscopic ultrasonography. Rev esp enferm Dig. 2011; 103(3): 123-128.�i���x��Ⅳa�j
5�j �����N��, ���͐�, �g��V��, ���ےq�T, �{�J��. �����ǃJ���`�m�C�h�̐f�f�Ǝ��� 3)�咰. �݂ƒ�. 2004; 39(4): 592-600. �i���x��Ⅵ�j
6�j Piani C, Franchi GM, Cappelletti C, et al. Cytological Ki67 in pancreatic endocrine tumours: an opportunity for pre-operative grading. Endocrine Related Cancer. 2008; 15(1): 175-181.�i���x��Ⅳa�j
7�j Chatzipantelis P, Konstantinou P, Kaklamanos M, Apostolou G, Salla C. The role of cytomorphology and proliferative activity in predicting biologic behavior of pancreatic neuroendocrine tumors. Cancer Cytopathology. 2009; 117(3): 211-216.�i���x��Ⅳa�j
8�j Alexiev BA, Darwin PE, Goloubeva O, Ioffe OB. Proliferative rate in endoscopic ultrasound fine�]needle aspiration of pancreatic endocrine tumors. Cancer Cytopathology. 2009; 117(1): 40-45.�i���x��Ⅳa�j
9�j Yang Z, Tang LH, Klimstra DS: Effect of tumor heterogeneity on the assessment of Ki67 labeling index in well-differentiated neuroendocrine tumors metastatic to the liver: implications for prognostic stratification, Am J Surg Pathol. 2011; 35(6): 853-860.�i���x��Ⅳa�j
10�j Fasanella KE, McGrath KM, Sanders M, Brody D, Domsic R, Khalid A. Pancreatic endocrine tumor EUS-guided FNA DNA microsatellite loss and mortality. Gastrointestinal Endoscopy. 2009; 69(6): 1074-1080.�i���x��Ⅳa�j
CQ2-2�@�X�E������NET���^�����ꍇ�ɐ�������鐶���f�f�@�͉����H
CQ2-2-1�@�X NET ���^�����ꍇ�ɐ�������鐶���f�f�@�͉���?
����
�f�f�\�ƈ��S���̖ʂ���EUS-FNA ������������i�O���[�hB�j�B
�̓]�ڂ��^���ꍇ�́A�o��I�̐������L�p�ł����i�O���[�hB�j�B
�y�� ���z
�X��ᇂɑ���p�O�̑g�D�̎�@�Ƃ��ẮA���US ���邢��CT �K�C�h���o��I���h�z���@�i�o��IFNA�j��EUS-FNA ����������B�����̐f�f�\�ɂ��ă����_������r�������s�����B��̘_��1)�́A�o��IFNA ��EUS-FNA �̐��f����72�� vs. 89���ŗ��҂ɗL�Ӎ��͔F�߂Ȃ�����(P��0.135)�B�܂��AHartwing ��2)���X��ᇂɑ���p�O�g�D�f�f�ɂ�����o��IFNA 21 �_����EUS-FNA 28 �_���̃��r���[�ł́A���x�A���ٓx�A���f���͂��ꂼ��87�� vs. 83���A72�� vs. 100���A84�� vs. 88���ł���A���҂ɑ傫�ȍ��͔F�߂Ă��Ȃ��B����A1050 ����X�a�ςɑ���FNA �̌���3)�iEUS-FNA 843 ��AUS/CT �K�C�h 207 ��)�ɂ����āA3 cm �ȉ����X��ᇂɑ��Ă͌o��IFNA �ɔ䂵EUS-FNA �̕����L�ӂɐ��f�������������B�XNET�Ɍ��肵���o��IFNA ��EUS-FNA �Ƃ̔�r����4)�ł��A�Ǘᐔ�����Ȃ����̂�EUS-FNA ����荂���f�f���������Ă���B
�܂��A�����ǂɊւ��ẮAFNA ��̕����d��̏o���p�x���o��IFNA ��EUS-FNA �Ŕ�r�����X���̒���5)�ł́A�ł́AEUS-FNA ���L�ӂɒႩ����(16.3�� vs. 2.2���AP��0.025)�ƕ��Ă���B
�X�E������NET �̊̓]�ڑ�����̐����f�f�Ɋւ��Ă͏�����̕�����6)�A�]�ڑ�����̊̐����ł�NET �̐f�f���\�ł���L�p�ł���ƍl������B
�y�� ���z
1�j Horwhat JD, Paulson EK, McGrath K, Branch MS, Baillie J, Tyler D, Pappas T, Enns R, Robuck G, Stiffler H, Jowell P. A randomized comparison of EUS-guided FNA versus CT or US-guided FNA for the evaluation of pancreatic mass lesions.. Gastrointestinal Endoscopy. 2006; 63(7): 966-975.�i���x��Ⅱ�j
2�j Hartwig W, Schneider L, Diener M, Bergmann F, Büchler M, Werner J. Preoperative tissue diagnosis for tumours of the pancreas. British Journal of Surgery. 2009; 96(1): 5-20.�i���x��Ⅱ�j
3�j Volmar KE, Vollmer RT, Jowell PS, Nelson RC, Xie HB. Pancreatic FNA in 1000 cases: a comparison of imaging modalities. Gastrointestinal Endoscopy. 2005; 61(7): 854-861.�i���x��Ⅳa�j
4�j Jhala D, Eloubeidi M, Chhieng DC, Frost A, Eltoum IA, Roberson J, Jhala N. Fine needle aspiration biopsy of the islet cell tumor of pancreas: a comparison between computerized axial tomography and endoscopic ultrasound-guided fine needle aspiration biopsy. Ann Diagn Pathol. 2002; 6(2): 106-112.�i���x��Ⅳa�j
5�j Micames C, Jowell PS, White R, Paulson E, Nelson R, Morse M, Hurwitz H, Pappas T, Tyler D, McGrath K. Lower frequency of peritoneal carcinomatosis in patients with pancreatic cancer diagnosed by EUS-guided FNA vs. percutaneous FNA. Gastrointest Endosc. 2003; 58(5): 690-695.�i���x��Ⅳa�j
6�j Gupta RK, Naran S, Lallu S, Fauck R. Fine needle aspiration diagnosis of neuroendocrine tumors in the liver. Pathology. 2000; 32(1): 16-20.�i���x��Ⅳa�j
CQ2-2-2�@������NET ���^�����ꍇ�ɐ�������鐶���f�f�@�͉���?
����
���������ł̑g�D����������������i�O���[�hA�j�B
���������őg�D�������Ȃ������ꍇ�ɂ́AEUS-FNA ������������i�O���[�hB�j�B
�y�� ���z
������NET ���^�����ꍇ�̐����f�f�@�ɂ͊m�����ꂽ���̂͂Ȃ��B������NET �ɂ����ĕp�x�̍���NET G1 �ɂ����ẮA�ʏ���������ł̐f�f����60-90���Ɣ�r�I����1-5)�B�������A�������������ɂĐf�f�������Ȃ��ꍇ�ɂ́AEUS-FNA �����߂���B������NET�ɑ���EUS-FNA �̐��т͂̕Ȃ����A��SMT �ɑ��鐬�тł́A83���Őf�f�\�ł��̗Lj����̐��f����95.6���ƗǍD�Ȃ��̂ł�6)�BEUS-FNA ���s���Ȃ��{�݂ł́A�������I�؏��ɂ���Đf�f���s���B
�y�� ���z
1�j �����N��, ���͐�, �g��V��, ���ےq�T, �{�J��.�����ǂ̔S������悤2004 �e�_2. �����ǃJ���`�m�C�h�̐f�f�Ǝ��� 3)�咰. �݂ƒ�. 2004; 39(4): 592-600.�i���x��Ⅵ�j
2�j Park HW, Byeon JS, Park YS, Yang DH, Yoon SM, Kim KJ, Ye BD, Myung SJ, Yang SK, Kim JH. Endoscopic submucosal dissection for treatment of rectal carcinoid tumors. Gastrointest Endosc. 2010; 72(1): 143-149.�i���x��Ⅳa�j
3�j �Љ�����, ���c������, �˖{��M�q, ���Ԓq�Îq,���ԍ_�K. �� GIST �̔S���؊J�����@�ɂ��V�����a���g�D�f�f�@. ���������. 2010; 50(2): 108-111.�i���x��Ⅳa�j
4�j de la Serna-Higuera C, Pérez-Miranda M, Díez-Redondo P.,Harranz T, Pérez-Martin E, Ochoa C, Caro-Patón A. EUS-guided single-incision needle-knife biopsy: description and results of a new method for tissue sampling of subepithelial GI tumors (with video). Gastrointest Endosc. 2011; 74(3): 672-676.�i���x��Ⅳa�j
5�j 5. Lee CK, Chung IK, Lee SH, Lee SH, Lee TH, Park SH, Kim HS, Kim SJ, Cho HD. Endoscopic partial resection with the unroofing technique for reliable tissue diagnosis of upper GI subepithelial tumors originating from the muscularis propria on EUS (with video). Gastrointest Endosc. 2010; 71(7): 188-194.�i���x��Ⅲ�j
6�j Mekky MA, Yamao K, Sawaki A, Mizuno N, Hara K, Nafeh MA, Osman AM, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc. 2010; 71(6): 913-919.�i���x��Ⅳa�j
CQ2-3�@�a���g�D�W�{�̎�舵�����@�iA�F�Œ�@�AB�F���F�@�j
����
A �Œ�@
�̎悳�ꂽ���̂͂������ɏ\���ȗʂ̌Œ�t�ŌŒ肷�邱�Ƃ����������(�O���[�hA)�B
�Œ莞�Ԃ�8-36 ���Ԃ�����������i�O���[�hA�j�B
B ���F���@
�a���`�Ԋw�I�ȕ]����HE ���F�𗘗p���邱�Ƃ�����������i�O���[�hA�j�B�_�o�����啪�����m�F���邽�߃N�����O���j��A�A�V�i�v�g�t�B�W���̖Ɖu���F���s�����Ƃ�����������i�O���[�hA�j�B�_�o�������ᇂ̑g�D�`�Ԃ������A�N�����O���j��A�A�V�i�v�g�t�B�W������������A���̏ꍇ�ɂ́A���̑��̖Ɖu���F(CD56 �Ȃ�)��d�q�������ɂ��ώ@��lj����邱�Ƃ���������� �i�O���[�hB�j�BWHO ���ނɊ�Â����f�f�̂��߁AKi67 �̖Ɖu���F���s�����Ƃ�����������i�O���[�hA�j�B���Ì��ʗ\���̂���SSTR �̖Ɖu���F������������i�O���[�hB�j�B
�y�� ���z
A �Œ�@
�̎悳�ꂽ���͍̂̎�ソ�����ɏ\���ȗʂ̌Œ�t(10�������ɏՃz���}�����t�Ȃ�)�ɓ���Œ肷��B�Œ莞�Ԃ́A�Ɖu���F���K�{�ł��邱�Ƃ���A�ߌŒ�������B�W�{�̌Œ莞�ԂƂ��Ă�8-36 ���Ԃ��]�܂���1)�B�K�ȌŒ莞�Ԃ͌��̂̑傫���ɂ���ĈقȂ�B�������̂̂悤�ɏ��������̂ł́A6-8 ���Ԓ��x���]�܂����A��p���̂̂悤�ȑ傫�Ȍ��̂ɂ����Ă�48 ���Ԉȏ�̌Œ�͐��F�����ቺ����1)�B
�O����n������ᇂƓ��l�ɁA���ǂł́A�ǂ̐[�B�x�ɂ���ċǏ���ᇐi�W�x���K�肳��邽�߁A���̂̃I���G���e�[�V���������ĂɂȂ�悤�ɌŒ肷��K�v������2, 3)�B����(�H���A�݁A�����A�����A�����A����)�ł́A���ǂ������ɐ�J���A�Œ��ň��������ČŒ肷��B��J�������́A�����Ƃ��ẮA�݂ł͑�]���A��������ь����ł͒��ǖ��̑Α��A�����ł͑O���Ƃ���B�������A�a�ς������̕��ʂɂ�����ꍇ�ɂ͕a�ς�����ĊJ��2, 3)�B�X�����X���\��w���؏����̂ł͏\��w���̗��؏��f�[������A�z���}�����𒍓����ČŒ肷��B�Œ�O�ɐ؊J�͓��ꂸ�A�Œ��ɍs�����Ƃ��]�܂���4)�B
B ���F���@
�_�o�����啪���肷��̂ɁA���݂ł͖Ɖu���F���嗬�ł���B�Ɖu�g�D���w���F�ł́A�V�i�v�g�t�B�W���A�N�����O���j��A �̂����ꂩ���z���ł��邱�Ƃ��m�F����5)�BNET G1�ANET G2 �ł́A��������z���ƂȂ邱�Ƃ��������ANEC �̂悤�ɕ����x���Ⴍ�Ȃ�ƃN�����O���j��A �̗z���x���Ⴍ�Ȃ�A�V�i�v�g�t�B�W���̐��F���L�p�ƂȂ�Ƃ����Ă���BCD56�iNCAM�j�݂̂��z���̏ꍇ�ɂ́A�d�q�������ɂ���ē������������m�F����ȂǁA�ᕪ�����Ɗӕʂ���K�v������B�����������̗L���̊ώ@�͓d�q�������ɂ���Ă̂݉\�ł���A�Ɖu���F�Ő_�o�����啪�����m�F����Ȃ��ꍇ�ɂ͗L�p�ł���BKi67 �w���ƍזE�������Ɋ�Â�WHO2010 ���ނ͐����\��Ƒ��ւ�6)�B���Ì��ʗ\���̂��߁ASSTR �Ȃǃo�C�I�}�[�J�[�̐��F���ɂ߂ďd�v�ł���7)�B
�K�v�ɉ����āA���ǐN�P�肷��ړI�Œe�����ې��F����у����p�ǐZ���̂��߂�D2-40 �̖Ɖu�g�D���w���F���s���B
�y�� ���z
1�j Goldstein NS, Ferkowicz M, Odish E, Mani A, Hastah F. Minimum formalin fixation time for consistent estrogen receptor immunohistochemical staining of invasive breast carcinoma. Am J Clin Pathol. 2003; 120(1): 86-92. �i���x��Ⅳa�j
2�j �咰��������. �咰���戵���K�� �� 7 �ŕ����. Edited by �����o��, 2009.�i���x��Ⅵ�j
3�j ���{�݊��w��. �݊��戵���K�� �� 14 ��. Edited by �����o��, 2010.�i���x��Ⅵ�j
4�j ���{�X���w��. �X���戵���K�� �� 6 ��. Edited by �����o��, 2009.�i���x��Ⅵ�j
5�j Wiedenmann B, Franke WW, Kuhn C, Moll R, Gould VE. Synaptophysin: a marker protein for neuroendocrine cells and neoplasms. Proc Natl Acad Sci USA. 1986; 83(10): 3500-3504.�i���x��Ⅰ�j
6�j Pape UF, Jann H, Muller-Nordhorn J, Bockelbrink A, Berndt U, Willich SN, Koch M, Rocken C, Rindi G, Wiedenmann B. Prognostic relevance of a novel TNM classification system for upper gastroenteropancreatic neuroendocrine tumors. Cancer. 2008; 113(2): 256-265. �i���x��Ⅰ�j
7�j Volante M, Brizzi MP, Faggiano A, La Rosa S, Rapa I, Ferrero A, Mansueto G, Righi L, Garancini S, Capella C, De Rosa G, Dogliotti L, Colao A, Papotti M, Somatostatin receptor type 2A immunohistochemistry in neuroendocrine tumors: a proposal of scoring system correlated with somatostatin receptor scintigraphy, Mod Pathol. 2007; 20(11): 1172-1182.(���x��Ⅳb)
CQ2-4�@�؏��W�{�ɂ�����a���g�D�f�f���ɕK�v�ȋL�ڍ��ڂ͉����H
����
�������鑟�햼�i�O���[�hA�j�A�g�D�`�ԓI����іƉu�g�D���w�I��NET �̓����i�O���[�hA�j�AWHO2010 �����i�O���[�hA�j�ATNM ���� �i�O���[�hA�j�A�����p�ߓ]�ڂ̗L���A�]�ڃ����p�߂̐��A���u�]�� �i�O���[�hA�j���L�ڂ��邱�Ƃ����������B��ᇂ̐؏��f�[�ɂ��Ď�ᇘI�o�̗L���A�f�[�܂ł̋������L�ڂ��邱�Ƃ�����������i�O���[�hB�j�B
�y�� ���z
�X�E������NET �́A�������ʂɂ�炸�A�זE��������Ki67 �w���ɂ����G1�AG2�ANEC �ɕ��ނ����1-3)�B�זE�������́A�ł������ώ@�����̈�10������ώ@���A���̍��v���Ƃ���B
Ki67 �w���̑���ɍۂ��ẮA�ŏ��Ɏ�g��Ŋώ@������ōł��z���זE���x�̍����̈�A���Ȃ킿hot spot�ŏ��Ȃ��Ƃ�2,000 �̎�ᇍזE�𑪒肵�ėz���זE�̊������Z�o����B�O�����ᇐ������S�̂�30���ȏ�̗̈�Ɋ܂܂���ᇂɂ��ẮAG1�AG2�ANEC �Ƃ͈قȂ�mixed adenoneuroendocrine carcinoma�iMANEC�j�ɕ��ނ����B���ǐN�P��̗L���͓Ɨ������\��\�����q�Ƃ��Ă͏\���ȃG�r�f���X���F�߂��Ȃ����Ƃ���AWHO2010���ނ��K�肷����q�Ƃ͂Ȃ�Ȃ��B
ENETS ��TNM ���ނ�AJCC/UICC ��TNM ���ނ͈قȂ��Ă��邽�߁A����̂Ȃ��悤�A������̕��ނ�p�����̂��L���Ȃ��Ă͂����Ȃ�1, 2, 4)�B
�y�� ���z
1�j Rindi G, Kloppel G, Alhman H, Caplin M, Couvelard A, de Herder WW, Erikssson B, Falchetti A, Falconi M, Komminoth P, Korner M, Lopes JM, McNicol AM, Nilsson O, Perren A, Scarpa A, Scoazec JY, Wiedenmann B: TNM staging of foregut (neuro)endocrine tumors: a consensus proposal including a grading system, Virchows Arch. 2006; 449(4): 395-401.�i���x��Ⅵ�j
2�j Rindi G, Kloppel G, Couvelard A, Komminoth P, Korner M, Lopes JM, McNicol AM, Nilsson O, Perren A, Scarpa A, Scoazec JY, Wiedenmann B: TNM staging of midgut and hindgut (neuro) endocrine tumors: a consensus proposal including a grading system, Virchows Arch. 2007; 451(4): 757-762.�i���x��Ⅵ�j
3�j Bosman F, Camerio F, Hurban R, Theise N: WHO classification of tumours of the digestive system. Edited by Lyon, IARC Press, 2010.�i���x��Ⅵ�j
4�j Sobin L, Gospodarowicz M, Wittekind C. TNM Classification of Malignant Tumors. Wiley-Blackwell, Oxford, 2009.�i���x��Ⅵ�j
CQ2-5�@�p���v���f�f�Ŗ��炩�ɂł��邱�Ƃ͉����H
CQ2-5-1�@�v���f�f�̖ړI�͉����H
����
��ᇍזE���܂܂�Ă��邩�ۂ����m�F���邱�Ƃ��ړI�ł���B�i�O���[�hB�j�B
NET �̐v���f�f�́A��Ƃ��āA��������]�ڕa���Ɏ�ᇍזE���܂܂�Ă��邩�ۂ����m�F���邱�Ƃł��� �i�O���[�hB�j�B�؏��f�[�̐v���f�f�̕]���́A�a�ς�����I�ɋߐڂ��Ă���ꍇ�ɐ���������i�O���[�hB�j�B
�y�� ���z
��ʓI�ɁA�v���f�f�̖ړI�́A1�j��ᇑg�D�f�f�A2�j�]�ځE�d��̗L���A3�j�؏��f�[�̕]���A�Ȃǂ���������B���̂����ANET �ł́A���̑��ƈقȂ�A�����͔�r�I���E���Ăȕa�ς��`�����邽�߁A�؏��f�[�̕]���͕K�v�łȂ��ꍇ������1)�A�a�ς�����I�ɋߐڂ��Ă���ꍇ�ɍs����B
�y�� ���z
1�j Couvelard A, Sauvanet A. Gastroenteropancreatic neuroendocrine tumors: indications for and pitfalls of frozen section examination. Virchows Arch. 2008; 453(5): 441-448. �i���x��Ⅵ�j
CQ2-5-2�@�v���f�f�łǂ��܂ł������邩�H
����
���̎�ᇂƂ̊ӕʂ�����ȏꍇ�́A�Ɖu���F���܂߂��i�v�W�{�ł̕]�����s�����Ƃ��A����������i�O���[�hC1�j�B
�y�� ���z
�v���a���f�f�ɂ����āANET �Ƒ��̏�琫������ᇂƂ̊ӕʂ͍���ł���1)�B�Xsolid-pseudopapillary neoplasm ��B�[�זE����NET �̐v���a���f�f�ɂ��ӕʂ͍���ł���A�Ɖu���F���܂߂��i�v�W�{�ł̕]�����K�v�ł���1)�B
NET �̂����A�����x�̒Ⴂ��ᇂ̑����́A�`�ԓI�ɓT�^�I�ȑ���悷�邱�Ƃ���A�p���v���f�f�ɂ����Đf�f���\�ł���B�������A�������ʂ�A�����x�ɂ���đg�D�������ʂł��邽�ߊm�肪����Ǘ���F�߂���B���Ɉ����x�̍���NET �̏ꍇ�ɂ́A�זE�ٌ^���ڗ����A�B���Ƃ̊ӕʂ�v����1, 2)�BVHL �a�ɂ������XNET �́A�����ΒW���ȍזE����L���A�t�זE������t��嚢�E�B��Ƃ̊ӕʂ�v����B���̑��A�XNET �ōD�_���זE����悷��Ǘ�ł͑B�[�זE���ƌ`�ԓI�Ȋӕʂ�������̂�����3, 4)�B������NET �ł́ABrunner �B�B���ُ����X�Ƃ̊ӕʂ�v����B
�y�� ���z
1�j Couvelard A, SauvaNET A: Gastroenteropancreatic neuroendocrine tumors: indications for and pitfalls of frozen section examination, Virchows Arch. 2008; 453(5): 441-448.�i���x��Ⅵ�j
2�j Bosman F, Camerio F, Hurban R, Theise N. WHO classification of tumours of the digestive system. IARC Press, Lyon, 2010.�i���x��Ⅵ�j
3�j Hoang MP, Hruban RH, Albores-Saavedra J. Clear cell endocrine pancreatic tumor mimicking renal cell carcinoma: a distinctive neoplasm of von Hippel-Lindau disease. Am J Surg Pathol. 2001; 25(5): 602-609.�i���x��Ⅴ�j
4�j Sugihara A, Nakasho K, Ikuta S, Aihara T, Kawai T, Iida H, Yoshie H, Yasui C, Mitsunobu M, Kishi K, Mori T, Yamada N, Yamanegi K, Ohyama H, Terada N, Ohike N, Morohoshi T, Yamanaka N. Oncocytic non-functioning endocrine tumor of the pancreas. Pathol Int. 2006; 56(12): 755-759. �i���x��Ⅴ�j
�O�Ȏ���
�܂�����
�O�Ȏ��Âɂ��ẮA�XNET �Ə�����NET �ɕ�����CQ ���쐬�����B�ړICQ �������₷�����邽�߂ɁA�XNET �ɂ��ẮA�C���X���m�[�}�A�K�X�g���m�[�}�A�O���J�S�m�[�}�AVIP �Y����ᇁA���̑��̋@�\��NET�A��@�\��NET �̍��ڂ��Ƃ�CQ ���쐬�����B�܂��AMEN1 �ɔ����X�E������NET �̊O�Ȏ��Âɂ��Ă�CQ ��݂����B�XNET �ɂ��Ă͓]�ڂ��ꍇ�ƁA�Ĕ��������̊O�Ȏ��Âɑ���CQ �����ꂼ��Ɨ����č쐬�����B
������NET �̊O�Ȏ��Âɂ��Ă͑���ʂɈ݁A�\��w���A�����A�����A�����A������NET �̍��ڂ��Ƃ�CQ ���쐬�����B������NET �ɂ��Ă��]�ځA�Ĕ����̊O�Ȏ��Âɑ���CQ �����ꂼ��쐬�����B
����ɁA�O�Ȏ��ÂɊ֘A����d�v�Ȗ��Ƃ��ďp���v���f�f�Əp��̌o�ߊώ@���@�ɂ��Ă�CQ ��lj������B�X�E������NET �ɂ��ẴG�r�f���X���W�ς��A����f�Â̎Q�l�ƂȂ鐄�����Ɖ���L�q��S�|�����B
CQ3-1�@�XNET �̎�p�K���Əp���́H
CQ3-1-1�@�C���X���m�[�}�̎�p�K���Əp���́H
����
�C���X���m�[�}�Ɛf�f���ꂽ�ꍇ�A�C���X���m�[�}�؏��p������������i�O���[�hB�j�B�p���͊j�o�p���X�����؏��Ȃǂ̋Ǐ��؏������������B�i�O���[�hB�j�B�������^����ꍇ�A�����p�ߊs������^�I�X�؏��p������������i�O���[�hB�j�B
�y�� ���z
�C���X���m�[�}�͖�90�����ǐ���ᇂ��X�ɋǍ݂��Ă���A��p�ɂ�鍪�������҂ł���1-5)�B���a��2 cm �ȉ��̕a�ςɂ��Ă͊j�o�p�����������6-8)�B��ᇂƎ��X�ǂ�3 mm �ȏ㗣��Ă���ꍇ�́A���X�ǂ������Ɋj�o�p���\�ł���B�������A��ᇂƎ��X�ǂ̋������ߐڂ��Ă���A���X�Ǒ����̊댯����ꍇ���X�����؏��p�╪�ߐ؏��p�A�X�����؏��p�Ȃǂ����������B�X�̔����؏��p���s���ꍇ�A��ᇂ̔햌���͂����肵�Ă���A�Z���X�����Ȃ��ȂLj���������Ȃ��ꍇ���B���Ö���������������6-8)�B��ᇑ����A�����X�ǂ̊g���A���͑g�D�ւ̐Z���A�����p�ߓ]�ڂȂǂ�F�߂��ꍇ�̓����p�ߊs�����X�؏��p�i�X���\��w���؏��p/�X�̔����؏��p�j�����������6-11)�B
�p�O�ɉ摜�f�f�@�݂̂��s���Ă��āA�p�������g�����Ȃǂɂ���Ă���ᇂ��m�F�ł��Ȃ��ꍇ�́A�ӖړI���X�؏��͐�������Ȃ��B��U�����āA�ʓr�J���V�E���n�t��p����SASI �e�X�g�����邱�Ƃɂ��A�����C���X���m�[�}�A�����ߌ`���Anesidioblastosis �Ȃǂ̋Ǎ݂�f�f���邱�Ƃ��ł���6-10)�B
�ߔN�A���o����p���}���ɕ��y���Ă��Ă���A�C���X���m�[�}�ɑ��镠�o������p������Ă���B�o���̂���p�҂ł���A���o���������g����(LUS)�� 85���ȏ�̋Ǎݐf�f ���\�ł���L�p�ł���Ƃ������4, 12, 13�j�B�{�M�ł��A2012 �N�t�ɕ��o�����X�؏��p���ی��K���ƂȂ����B
�y�� ���z
1�j Metz DC, Jensen RT: Gastrointestinal neuroendocrine tumors: Pancreatic endocrine tumors. Gastroenterology. 2008; 135(5): 1469-1492.�i���x��Ⅵ�j
2�j Vanderveen K, Grant C: Insulinoma. Cancer Treat Res. 2010; 153: 235-252.�i���x��Ⅵ�j
3�j de Herder WW, Niederle B, Scoazec JY, Pauwels S, Kloppel G, Falconi M, Kwekkeboom DJ, Oberg K, Eriksson B, Wiedenmann B, Rindi G, O'Toole D, Ferone D; Frascati Consensus Conference; European Neuroendocrine Tumor Society. Well-differentiated pancreatic tumor/carcinoma: insulinoma. Neuroendocrinology. 2006; 84(3): 183-188.�i���x��Ⅱ�j
4�j Ekeblad S, Skogseid B, Dunder K, Oberg K, Eriksson B. Prognostic factors and survival in 324 patients with pancreatic endocrine tumor treated at a single institution. Clin Cancer Res. 2008; 14(23): 7798-7803.�i���x��Ⅳa�j
5�j España-Gómez MN, Velázquez-Fernández D, Bezaury P, Sierra M, Pantoja JP, Herrera MF. Pancreatic insulinoma: a surgical experience. World J Surg. 2009; 33(9): 1966-1970.�i���x��Ⅳb�j
6�j Kulke MH, Anthony LB, Bushnell DL, de Herder WW, Goldsmith SJ, Klimstra DS, Marx SJ, Pasieka JL, Pommier RF, Yao JC, Jensen RT. North American Neuroendocrine Tumor Society (NANETS). NANETS Treatment Guidelines: well-differentiated neuroendocrine tumors of the stomach and pancreas. Pancreas. 2010; 39(6): 735-752.�i���x��Ⅵ�j
7�j Akerstrom G, Hellman P: Surgery on neuroendocrine tumours. Best Pract Res Clin Endocrinol Metab. 2007; 21(1): 87-109.�i���x��Ⅵ�j
8�j Fendrich V, Waldmann J, Bartsch DK, et al: Surgical management of pancreatic endocrine tumors. Nat Rev Clin Oncol. 2009; 6(7): 419-428.�i���x��Ⅵ�j
9�j Jensen RT, Niederle B, Mitry E, Ramage JK, Steinmuller T, Lewington V, Scarpa A, Sundin A, Perren A, Gross D, O'Connor JM, Pauwels S, Kloppel G; Frascati Consensus Conference; European Neuroendocrine Tumor Society. Gastrinoma (duodenal and pancreatic). Neuroendocrinology. 2006; 84(3): 173-182.�i���x��Ⅵ�j
10�j Jensen RT, Berna MJ, Bingham DB, Norton JA. Inherited pancreatic endocrine tumor syndromes: advances in molecular pathogenesis, diagnosis, management and controversies. Cancer. 2008; 113(suppl 7):1807-1843.�i���x��Ⅵ�j
11�j Grant CS: Insulinoma. In: Surgical Endocrinology 2001. Loppincott, Williams& Wilkins, Philadelphia: 345-360.�i���x��Ⅵ�j
12�j Fernández-Cruz L, Blanco L, Cosa R, Rendón H. Is laparoscopic resection adequate in patients with neuroendocrine pancreatic tumors? World J Surg. 2008; 32(5): 904-917.�i���x��Ⅳa�j
13�j Richards ML, Thompson GB, Farley DR, Kendrick ML, Service JF, Vella A, Grant CS. Setting the bar for laparoscopic resection of sporadic insulinoma. World J Surg. 2011; 35(4): 785-789.�i���x��Ⅴ�j
CQ3-1-2�@�K�X�g���m�[�}�̎�p�K���Əp���́H
����
�K�X�g���m�[�}�Ɛf�f���ꂽ�ꍇ�A�؏��p������������i�O���[�hB�j�B�\��w���K�X�g���m�[�}�ɑ��ẮA�����p�ߊs�����\��w���؏��p������������i�O���[�hB�j�B�X�K�X�g���m�[�}�ɑ��ẮA�����p�ߊs�����X�؏��p������������i�O���[�hB�j�B
�y�� ���z
�K�X�g���m�[�}�́A�؏��p�ɂ���Ă̂݁A�����ł���1-4)�B�K�X�g���m�[�}�͂���60-90����������ᇂƕ���Ă���1, 2, 5)�B�̓]�ځE���u�]�ڂ�Ȃ��Ɛf�f���ꂽ�ꍇ�́A�؏��p�����������B�����p�ߓ]�ڗ���60%�ȏ�ƍ����̂ŁA�����p�ߊs���͕K�{�ł���1-3)�B���ǂȂǎ��ӑ���ւ̐Z��������ꍇ���A�����؏����\�Ɣ��f�����ꍇ�͐؏��p�����������2, 3, 5, 6)�B
�K�X�g���m�[�}�͏\��w���A�X�̗������甭�����邱�Ƃ��m���Ă��邪�A�ŋ߂́A�X�K�X�g���m�\�}���A�\��w���K�X�g���m�[�}�̔������̕��������A�U�����̏ꍇ�ł��S�̂�50-88�����\��w���K�X�g���m�[�}����߂Ă���2, 7)�B�H�ɁA�X�E�\��w���ȊO����̔���������Ă���2, 7)�A�p���̕����S�̂̏ڍׂȌ������s���ł��邽�߂ɁA�J���p�ɂ���ᇂ̌��������������2, 3, 8)�B
�]�ځE�Z���������R�����ꍇ�́A�\��w���A�X���Ƃ������؏��p��j�o�p�ō����ł���B���ׂȃ����p�ߓ]�ڑ��́A�p���̎��f�A�G�f�ł͐f�f�ł��Ȃ��̂ŁA�����p�ߊs�����؏��p�����������2, 3, 8, 9)�B
�K�X�g���m�[�}�̍�����ړI�Ƃ����A��������ᇂ̐����ړI�Ƃ���ݑS�E�p������_�o�ؗ��p�͐�������Ȃ�2, 3, 8, 10)�B
�y�� ���z
1�j Metz DC, Jensen RT: Gastrointestinal neuroendocrine tumors: Pancreatic endocrine tumors. Gastroenterology. 2008; 135(5): 1469-1492.�i���x��Ⅵ�j
2�j Jensen RT, Niederle B, Mitry E, Ramage JK, Steinmuller T, Lewington V, Scarpa A, Sundin A, Perren A, Gross D, O'Connor JM, Pauwels S, Kloppel G; Frascati Consensus Conference; European Neuroendocrine Tumor Society. Gastrinoma (duodenal and pancreatic). Neuroendocrinology. 2006; 84(3): 173-182.�i���x��Ⅵ�j
3�j Norton JA, Jensen RT: Resolved and unresolved controversies in the surgical management of patients with Zollinger-Ellison syndrome. Ann Surg. 2004; 240(5): 757-773.�i���x��Ⅵ�j
4�j Kulke MH, Anthony LB, Bushnell DL, de Herder WW, Goldsmith SJ, Klimstra DS, Marx SJ, Pasieka JL, Pommier RF, Yao JC, Jensen RT. North American Neuroendocrine Tumor Society (NANETS). NANETS Treatment Guidelines: well-differentiated neuroendocrine tumors of the stomach and pancreas. Pancreas. 2010; 39(6): 735-752 �i���x��Ⅵ�j
5�j Fendrich V, Waldmann J, Bartsch DK, Langer P. Surgical management of pancreatic endocrine tumors. Nat Rev Clin Oncol. 2009; 6(7): 419-428.�i���x��Ⅵ�j
6�j Norton JA, Fraker DL, Alexander HR, Venzon DJ, Doppman JL, Serrano J, Goebel SU, Peghini PL, Roy PK, Gibril F, Jensen RT. Surgery to cure the Zollinger-Ellison syndrome. N Engl J Med. 1999; 341(19): 635-644.�i���x��Ⅲ�j
7�j Anlauf M, Garbrecht N, Henopp T, Schmitt A, Schlenger R, Raffel A, Krausch M, Gimm O, Eisenberger CF, Knoefel WT, Dralle H, Komminoth P, Heitz PU, Perren A, Klöppel G. Sporadic versus hereditary gastrinomas of the duodenum and pancreas: distinct clinicopathological and epidemiological features. World J Gastroenterol. 2006; 12(34): 5440-5446.�i���x��Ⅳa�j
8�j Morrow EH, Norton JA: Surgical management of Zollinger-Ellison syndrome; state of the art. Surg Clin North Am 2009; 89: 1091-1103. �i���x��Ⅵ�j
9�j Sugg SL, Norton JA, Fraker DL, Metz DC, Pisegna JR, Fishbeyn V, Benya RV, Shawker TH, Doppman JL, Jensen RT. A prospective study of intraoperative methods to diagnose and resect duodenal gastrinomas. Ann Surg. 1993; 218(2): 138-144.�i���x��Ⅲ�j
10�j Franz RC, Penzhorn HO: Is total gastrectomy still a viable option in the management of patients with the Zollinger-Ellison syndrome? S Afr J Surg. 2007; 45(2): 58-60.�i���x��Ⅳa�j
CQ3-1-3�@�O���J�S�m�[�}�̎�p�K���Əp���́H
����
�O���J�S�m�[�}�Ɛf�f���ꂽ�ꍇ�A�؏��p������������i�O���[�hB�j�B�p���́A�����p�ߊs�����X�؏��p������������i�O���[�hB�j�B
�y�� ���z
�O�ȓI�؏���������������B��̎��Ö@�ł���1, 2)�A�O���J�S�m�[�}�̐f�f���m�肵�����_�ŊO�Ȑ؏����l������B�܂��A�f�f���̕��ώ�ᇌa�͑����XNET �ɔ�ׂđ傫��3)�B�]�ڂ̂قƂ�ǂ��̓]�ڂƃ����p�ߓ]�ڂł���A���Ɋ̓]�ڂ̕p�x��41-95���ƍ����ł��邪1, 3-6)�A�������A�̓]�ڂƂ��ɐ؏����\�ȏꍇ�́A�؏��p�����������B
�O���J�S�m�[�}�̓����p�ߓ]�ڂ����p�x�ł���A��ᇐ؏��ɉ��������p�ߊs�����K�{�ł���B�������̋Ǎ݂�90���ȏオ�X���ŁA�X�����A�̕��A�����̏��ɋǍݕp�x������1, 4-6)�B�p�����X�̔����؏��p�A�X���\��w���؏��p����{�Ƃ��邪�A�������̋Ǎ݂ɉ����ďp����ύX����B
�����؏����s�\�ȓ]�ڑ����F�߂�ꂽ�ꍇ�ł����Ă��A�������̐؏��ɂ���ᇂ̏k���́A�����O���J�S���Z�x��ቺ�����A�������铜�A�a�A�畆�a��(�V�������g��)�A�n���A���A�~�m�_���ǂɑ�����P���ʂ�����1, 2, 6)�B
�y�� ���z
1�j Wermers RA, Fatourechi V, Wynne AG, Kvols LK, Lloyd RV. The glucagonoma syndrome: clinical and pathologic features in 21 patients. Medicine (Baltimore). 1996; 75(2): 53-63.�i���x��Ⅳb�j
2�j Chastain MA. The glucagonoma syndrome: a review of its features and discussion of new perspectives. Am J Med Sci. 2001; 321(5): 306-320.�i���x��Ⅳb�j
3�j Kindmark H, Sundin A, Granberg D, Dunder K, Skogseid B, Janson ET, Welin S, Õberg K, Eriksson B. Endocrine pancreatic tumors with glucagon hypersecretion: a retrospective study of 23 cases during 20 years. Med Oncol. 2007; 24(3): 330-337.�i���x��Ⅳb�j
4�j Eldor R, Glaser B, Doviner V, Salmon A, Gross DJ. Glucagonoma and the glucagonoma syndrome - cumulative experience with an elusive endocrine tumor. Clin Endocrinol (Oxf). 2011; 74(5): 593-598.�i���x��Ⅳb�j
5�j Chu QD, Al-kasspooles MF, Smith JL, Nava HR, Douglass HO Jr, Driscoll D, Gibbs JF. Is glucagonoma of the pancreas a curable disease? Int J Pancreatol. 2001; 29(3): 155-162.�i���x��Ⅳb�j
6�j Soga J, Yakuwa Y. Glucagonoma/diabetico-dermatologenic syndrome (DDS): a statistical evaluation of 407 reported cases. J Hepatobiliary Pancreat Surg. 1998; 5(3): 312-319.�i���x��Ⅳb�j
CQ3-1-4�@VIP�I�[�}�̎�p�K���Əp���́H
����
VIP�I�[�}�Ɛf�f���ꂽ�ꍇ�A�؏��p������������i�O���[�hB�j�B�p���́A�����p�ߊs�����X�؏��p������������i�O���[�hB�j�B
�y�� ���z
�@�\��NET �ɂ������p�Ö@�̖ړI�́A�����\��̉��P�ƃz�������Ǐ�̊ɘa�ł���B����VIP �I�[�}���X���R�����Ƃ����鑽�ʂ̕��含��������̂Ƃ���WDHA �nj�Q(watery diarrhea-hypokalemia-achlorhydria syndrome)�ǂ��Đf�f����邱�Ƃ������A�Ǐ�ɘa�̏d�v���������B������ᇂ̊�����40-80���ł���1, 2, 4-6)�B��p�K���̓z�������Ǐ�A��ᇂ̑傫���A�Ǎ݁A�]�ڂ̗L���Ȃǂɂ���Č��܂�1, 2, 4-6)�B
�p�O�f�f�Ŋ̓]�ځE���u�]�ڂ�Ȃ��Ɛf�f���ꂽ�ꍇ�͐؏���p�̓K���ƂȂ�B�܂��A���������p�ߓ]�ځA�Ǐ��Z�������A�̓]�ڂ����݂��Ă���c�̂Ȃ��؏�(R0 ��p)���\�Ɣ��f�����ꍇ�͐؏���p�̓K���ƂȂ�1, 2, 4-6)�BR0 �؏�������Ɣ��f�����ꍇ���A�Ǐ�ɘa�̖ړI�Ō��ʎ�p���s�����Ƃ͐��������B��ᇂ�90���ȏ�̐؏����\�ł���A���ʎ�p�ɂ��Ǐ�ɘa�����҂ł���6-9)�B��p����ᇌ��ʎ�p�ɂƂǂ܂����ꍇ�́A�\�}�g�X�^�`���A�i���O���܂Ȃǂɂ��lj����Â����������B
�p���́A�X�����؏��p�A�X���\��w���؏��p�A�X�̔����؏��p�Ȃǂ��X�؏��p�����������B��ᇂ��������A�Z���E�]�ڂ��Ȃ��ꍇ�͎�ᇊj�o�p���I�������1, 2, 4-6, 10)�B�����p�ߓ]�ڂ��ꍇ�̓����p�ߊs�����K�v�ɂȂ�2)�BVIP �I�[�}�͒ʏ��X�ɔ������邪�A�H�ɏ\��w����ᇂ�����Ă���11)�A�X���Ɏ�ᇂ������ł��Ȃ��ꍇ�͏\��w���̌������K�v�ł���B�iCQ1-1-4���Q�Ɓj
�y�� ���z
1�j Metz DC, Jensen RT. Gastrointestinal neuroendocrine tumors: pancreatic endocrine tumors. Gastroenterology. 2008; 135: 1469-1492.�i���x��Ⅵ�j
2�j O'Toole D, Salazar R, Falconi M, Kaltsas G, Couvelard A, de Herder WW, Hyrdel R, Nikou G, Krenning E, Vullierme MP, Caplin M, Jensen R, Eriksson B; Frascati Consensus Conference; European Neuroendocrine Tumor Society. Rare functioning pancreatic endocrine tumors. Neuroendocrinology. 2006; 84(3): 189-195.�i���x��Ⅵ�j
3�j Nikou GC, Toubanakis C, Nikolaou P, Giannatou E, Safioleas M, Mallas E, Polyzos A. VIPomas: an update in diagnosis and management in a series of 11 patients. Hepatogastroenterology. 2005; 52(64): 1259-1265.�i���x��Ⅳb�j
4�j Akerstrom G, Hellman P. Surgery on neuroendocrine tumours. Best Pract Res Clin Endocrinol Metab. 2007; 21(1): 87-109.�i���x��Ⅵ�j
5�j Fendrich V, Waldmann J, Bartsch DK, Langer P. Surgical management of pancreatic endocrine tumors. Nat Rev Clin Oncol. 2009; 6(7): 419-428.�i���x��Ⅵ�j
6�j Abood GJ, Go A, Malhotra D, Shoup M. The surgical and systemic management of neuroendocrine tumors of the pancreas. Surg Clin North Am. 2009; 89(1): 249-266.�i���x��Ⅵ�j
7�j Jensen RT, Niederle B, Mitry E, Ramage JK, Steinmuller T, Lewington V, Scarpa A, Sundin A, Perren A, Gross D, O'Connor JM, Pauwels S, Kloppel G; Frascati Consensus Conference; European Neuroendocrine Tumor Society. Gastrinoma (duodenal and pancreatic). Neuroendocrinology. 2006; 84(3): 173-182. �i���x��Ⅵ�j
8�j Hodul P, Malafa M, Choi J, Kvols L. The role of cytoreductive hepatic surgery as an adjunct to the management of metastatic neuroendocrine carcinomas. Cancer Control. 2006; 13(1): 61-71.�i���x��Ⅳb�j
9�j Akyildiz HY, Mitchell J, Milas M, Siperstein A, Berber E. Laparoscopic radiofrequency thermal ablation of neuroendocrine hepatic metastases: long-term follow-up. Surgery. 2010; 148(6): 1288-1293.�i���x��Ⅳa�j
10�j Oberg K: Pancreatic endocrine tumors. Semin Oncol 2010; 37: 594-618. �i���x��Ⅵ�j
11�j Kirkwood KS, Debas HT: Neuroendocrine tumors: common presentations of uncommon disease. Compr Ther. 1995; 21(12): 719-725.�i���x��Ⅵ�j
CQ3-1-5�@���̑��̋@�\���XNET �̎�p�K���Əp���́H
����
�����؏��p���\�ȏꍇ�ɂ́A�؏��p������������i�O���[�hB�j�B�p���́A��ᇂ̋Ǎ݂��l�����āA�����p�ߊs�����X�؏��p������������i�O���[�hB�j�B�����؏����s�\�ȏꍇ�ɂ́A�Ǐ�̊ɘa�ړI�Ŏ�ᇌ��ʎ�p�����e������i�O���[�hC1�j�B
�y�� ���z
���̑��̋H�ȋ@�\���XNET �Ƃ��ẮA�\�}�g�X�^�`�m�[�}�i��70���j�AGRF �I�[�}�i��30���j�APP �I�[�}�i10-60���j�AACTH �I�[�}�i100���j�APTH �I�[�}�i100���j�A�j���[���e���V�m�[�}�i80�� �ȏ�j�Ȃǂ�����B���������Ɉ����̊������L�ڂ������A�����̊����͍���1)�B�����؏����\�Ɣ��f�����ꍇ�́A�؏��p�̓K���ƍl������1-5)�B�p���́A��ᇂ̋Ǎ݂Ɍ��������؏��p�ɉ����A�����p�ߊs�������������B�\�}�g�X�^�`�m�[�}�͑������\��w�����X�ɑ��݂�5-7)�A�܂�PP �I�[�}���������X�ɑ��݂��邽��1, 7)�A�X���\��w���؏����X�̔����؏�����{�p���Ƃ���B�]�ڂ����݂���ꍇ���A�؏����\�ł���ΐ؏������������2, 3)�B
�\�}�g�X�^�`�m�[�}��PP �I�[�}�̓z�������ߏ蕪��ɂ��ŗL�̏Ǐ��悷�邱�Ƃ����Ȃ�1, 5, 7)�B���̂悤�ȏꍇ�A�����؏����s�\�ł���Ό��ʎ�p�ɂ��Ǐ�ɘa��K�v�Ƃ��Ȃ��BGRF �I�[�}�ł͖��[���ǂ�悷�邽�߁A��ᇏk���ɂ��Ǐ�ɘa�����҂ł���3, 5)�BACTH �I�[�}�̓N�b�V���O�nj�Q��悷�邽�߁A���������؏��ł��Ȃ��ꍇ�ɗ����̕��t�؏��ɂ��Ǐ�ɘa�����������2)�B
�y�� ���z
1�j Kuo SCL, Gananadha S, Scarlett CJ, Gill A, Smith RC. Sporadic pancreatic polypeptide secreting tumors (PPomas) of the pancreas. World J Surg. 2008; 32(8): 1815-182.�i���x��Ⅳb�j
2�j O'Toole D, Salazar R, Falconi M, Kaltsas G, Couvelard A, de Herder WW, Hyrdel R, Nikou G, Krenning E, Vullierme MP, Caplin M, Jensen R, Eriksson B; Frascati Consensus Conference; European Neuroendocrine Tumor Society. Rare functioning pancreatic endocrine tumors. Neuroendocrinology. 2006; 84(3): 189-195.�i���x��Ⅵ�j
3�j Doherty GM. Rare endocrine tumors of the GI tract. Best Pract Res Clin Gastroenterol. 2005; 19(5): 807-817.�i���x��Ⅳb�j
4�j Fendrich V, Bartsch DK. Surgical treatment of gastrointestinal neuroendocrine tumors. Langenbecks Arch Surg. 2011; 396(3): 299-311.�i���x��Ⅳb�j
5�j Oberg K. Pancreatic endocrine tumors. Semin Oncol. 2010; 37(6): 594-618.�i���x��Ⅵ�j
6�j Garbrecht N, Anlauf M, Schmitt A, Henopp T, Sipos B, Raffel A, Eisenberger CF, Knoefel WT, Pavel M, Fottner C, Musholt TJ, Rinke A, Arnold R, Berndt U, Plöckinger U, Wiedenmann B, Moch H, Heitz PU, Komminoth P, Perren A, Klöppel G. Somatostatin-producing neuroendocrine tumors of the duodenum and pancreas: incidence, types, biological behavior, association with inherited syndromes, and functional activity. Endocr Relat Cancer. 2008; 15(1): 229-241.�i���x��Ⅳb�j
7�j Soga J, Yasukawa Y. Pancreatic endocrinomas: a statistical analysis of 1,857 cases. J hep Bil Pancr Surg. 1994; 1: 522-529.�i���x��Ⅳb�j
CQ3-1-6�@��@�\���XNET �̐؏��K���Əp���́H
����
�U�����̔�@�\��NET �Ɛf�f���ꂽ�ꍇ�A�����p�ߊs�����X�؏�������������i�O���[�hB�j�B2 cm �ȏ�̔�@�\��NET �ɑ��Ă͒�^�I�X�؏��p������������i�O���[�hB�j�B
�y�� ���z
�X�Ɍ��ǂ���NET �́A��p�����邱�Ƃŗ\�オ���P���邱�Ƃ�����Ă���1)�B�܂��ANET �̎�ᇌa�ƈ����x�����ւ��邱�Ƃ�������Ă���B���ۓI�ɂ�1 cm �ȉ��̔�@�\��NET �͊̓]�ڗ����Ⴍ�A�o�ߊώ@���\�ł���Ƃ̈ӌ���������2, 3)�B�������A2011 �N��NCCN �K�C�h���C���ɂ����Ă͎U�������XNET �͂��ׂĐ؏��p����������Ă���A�{�M�ɂ����Ă��X�؏��p�����S�Ɏ{�s�ł���{�݂ł͎U������@�\��NET �ɑ��āA�����̐؏��p�����������B
��p���s���ꍇ�ɂ́A�p����X�@�\�ɔz�������K�ȏp���I�����K�v�ł���4)�B�p���͎�ᇂ̑傫����Ǎ݂ɂ���đI������B��������ᇂɑ��Ă͊j�o�p�A�X�����؏��p�Ȃǔ��^�I�X�؏��p�̑I�����l������邪�A���^�I�X�؏��ł͍����Ǘ��������Ȃ�5-8)�B�j�o�p���s���ꍇ�ɂ͎��X�Ǒ����ɒ��ӂ��K�v������B1 cm �ȉ��̎�ᇂ�؏�����ꍇ�ɂ͊j�o�p�A1-2 cm �̎�ᇂ�؏�����ꍇ�͊j�o�p�܂����X�؏��p�����������B2cm �ȉ��̎�ᇂŔ��^�I�X�؏����s���ꍇ�ł����Ă��A�����p�ߓ]�ڂ̏\���Ȍ��������������B2cm �����ᇂɂ��ẮA�X�؏��p�ƃ����p�ߊs�����s�����Ƃ����������B
�y�� ���z
1�j Hill JS, McPhee JT, McDade TP, Zhou Z, Sullivan ME, Whalen GF, Tseng JF.: Pancreatic neuroendocrine tumors: the impact of surgical resection on survival. Cancer. 2009; 115(4): 741-751.�i���x��Ⅳa�j
2�j La Rosa S, Klersy C, Uccella S, Dainese L, Albarello L, Sonzogni A, Doglioni C, Capella C, Solcia E. Improved histologic and clinicopathologic criteria for prognostic evaluation of pancreatic endocrine tumors. Hum Pathol. 2009; 40(1): 30-40.�i���x��Ⅳa�j
3�j Bettini R, Partelli S, Boninsegna L, Capelli P, Crippa S, Pederzoli P, Scarpa A, Falconi M. Tumor size correlates with malignancy in nonfunctioning pancreatic endocrine tumor. Surgery. 2011; 150(1): 75-82.�i���x��Ⅳa�j
4�j Smith JK, Ng SC, Hill JS, Simons JP, Arous EJ, Shah SA, Tseng JF, McDade TP. Complications after pancreatectomy for neuroendocrine tumors: a national study. J Surg Res. 2010; 163(1): 63-68.�i���x��Ⅳa�j
5�j Falconi M, Zerbi A, Crippa S, Balzano G, Boninsegna L, Capitanio V, Bassi C, Di Carlo V, Pederzoli P. Parenchyma- preserving resections for small nonfunctioning pancreatic endocrine tumors. Ann Surg Oncol. 2010; 17(6): 1621-1627.�i���x��Ⅳb�j
6�j Evans DB, Skibber JM, Lee JE, Cleary KR, Ajani JA, Gagel RF, Sellin RV, Fenoglio CJ, Merrell RC, Hickey RC. Surgery. 1993; 114(6): 1175-1181; discussion 1181-1182.�i���x��Ⅳa�j
7�j Solorzano CC, Lee JE, Pisters PW, Vauthey JN, Ayers GD, Jean ME, Gagel RF, Ajani JA, Wolff RA, Evans DB. Nonfunctioning islet cell carcinoma of the pancreas: survival results in a contemporary series of 163 patients. Surgery. 2001; 130(6): 1078-1085. �i���x��Ⅳa�j
8�j Falconi M, Mantovani W, Crippa S, Mascetta G, Salvia R, Pederzoli P. Pancreatic insufficiency after different resections for benign tumours. Br J Surg. 2008; 95(1): 85-91.�i���x��Ⅳb�j
CQ3-1-7�@MEN1 �ɔ����X�E������NET �̎�p�K���Əp���́H
����
MEN1 �ɔ����X�E������NET �̂����A�K�X�g���m�[�}�A�C���X���m�[�}�Ȃǂ̋@�\��NET �͑傫���ɂ�����炸��p������������i�O���[�hB�j�BMEN 1�ɔ�����@�\��NET �́A�ʏ�2 cm �ȏ��NET ���؏��ΏۂƂȂ��i�O���[�hB�j�B�������A1-2 cm �ő���X��������ꂽ�ꍇ�ɂ́A�؏��p����������A1�p �ȉ��ł͌o�ߊώ@������������i�O���[�hB�j�B�����p�ߊs�����؏��p������������i�O���[�hB�j�B
�y�� ���z
MEN1 �ɔ����X�E������NET �͏\��w���E�X���瓯�����E�َ����ɑ������邱�Ƃ�����1)�B�K�X�g���m�[�}�͏\��w�����甭�����邱�Ƃ������A����NET ���X�����������B�@�\��NET �̕p�x�́A�K�X�g���m�[�}���ł������B�����̎�ᇂ���������ꍇ�ɂ́A�z����������̗L���A��ᇂ̑傫���A�����x�A�َ����E���������l�����Ď��Â���K�v������2, 3)�B���ɔ�@�\���XNET �́A�����p�x���ł������A�����Ȏ�ᇂƂ��đ������邱�Ƃ������B�����Ȕ�@�\���XNET �̎�p�K���Ɋւ��Ă̓R���Z���T�X���Ȃ��B1 �p ����ꍇ�ɐ؏������߂� �Ƃ�����4)��A2 �p �܂ł͊ώ@�����߂���Ƃ����5)������B2 �p ����ꍇ��1 �p�ȏ�ő���X�����F�߂���ꍇ�͐؏������������B�傫���XNET ��؏����邱�Ƃɂ��]�ځA�Z����\�h���邱�Ƃ���p�̖ړI�ł���6-8)�B
�p���̑I���ɍۂ��ẮA�K�X�g���m�[�}��C���X���m�[�}�Ȃǂ̋@�\��NET �ɂ��z�������ߏ蕪��Ǐ��L����ꍇ�A�z�������Ǐ�̊ɘa���d�v�ȖړI�ƂȂ�B������NET �����ɔF�߂�ꍇ�A�ǂ�NET ���z�������Ǐ�̌����ƂȂ��Ă���@�\��NET �ł��邩���ASASI �e�X�g�Ȃǂŏ\���Ɍ���������ŏp����I������K�v������B
�I�������p���́A��ᇂ̐��A�Ǎ݁A�z�������Ǐ�̗L���ɂ���āA�X���\��w���؏��A�X�̔����؏��A�X��ᇊj�o�p�A�\��w����ᇐ؏��p�A�X�����\��w���S�؏��p�A�X�S�E�p�Ȃǂ�I������2, 3)�B�������A�X�S�E��PS ��p�㌌���Ǘ��Ȃǂ��l�����ēK�������߂�B�����Ƀ����p�ߓ]�ڂ𗈂����Ƃ���A�����p�ߊs�����s�����Ƃ����������9, 10)�B
�U������NET �ƈقȂ�A�َ����X�E������NET �Ƒ�����̎�ᇂɑ���z�����K�v�ł���B�����p���ɂ́A�����X�E������NET ���Ĕ������邩�ۂ��͕s���ł���B���������āA�����p���ɗ\�h�I�Ȓlj��X�؏��͍s���ׂ��ł͂Ȃ��B�܂��AMEN1 �ł͕��b��B�@�\���i�ǂ≺���̑B��A���t�B����������邽�߁APS ���\���]��������Ŏ�p�K�����l������K�v������B
�y�� ���z
1�j Sakurai A, Suzuki S, Kosugi S, Okamoto T, Uchino S, Miya A, Imai T, Kaji H, Komoto I, Miura D, Yamada M, Uruno T, Horiuchi K, Miyauchi A, Imamura M; MEN Consortium of Japan, Fukushima T, Hanazaki K, Hirakawa S, Igarashi T, Iwatani T, Kammori M, Katabami T, Katai M, Kikumori T, Kiribayashi K, Koizumi S, Midorikawa S, Miyabe R, Munekage T, Ozawa A, Shimizu K, Sugitani I, Takeyama H, Yamazaki M. MEN Consortium of Japan. Multiple endocrine neoplasia type 1 in Japan: Establishment and analysis of a multicentre database. Clin Endocrinol (Oxf). 2012; 76(4): 533-539.�i���x��Ⅳb�j
2�j �N��W�m�GMEN1 �^�̐f�f�Ǝ��ÁD�̒_�X. 2011; 63(2): 285-291.�i���x��Ⅴ�j
3�j Imamura M, Komoto I, Ota S, Hiratsuka T, Doi R, Awane M, Inoue N.; Biochemically curative surgery for gastrinoma in multiple endocrine neoplasia type 1 patient. World J Gastroenterol. 2011; 17(10): 1343-1353.�i���x��Ⅳb�j
4�j �������V�GNET �Տ��̕ϑJ�F�Ǎݐf�f�@�̐i���ƕa�ԉ𖾁D��w�̂����. 2008; 224(10): 753-756.�i���x��Ⅴ�j
5�j Plöckinger U, Rindi G, Arnold R, Eriksson B, Krenning EP, de Herder ww, Goede A, Caplin M, Oberg K, Reubi JC, Nilsson O, Delle Fave G, Ruszniewski P, Ahlman H, Wiedenmann B; European Neuroendocrine Tumour Society. Guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. A consensus statement on behalf of the European Neuroendocrine Tumour Society (ENETS). Neuroendocrinology. 2004; 80(6): 394-424.�i���x��Ⅵ�j
6�j Fraker DL, Norton JA, Alexander HR, Venzon DJ, Jensen RT.; Surgery in Zollinger-Ellison syndrome alters the natural history of gastrinoma. Ann Surg. 1994; 220(3): discussion 320-330.�i���x��Ⅳa�j
7�j Norton JA, Fraker DL, Alexander HR, Gibril F, Liewehr DJ, Venzon DJ, Jensen RT.; Surgery increases survival in patients with gastrinoma. Ann Surg. 2006; 244(3): 410-419.�i���x��Ⅲ�j
8�j Bartsch DK, Fendrich V, Langer P, Celik I, Kann OH, Rothmund M.; Outcome of duodenopancreatic resections in patients with multiple endocrine neoplasia type 1. Ann Surg. 2005; 242(6): 757-764.�i���x��Ⅳb�j
9�j Norton JA, Alexander HR, Fraker DL, et al: Comparison of surgical results in patients with advanced and limited disease with multiple endocrine neoplasia type 1 and Zollinger-Ellison syndrome. Ann Surg. 2001; 234(4): 495-506.�i���x��Ⅳb�j
10�j Norton JA: Surgery and prognosis of duodenal gastrinoma as a duodenal neuronedocrine tumor. Best Pract Res Clin Gastroenterol. 2005; 19(5): 699-704.�i���x��Ⅳb�j
CQ3-2�@�]�ڂ��XNET �̎�p�K���́H
����
�O�Ȏ��ÁA���Ȏ��ÁA�W�w�I���ÂŐ���\�ȓ]�ڑ��i�̓]�ځE�����p�ߓ]�ځj��L�����XNET �́A�؏��p������������i�O���[�hB�j�B�؏��s�\�Ȋ̓]�ڂ�L�����XNET �́C�����ɂ�茴�����̐؏�������������i�O���[�hC1�j�B
�y�� ���z
�O�Ȏ��ÂŐ���\�Ȋ̓]�ځiCQ3-3���Q�Ɓj�A�����p�ߓ]�ڂ�L�����XNET �͓]�ڑ��ƂƂ��Ɏ�p�K���ł���B�č���SEER(Surveillance Epidemiology and End Results)���W�X�g���̑�K�̓f�[�^��1)�A�̈惊���p�ߓ]�ڂ������͎��͑���ւ̐Z�����Ǘ�≓�u�]�ڂ�L����Ǘ�ɑ���O�Ȏ��Â͗\������P���邱�Ƃ�������Ă���B�܂��A�؏��\�Ȋ̓]�ڂ���p�ߓ]�ڂ�L�����XNET �ɑ��A�̈惊���p�ߊs������p���{�s�����ꍇ�ɁA65-80���Ƃ����ǍD��5 �N������������Ă���2-6)�A�؏��\�Ȋ̓]�ڂ�Ǐ������p�ߓ]�ڂ�L�����XNET �͓]�ڑ��ƂƂ��Ɏ�p�K���ł���ƍl������
�]�ڑ���L�����XNET �ɑ����p�p���́A�ʏ�̋Ǐ������p�ߊs�����X�NJ��ɏ�������p���s���B���Ȃ킿�A�X�����̎�ᇂɑ��Ă��X���\��w���؏��p���A�X�̔����̎�ᇂɑ��Ă��B���E�o�p���������X�̔����؏��p���{�s�����7)�B
�XNET �Ɗ̓]�ڂ̓�����p�́A���ɏd�Ăȍ����ǂ������N�����\��������A��p�N�P���傫���Ȃ�ꍇ�͓���I��p���l������4, 8)�B�o���L�x�ȊO�Ȉオ����{�݂ɂ����ẮA�X�̔����؏��p�Ɗ̓]�ڂɑ��鎡�Â͈��S�Ɏ{�s�ł���ƍl������B�������A�X���\��w���؏��p�Ɗ̓]�ڂɑ��鎡�Â��s���ꍇ�́A����I�A����I���Âɂ�����炸�����ɍ����ǂ��F�߂��A���Ɋ̗t�؏��ȏ�̎��Â��s���K�v������ꍇ�́A��p�K�����̂�T�d�ɔ��f����K�v������9)�B
�؏��s�\�Ȋ̓]�ڂ�L�����XNET �̐؏��́A�������ɂ��_���E�����ǕǁA�o���A���ɂȂǂ̏Ǐ�̉��P��TAE ��TACE �Ȃǂ̊̑���ΏۂƂ������Â��I�����₷���Ȃ�Ƃ������_������B�܂��A�؏��s�\�Ȋ̓]�ڂ�L�����XNET �̌������̐؏����\������P����Ƃ̕�����10-14)�B����A�������̐؏��̈Ӌ`�͏Ǐ�ɘa�݂̂ł���Ƃ��錩��������15, 16)�A�XNET �������̐؏��̈Ӌ`�ɂ��Ă͌��_���o�Ă��Ȃ��B
�������؏��̓K�����l������ꍇ�́A�Ǐ��邩�����o��������Ǘ�ƁA�̓]�ڂ̒��x�╪���x���炠����x�̗\�オ�����߂�Ǘ�15, 17, 18)�Ɍ��肷��ׂ��ƍl������B
�y�� ���z
1�j Hill JS, McPhee JT, McDade TP, Zhou Z, Sullivan ME, Whalen GF, Tseng JF: Pancreatic neuroendocrine tumors: the impact of surgical resection on survival. Cancer. 2009; 115(4): 741-751.�i���x��Ⅳa�j
2�j Norton JA, Kivlen M, Li M, Schneider D, Chuter T, Jensen RT: Morbidity and mortality of aggressive resection in patients with advanced neuroendocrine tumors. Arch Surg. 2003; 138(8): 859-866.�i���x��Ⅳa�j
3�j House MG, Cameron JL, Lillemoe KD, Schulick RD, Choti MA, Hansel DE, HrubanRH, Maitra A, Yeo CJ. Differences in survival for patients with resectable versusunresectable metastases from pancreatic islet cell cancer. J Gastrointest Surg. 2006; 10(1): 138-145.�i���x��Ⅳa�j
4�j Sarmiento JM, Que FG, Grant CS, Thompson GB, Farnell MB, Nagorney DM:Concurrent resections of pancreatic islet cell cancers with synchronous hepaticmetastases: outcomes of an aggressive approach. Surgery. 2002; 132(6): 976-983.�i���x��Ⅳa�j
5�j Fendrich V, Langer P, Celik I, Bartsch DK, Zielke A, Ramaswamy A, Rothmund M: An aggressive surgical approach leads to long-term survival in patients with pancreatic endocrine tumors. Ann Surg 2006; 244(6): 845-853.�i���x��Ⅳa�j
6�j Cho CS, Labow DM, Tang L, Klimstra DS, Loeffler AG, Leverson GE, Fong Y, Jarnagin WR, D'Angelica MI, Weber SM, Blumgart LH, Dematteo RP: Histologic grade is correlated with outcome after resection of hepatic neuroendocrine neoplasms. Cancer. 2008; 113(1): 126-134.�i���x��Ⅳa�j
7�j �ؑ��@��: �X�������ᇂ̊O�Ȏ���. �X��. 2008; 23(6): 703-709.�i���x��Ⅵ�j
8�j Kianmanesh R, SauvaNET A, Hentic O, Couvelard A, Lévy P, Vilgrain V, Ruszniewski P, Belghiti J. Two-step surgery for synchronous bilobar liver metastases from digestive endocrine tumors: a safe approach for radical resection. Ann Surg. 2008; 247(4): 659-665.�i���x��Ⅳa�j
9�j De Jong MC, Farnell MB, Sclabas G, Cunningham SC, Cameron JL, Geschwind JF,Wolfgang CL, Herman JM, Edil BH, Choti MA, Schulick RD, Nagorney DM, Pawlik TM. Liver-directed therapy for hepatic metastases in patients undergoing pancreaticoduodenectomy: a dual-center analysis. Ann Surg. 2010; 252(1): 142-148.�i���x��Ⅳa�j
10�j Capurso G, Bettini R, Rinzivillo M, Boninsegna L, Delle Fave G, Falconi M. Role of Resection of the Primary Pancreatic Neuroendocrine Tumour Only in Patients with Unresectable Metastatic Liver Disease: A Systematic Review. Neuroendocrinology. 2011; 93(4): 223-229.�i���x��Ⅰ�j
11�j Evans DB, Skibber JM, Lee JE, Cleary KR, Ajani JA, Gagel RF, Sellin RV, Fenoglio CJ, Merrell RC, Hickey RC. Nonfunctioning islet cell carcinoma of the pancreas. Surgery. 1993; 114(6): 1175-1182.�i���x��Ⅳa�j
12�j Solorzano CC, Lee JE, Pisters PW, Vauthey JN, Ayers GD, Jean ME, Gagel RF, Ajani JA, Wolff RA, Evans DB. Nonfunctioning islet cell carcinoma of the pancreas: survival results in a contemporary series of 163 patients. Surgery. 2001; 130(6): 1078-1085.�i���x��Ⅳa�j
13�j Fraker DL, Norton JA, Alexander HR, Venzon DJ, Jensen RT. Surgery in Zollinger-Ellison syndrome alters the natural history of gastrinoma. Ann Surg. 1994; 220(3): discussion 320-330.�i���x��Ⅳa�j
14�j Franko J, Feng W, Yip L, Genovese E, Moser AJ. Non-functional neuroendocrine carcinoma of the pancreas: incidence, tumor biology, and outcomes in 2,158 patients. J Gastrointest Surg. 2010; 14(3): 541-548.�i���x��Ⅳa�j
15�j Bettini R, Mantovani W, Boninsegna L, Crippa S, Capelli P, Bassi C, Scarpa A, Pederzoli P, Falconi M. Primary tumour resection in metastatic nonfunctioning pancreatic endocrine carcinomas. Dig Liver Dis 2009; 41(1): 49-55.�i���x��Ⅳa�j
16�j Hung JS, Chang MC, Lee PH, Tien YW. Is surgery indicated for patients with symptomatic nonfunctioning pancreatic neuroendocrine tumor and unresectable hepatic metastases? World J Surg. 2007; 31(12): 2392-2397.�i���x��Ⅳa�j
17�j Bloomston M, Muscarella P, Shah MH, Frankel WL, Al-Saif O, Martin EW, Ellison EC. Cytoreduction results in high perioperative mortality and decreased survival in patients undergoing pancreatectomy for neuroendocrine tumors of the pancreas. J Gastrointest Surg. 2006; 10(10): 1361-1370.�i���x��Ⅳa�j
18�j Bruzoni M, Parikh P, Celis R, Are C, Ly QP, Meza JL, Sasson AR. Management of the primary tumor in patients with metastatic pancreatic neuroendocrine tumor: a contemporary single-institution review. Am J Surg. 2009; 197(3): 376-381.�i���x��Ⅳa�j
CQ3-3�@�XNET �̍Ĕ��a���̎�p�K���́H
����
�XNET �̍Ĕ��a���i�́A�Ǐ��A�����d��A�x�Ȃǁj�́A�؏��ɂ��Ǐ��\��̉��P�������܂��ꍇ�ɐ؏��p������������i�O���[�hB�j�B
�y�� ���z
- 1�j�XNET �̊̓]�ڍĔ��̎�p�K���̏����́A���L�̒ʂ�ł���B
�E�̑��ȊO�ɍĔ��������A�܂��͕��o���Ĕ����������Ă��Ă�����\�ȏ�Ԃł���B
�E�̐؏���Ɋ̗\���\�ɉ������\���Ȏc�̗e�ς��m�ۂł���B
�E�d�Ăȍ����ǂ������Ϗp�\�ł���B - 2�j�XNET �̋Ǐ��Ĕ��́A���̍Ĕ��a�ς̐��䂪�\�ŁA�؏����\�ł���Ύ�p�K���ł���B
- 3�j�����d��́A���̍Ĕ����̐��䂪�\�ŁA���͈͂Ő؏��\�ȕa�ςł���ΏW�w�I���Â̈ꕔ�Ƃ��Ď�p���l�������B
- 4�j�XNET �x�]�ڂ́A�x�ȊO�ɓ]�ڑ����Ȃ��A�؏���ɏ\���Ȕx�@�\���ۂ���A�d�Ăȍ����ǂ��Ȃ��Ϗp�\�ł���A��p�K��������B
�XNET �̍Ĕ��`���͊̓]�ڂ���̂ł���A�̓]�ڂɑ���O�Ȏ��Â͓�����Ǐ�̊ɘa��\��̉��P�����҂ł���̂ŏd�v�ł���B�XNET �̓]�ڂ̏Ǘ���30-50���܂�NET �̓]�ڂɊւ��邢�����̘_���ł́A�O�Ȏ��Â��{�s�����Ǘ��5 �N��������61-86��1-11)�A�z�������nj���܂ޏǏ�̉��P����90-100��1,4-7,12-14)�ƕ���Ă���B�O�Ȏ��Â̐��т��ǍD�ł��邱�Ƃ���1,5,15-17)�؏��\��NET �̓]�ڂ̑��I���̎��ÂƂ��ĊO�Ȏ��Â��{�s����Ă����B
�XNET �̓]�ڍĔ��̎�p�K���́A�̑��ȊO�ɓ]�ڂ��Ȃ����ƁA�\���\�ɉ������c�̗e�ς��ۏ����ȂǑϏp�\�ł��邱�Ƃ��K�v�����ƂȂ�B
NET �̓]�ڂɑ���O�Ȏ��Â�R0 ��p��ڎw���čs�����AR0 �ƂȂ�Ȃ��Ă���ᇂ��قڐ؏����ł��Ă����R0 ��p�Ɨ\��ɍ����F�߂��Ȃ������Ƃ�������3, 10, 11)�A�؏��\�ȕa�ς͐؏������������B
ENETS �̃K�C�h���C��18)�ł́A�̓]�ڂ̕��z�l���ɂ��A(A)��̋��܂��͗אڂ����̋��Ɋ̓]�ڂ����ǂ��Ă���n���I�̐؏��Ő؏����\�A(B)��̑傫�Ȋ̓]�ڑ��Ǝ��ӂɗ��t�ɂ킽�鏬�a�ς����݂��Ă���ꍇ�A(C)�̑S�̂ɂт܂Ɋ̓]�ڂ����݂��Ă���ꍇ�̎O�ɕ��ނ��Ă���A���̕��ނɉ��������Îw�j����Ă���B
�g�D�^���ᕪ���^�̏ꍇ�́A�������A�]�ڑ��ɂ�����炸�\��s�ǂł��邱�Ƃ�����Ă���7, 11, 19, 20)�A�p�O�Ɋ̓]�ڑ��ɑ��鐶�����s���ᕪ���^�Ɛf�f���ꂽ�ꍇ�́A�̐؏��͐�������Ȃ�18)�B
NET �̓]�ڂ̊O�Ȏ��Ì�̍Ĕ�����5 �N��80%�ȏ�ƕ���4, 7, 8, 9, 11)�A���̑�����2 �N�ȓ��ɍĔ����Ă���4, 7, 8, 9, 11, 13, 15)�B�̓]�ڂɑ���O�Ȏ��Â̑����́A�����I�Ӌ`�͏��Ȃ��ƍl�����Ă���B�Ĕ����ʂƂ��Ă͊́A���A�x�A�����p�߁A�����A�]�ȂǂŁA�̑����S�Ĕ����ʂ�80-90�����߂�4, 7, 8, 9, 11, 13, 15)�B
90���̎�ᇐ؏����s����ᇌ��ʎ�p�́A���ȓI���Âɒ�R���̃z�������nj��L����Ǘ�ɑ��čs�����ꍇ�A���������E���S���������킹���90�����x�̏Ǐ𗦂�����Ă���1, 4, 12, 21, 22)�B
NET �̊̓]�ڂɑ���̈ڐA�́A�]�ڂ��̂Ɍ��ǂ��Ă���؏��s�\�Ȋ̓]�ڂɑ��čs���Ă��邪�A�Ĕ�����������ʓI�ł͂Ȃ�18)�B�I�ʂ��ꂽ�Ǘ�ɂ����Ă��XNET �ɑ���̈ڐA�ɂ��\��̉��P��������\������������Ă���B23-30)
NET �ɕ����d�킪��������ꍇ�ɂ́A82-97���Ɋ̓]�ڂ��Ă���31, 32)�A�̓]�ڂ����d�v�ȗ\�㌈����q�ƂȂ�32)�B����Ŋ̓]�ڂ̊O�Ȏ��×�̗\����q�Ƃ��ĕ����d��Ȃǂ̊̊O�a�ς̑��݂�����Ă���9, 11)�B
NET �̔x�]�ڂ̎��ÂɊւ���͏��Ȃ�33)�A���m�Ȏ��Îw�j���������Ƃ͓�����A�x�ȊO�ɕa�ς��Ȃ��A�x�@�\�Ȃ�Ȃ��͈͂Ő؏����\���Ϗp�\�ȏǗ�ɂ����ēK�������ׂ��ƍl������B
�Ǐ��Ĕ��Ɋւ��Ă��A�؏����\�ł���ΐ؏����s���BSchurr ��34)�́A�Ǐ��Ĕ����܂ލĔ��a�ςɑ��ĐϋɓI�Ɏ�p���s���A�L�Ӎ��͂Ȃ��� OS �� DFS �͍Ď�p���{�s�����Q�ŗǍD�ȌX����F�߂��ƕ��Ă���B
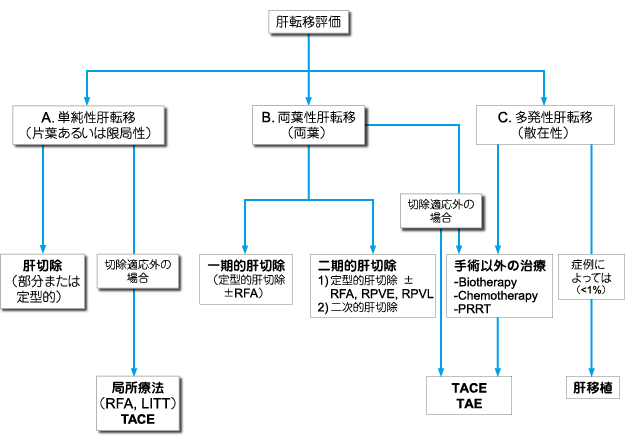
RFA; radiofrequency ablation, LITT; Laser-induced thermotherapy,
TACE; trans-catheter arterial chemoembolization, RPVE; right portal vein embolization,
RPVL; right portal vein ligation, TAE; trans-catheter arterial embolization, PRRT; peptide receptor radionuclide therapy
Steinmuller T, et al, Neuroendocrinology 2008 ������
�y�� ���z
1�j Chamberlain RS, Canes D, Brown KT, Saltz L, Jarnagin W, Fong Y, Blumgart LH: Hepatic neuroendocrine metastases: does intervention alter outcomes? J Am Coll Surg. 2000; 190(4): 432-445.�i���x��Ⅳa�j
2�j Pascher A, Steinmüller T, Radke C, Hosten N, Wiedenmann B, Neuhaus P, Bechstein WO: Primary and secondary hepatic manifestation of neuroendocrine tumors. Langenbecks Arch Surg 2000; 385(4): 265-270.�i���x��Ⅳa�j
3�j Elias D, Lasser P, Ducreux M, Duvillard P, Ouellet JF, Dromain C, Schlumberger M, Pocard M, Boige V, Miquel C, Baudin E: Liver resection (and associated extrahepatic resections) for metastatic well-differentiated endocrine tumors: a 15-year single center prospective study. Surgery. 2003; 133(4): 375-382.�i���x��Ⅳa�j
4�j Sarmiento JM, Heywood G, Rubin J, Ilstrup DM, Nagorney DM, Que FG. Surgical treatment of neuroendocrine metastases to the liver: a plea for resection to increase survival. J Am Coll Surg. 2003; 197(1): 29-37.�i���x��Ⅳa�j
5�j Touzios JG, Kiely JM, Pitt SC, Rilling WS, Quebbeman EJ, Wilson SD, Pitt HA. Neuroendocrine hepatic metastases: does aggressive management improve survival? Ann Surg. 2005; 241(5): 776-785.�i���x��Ⅳb�j
6�j Gomez D, Malik HZ, Al-Mukthar A, Menon KV, Toogood GJ, Lodge JP, Prasad KR. Hepatic resection for metastatic gastrointestinal and pancreatic neuroendocrine tumours: outcome and prognostic predictors. HPB (Oxford). 2007; 9(5): 345-351.�i���x��Ⅴ�j
7�j Cho CS, Labow DM, Tang L, Klimstra DS, Loeffler AG, Leverson GE, Fong Y, Jarnagin WR, D'Angelica MI, Weber SM, Blumgart LH, Dematteo RP. Histologic grade is correlated with outcome after resection of hepatic neuroendocrine neoplasms. Cancer. 2008; 113(1): 126-134.�i���x��Ⅳa�j
8�j Scigliano S, Lebtahi R, Maire F, Stievenart JL, Kianmanesh R, Sauvanet A, Vullierme MP, Couvelard A, Belghiti J, Ruszniewski P, Le Guludec D. Clinical and imaging follow-up after exhaustive liver resection of endocrine metastases: a 15-year monocentric experience. Endocr Relat Cancer. 2009; 16(3): 977-990.�i���x��Ⅳb�j
9�j Mayo SC, de Jong MC, Pulitano C, Clary BM, Reddy SK, Gamblin TC, Celinksi SA, Kooby DA, Staley CA, Stokes JB, Chu CK, Ferrero A, Schulick RD, Choti MA, Mentha G, Strub J, Bauer TW, Adams RB, Aldrighetti L, Capussotti L, Pawlik TM. Surgical management of hepatic neuroendocrine tumor metastasis: results from an international multi-institutional analysis. Ann Surg Oncol. 2010; 17(12): 3129-3136.�i���x��Ⅳa�j
10�j Glazer ES, Tseng JF, Al-Refaie W, Solorzano CC, Liu P, Willborn KA, Abdalla EK, Vauthey JN, Curley SA. Long-term survival after surgical management ofneuroendocrine hepatic metastases. HPB (Oxford). 2010; 12(6): 427-433.�i���x��Ⅳa�j
11�j Saxena A, Chua TC, Sarkar A, Chu F, Liauw W, Zhao J, Morris DL. Progression and survival results after radical hepatic metastasectomy of indolent advancedneuroendocrine neoplasms (NENs) supports an aggressive surgical approach. Surgery. 2011; 149(2): 209-220.�i���x��Ⅳa�j
12�j Que FG, Nagorney DM, Batts KP, Linz LJ, Kvols LK. Hepatic resection for metastatic neuroendocrine carcinomas. Am J Surg. 1995; 169(1): 36-43.�i���x��Ⅳa�j
13�j Dousset B, Saint-Marc O, Pitre J, Soubrane O, Houssin D, Chapuis Y. Metastatic endocrine tumors: medical treatment, surgical resection, or liver transplantation. World J Surg. 1996; 20(7): 908-915.�i���x��Ⅳa�j
14�j Frilling A, Li J, Malamutmann E, Schmid KW, Bockisch A, Broelsch CE. Treatment of liver metastases from neuroendocrine tumours in relation to the extent of hepatic disease. Br J Surg. 2009; 96(2): 175-184.�i���x��Ⅳa�j
15�j Chen H, Hardacre JM, Uzar A, Cameron JL, Choti MA. Isolated liver metastases from neuroendocrine tumors: does resection prolong survival? J Am Coll Surg. 1998; 187(1): 88-93.�i���x��Ⅳa�j
16�j Thompson GB, van Heerden JA, Grant CS, Carney JA, Ilstrup DM. Islet cell carcinomas of the pancreas: a twenty-year experience. Surgery. 1988; 104(6): 1011-1017.�i���x��Ⅳa�j
17�j Carty SE, Jensen RT, Norton JA. Prospective study of aggressive resection of metastatic pancreatic endocrine tumors. Surgery. 1992; 112(6): 1024-1032.�i���x��Ⅳa�j
18�j Steinmuüller T, Kianmanesh R, Falconi M, Scarpa A, Taal B, Kwekkeboom DJ, Lopes JM, Perren A, Nikou G, Yao J, Delle Fave GF, O'Toole D; Frascati Consensus Conference participants. Consensus guidelines for the management of patients with liver metastases from digestive (neuro)endocrine tumors: foregut, midgut, hindgut, and unknown primary. Neuroendocrinology. 2008; 87(1): 47-62.�i���x��Ⅵ�j
19�j Bilimoria KY, Talamonti MS, Tomlinson JS, Stewart AK, Winchester DP, Ko CY, Bentrem DJ. Prognostic score predicting survival after resection of pancreaticneuroendocrine tumors: analysis of 3851 patients. Ann Surg. 2008; 247(3): 490-500.�i���x��Ⅳa�j
20�j Strosberg J, Gardner N, Kvols L. Survival and prognostic factor analysis in patients with metastatic pancreatic endocrine carcinomas. Pancreas. 2009; 38(3): 255-258.�i���x��Ⅳa�j
21�j McEntee GP, Nagorney DM, Kvols LK, Moertel CG, Grant CS. Cytoreductive hepaticsurgery for neuroendocrine tumors. Surgery 1990; 108(6): 1091-1096.�i���x��Ⅳa�j
22�j Osborne DA, Zervos EE, Strosberg J, Boe BA, Malafa M, Rosemurgy AS, Yeatman TJ, Carey L, Duhaine L, Kvols LK. Improved outcome with cytoreduction versus embolization for symptomatic hepatic metastases of carcinoid and neuroendocrine tumors. Ann Surg Oncol. 2006; 13(4): 572-581.�i���x��Ⅳa�j
23�j Chung MH, Pisegna J, Spirt M, Giuliano AE, Ye W, Ramming KP, Bilchik AJ. Hepatic cytoreduction followed by a novel long-acting somatostatin analog: a paradigm for intractable neuroendocrine tumors metastatic to the liver. Surgery. 2001; 130(6): 954-962.�i���x��Ⅳa�j
24�j Lehnert T. Liver transplantation for metastatic neuroendocrine carcinoma: an analysis of 103 patients. Transplantation. 1998; 66(10): 1307-1312.�i���x��Ⅳa�j
25�j Ahlman H, Friman S, Cahlin C, Nilsson O, Jansson S, Wängberg B, Olausson M. Liver transplantation for treatment of metastatic neuroendocrine tumors. Ann N Y Acad Sci. 2004; 1014: 265-269.�i���x��Ⅳa�j
26�j Rosenau J, Bahr MJ, von Wasielewski R, Mengel M, Schmidt HH, Nashan B, Lang H,Klempnauer J, Manns MP, Boeker KH. Ki67, E-cadherin, and p53 as prognosticindicators of long-term outcome after liver transplantation for metastatic neuroendocrine tumors. Transplantation. 2002; 73(3): 386-394.�i���x��Ⅳa�j
27�j Lang H, Oldhafer KJ, Weimann A, Schlitt HJ, Scheumann GF, Flemming P, Ringe B, Pichlmayr R. Liver transplantation for metastatic neuroendocrine tumors. Ann Surg. 1997; 225(4): 347-354.�i���x��Ⅳa�j
28�j Le Treut YP, Grégoire E, Belghiti J, Boillot O, Soubrane O, Mantion G, Cherqui D, Castaing D, Ruszniewski P, Wolf P, Paye F, Salame E, Muscari F, Pruvot FR, Baulieux J. Predictors of long-term survival after liver transplantation for metastatic endocrine tumors: an 85-case French multicentric report. Am J Transplant. 2008; 8(6): 1205-1213. �i���x��Ⅳa�j
29�j Mazzaferro V, Pulvirenti A, Coppa J. Neuroendocrine tumors metastatic to the liver: how to select patients for liver transplantation? J Hepatol. 2007; 47(4): 460-466. �i���x��Ⅳa�j
30�j Máthé Z, Tagkalos E, Paul A, Molmenti EP, Kóbori L, Fouzas I, Beckebaum S, Sotiropoulos GC. Liver transplantation for hepatic metastases of neuroendocrine pancreatic tumors: a survival-based analysis. Transplantation. 2011; 91(5): 575-582.�i���x��Ⅳa�j
31�j Elias D, Sideris L, Liberale G, Ducreux M, Malka D, Lasser P, Duvillard P, Baudin E. Surgical treatment of peritoneal carcinomatosis from well-differentiated digestive endocrine carcinomas. Surgery. 2005; 137(4): 411-416. �i���x��Ⅳa�j
32�j Vasseur B, Cadiot G, Zins M, Fléjou JF, Belghiti J, Marmuse JP, Vilgrain V, Bernades P, Mignon M, Ruszniewski P. Peritoneal carcinomatosis in patients with digestive endocrine tumors. Cancer. 1996; 78(8): 1686-1692.�i���x��Ⅳa�j
33�j Khan JH, McElhinney DB, Rahman SB, George TI, Clark OH, Merrick SH. Pulmonary metastases of endocrine origin: the role of surgery. Chest 1998; 114(2): 526-534.�i���x��Ⅳa�j
34�j Schurr PG, Strate T, Rese K, Kaifi JT, Reichelt U, Petri S, Kleinhans H, Yekebas EF, Izbicki JR. Aggressive surgery improves long-term survival in neuroendocrine pancreatic tumors: an institutional experience. Ann Surg. 2007; 245(2): 273-281.�i���x��Ⅳa�j
CQ3-4�@������NET �̎�p�K���Əp���́H
CQ3-4-1�@������NET �ɐ���������p�K���Əp���́H
A ��p�K��
����
�Ǐ��̈�a�ρA�������I���Í���A�������I���Ì�̒lj����×v�������݂���ꍇ�A�؏��p������������i�O���[�hB�j�B
�y�� ���z
������NET �̎�p�K���́A��������ɂ��قȂ�B�ȉ��ɑ���ʂ̎�p�K�����������B
��NET �̎�p�K���́A���K�X�g�������ǂ̐�����v����Ⅰ�^�A��ᇌa��2 cm ���z���邩�������I�؏�����Ⅰ�AⅡ�^�A�̓]�ڂ̖���Ⅲ�^�ł���1, 2)�B�������I�؏�����Ƃ́A��ᇌa��1 �p ���邩�A���邢�͎�ᇌ���6 �ȏ�̏ꍇ�Ƃ���1)�B
�\��w��NET �̎�p�K���́A��ᇌa�� 1 �p���z����A�ŗL�ؑw�Ȑ[�̎�ᇐZ����(�^��)�A�����p�ߓ]�ڂ��i�^���j�ꍇ�ƁA�������I�؏��W�{�ɂ�����؏��f�[�z�������▬�ǐZ�������Ƃ������lj����×v���̑��݁A�ł���3)�B�Ȃ��A�K�X�g���m�[�}�̎�p�K�����Ă�CQ3-1-2 ���Q�ƁB
����NET �̎�p�K���́A�Ǐ��̈�a�ςł���B�Ǐ��̈�a�ςƂ͒��ǂƂ��̗̈惊���p�߂ɂƂǂ܂�͈͂ł̕a���i�W�Ƃ���2, 4, 5)�B
����NET �̎�p�K���́A�Ǐ��̈�a�ςł���B��ᇌa��1 cm ���z���A�ŗL�ؑw�Z������p�ߓ]�ڂ��i�^���j�ꍇ�ƁA�������I�؏��W�{�ɂ�����lj����×v�������݂���ꍇ�ł���2, 5, 6)�B�lj����×v���Ƃ́A�ŗL�ؑw�Z���A�؏��f�[�z���A���ǐZ���ily�j�ł���B
����NET �̎�p�K���́A��ᇌa��2 cm ���A��ᇌa��1�`2 cm �ŌŗL�ؑw�Z���A���ǐN�P�A�����p�ߓ]�ڂ̂����ꂩ���i�^���j�ꍇ�ƁA���������Í���ȏ��a�ςł���2, 7, 8)�B
����NET �́A�S�Ⴊ��p�K���ł���2, 5, 9)�B
�]�ڂ�������NET �̎�p�K���ɂ��ẮACQ3-5 ���Q�ƁB
B ��p�p��
����
�����p�ߊs������^�I����؏��p������������i�O���[�hB�j�B�������I���Í���Ȕ�r�I�����̏��a�ρiT1�j�ɑ��ẮA�Ǐ��؏��p������������i�O���[�hB�j�B
�y�� ���z
������NET �̎�p�p���͌�������ɂ��قȂ�B�ȉ��ɑ���ʂ̎�p�p�����������B
��NET �̎�p�p���ɂ́A�Ǐ��؏��p�A�H�哴�؏��p�A�����p�ߊs�����H�呤�ݐ؏��p�E�ݑS�E�p������1, 2)�B
�\��w��NET �̎�p�p���ɂ́A�����p�ߊs�����{�s�\���X���\��w���؏��p�i�H��։����A���S�݉����j�ƁA��ᇐ؏���ړI�Ƃ����X�����\��w���S�؏��p�A�\��w�������i���߁j�؏��p�A�����؏��p�A��ᇓE�o�p�E�j�o�p�A�Ȃǂ�����1, 3)�B
����NET �̎�p�p���́A�����؏��p�ƒ��Ԗ��������p�ߊs���ł���2, 4, 5)�B
����NET �̎�p�p���́A�����p�ߊs�������ǐ؏��p�ł���2, 5, 6)�B
����NET �̎�p�p���ɂ́A�����p�ߊs���������؏��i�f�j�p�ƁA�Ǐ��؏��Ƃ��Ă̌o���I�؏��p�E�o�卜�I�؏��p������2, 7, 8)�B
����NET �̎�p�p���ɂ́A�����p�ߊs���������E���؏��p�A��ӕ��؏��p�ƁA�����؏��p������2, 5, 9)�B
���o������p�͑I�����Ƃ��ċ��e�����1)�B
�y�� ���z
1�j �������V�ďC. �c����v�A���c�����. �X�E�����Ǔ������ᇁiNET�j�f�f���Î��H�}�j���A��, pp128-147, ������w��, ����, 2011. �i���x��Ⅵ�j
2�j Clark OH, Benson AB 3rd, Berlin JD, Choti MA, Doherty GM, Engstrom PF, Gibbs JF, Heslin MJ, Kessinger A, Kulke MH, Kvols L, Salem R, Saltz L, Shah MH, Shibata S, Strosberg JR, Yao JC; NCCN Neuroendocrine Tumors Panel Members. NCCN Clinical Practice Guidelines in Oncology: neuroendocrine tumors. J Natl Compr Canc Netw. 2009; 7(7): 712-747.�i���x��Ⅵ�j
3�j Scherübl H, Jensen RT, Cadiot G, Stölzel U, Klöppel G. Neuroendocrine tumors of the small bowels are on the rise: Early aspects and management. World J Gastrointest Endosc. 2010; 2(10): 325-34.�i���x��Ⅵ�j
4�j Eriksson B, Klöppel G, Krenning E, Ahlman H, Plöckinger U, Wiedenmann B, Arnold R, Auernhammer C, Körner M, Rindi G, Wildi S; Frascati Consensus Conference participants. Consensus guidelines for the management of patients with digestive neuroendocrine tumors: well-differentiated jejunal-ileal tumor/carcinoma. Neuroendocrinology. 2008; 87(1): 8-19.�i���x��Ⅵ�j
5�j Boudreaux JP, Klimstra DS, Hassan MM, Woltering EA, Jensen RT, Goldsmith SJ, Nutting C, Bushnell DL, Caplin ME, Yao JC. The NANETS consensus guideline for the diagnosis and management of neuroendocrine tumors: well-differentiated neuroendocrine tumors of the Jejunum, Ileum, Appendix, and Cecum. Pancreas. 2010; 39(6): 753-766.�i���x��Ⅵ�j
6�j Yao JC, Hassan M, Phan A, Dagohoy C, Leary C, Mares JE, Abdalla EK, Fleming JB, Vauthey JN, Rashid A, Evans DB. One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008; 26(18): 3063-3072.�i���x��Ⅴ�j
7�j Anthony LB, Strosberg JR, Klimstra DS, Maples WJ, O'Dorisio TM, Warner RR, Wiseman GA, Benson AB 3rd, Pommier RF. The NANETS consensus guidelines for the diagnosis and management of gastrointestinal neuroendocrine tumors (nets): well-differentiated nets of the distal colon and rectum. Pancreas. 2010; 39(6): 767-774.�i���x��Ⅵ�j
8�j Ramage JK, Goretzki PE, Manfredi R, Komminoth P, Ferone D, Hyrdel R, Kaltsas G, Kelestimur F, Kvols L, Scoazec JY, Garcia MI, Caplin ME; Frascati Consensus Conference participants. Consensus guidelines for the management of patients with digestive neuroendocrine tumours: well-differentiated colon and rectum tumour/carcinoma. Neuroendocrinology. 2008; 87(1): 31-39.�i���x��Ⅵ�j
9�j Plöckinger U, Couvelard A, Falconi M, Sundin A, Salazar R, Christ E, de Herder WW, Gross D, Knapp WH, Knigge UP, Kulke MH, Pape UF; Frascati Consensus Conference participants. Consensus guidelines for the management of patients with digestive neuroendocrine tumours: well-differentiated tumour/carcinoma of the appendix and goblet cell carcinoma. Neuroendocrinology. 2008; 87(1): 20-30.�i���x��Ⅵ�j
CQ3-4-2�@��NET �̎�p�K���Əp���́H
����
Rindi���ނɉ�������p�K���Əp���I��������������i�O���[�hB�j�B
| Ⅰ�^; | �������I�؏����� | ⇒�@�Ǐ��؏� |
| ���K�X�g�������ǂ̐��� | ⇒�@�H�哴�؏��iantrectomy�j | |
| Ⅱ�^; | �������I�؏�����i��ᇌa��1 cm ���邢�͌���6 �j | |
| ⇒�@�ݐ؏��{�����p�ߊs���A�\��w���K�X�g���m�[�}�̐؏� | ||
| Ⅲ�^; | �̓]�ڂȂ� | ⇒�@�ݐ؏��{�����p�ߊs�� |
| �̓]�ڂ��� | ⇒�@CQ3-5 �� | |
�y�� ���z
�݂�NET �́AA �^�݉��ɔ������K�X�g�������ǂɂ�萶����Ⅰ�^�AMEN1 �ɔ����Ĕ�������Ⅱ�^�A�U������Ⅲ�^�ɕ������1)�B��ʓI��Ⅰ�AⅡ�^�ɂ͏��a�ς��������AⅢ�^�ł͎�ᇌa���傫���]�ڂ������ł���1)�B
1 cm �ȏ��Ⅰ�^��ᇂ͋H�ł��邪�A①�������I�ɐ؏��ł��Ȃ��A②�Z���X���������A③�����ɂ��������I���S�؏�������ł���A�Ƃ����ꍇ�ɂ͈ݐ؏��p���l������B���K�X�g�������ǂ̐�����ړI�Ƃ��ėH�哴�؏����s���邱�Ƃ�����B
Ⅱ�^�ł͑����̏ꍇMEN1 ���Ă���A�\��w���a�ςɑ���O�Ȏ��Â���̂��Ȃ��BⅡ�^�ɔ����ݕa�ς͒�p�x�ł��邪�A���̏ꍇ�́A1-2 cm �̕a�ς��������A����4�`5 cm ���z���邱�Ƃ�����B���̏ꍇ�̎��Â�Ⅰ�^�ɏ����A��ᇌa��1 cm ���z���邩�A���ǐZ�������������ꍇ�͈ݐ؏��p��I�����A�����p�ߊs����t������B
Ⅲ�^�ɂ����ẮA��ᇂ͌Ǘ�����2 cm ���z������̂������A�ؑw���z���ĈݕǂZ��������̂��唼�ł���B�ݑ̕��A�ݒꕔ�ɍD�����A�����p�ߓ]�ڂ��Ă��邱�Ƃ������B�O�Ȏ��ÂƂ��ẮA���u�]�ڂ��Ƃ��Ȃ�Ȃ���L�͈̓����p�ߊs�����ݐ؏��p���l������2)�B
�{�M�ɂ�����sm �܂ł̐Z���������ǃJ���`�m�C�h1914 ��̕��͂ł́A��ᇌa0.5 cm �ȉ��̎�ᇂ�4.6���A1 cm �ȉ��̎�ᇂ�7.9���A2 cm �ȉ��̎�ᇂ�13.4���ɓ]�ڂ����݂���3)�B���̂��Ƃ��烊���p�ߊs�����ݐ؏��̓K������ᇌa��1 cm �Ƃ��邱�Ƃ͑Ó��ł���B��ᇌa�ɂ��O�Ȑ؏��K���́A�č��ł�2 cm �ȏ�4, 5)�A���[���b�p�ł�1cm �ȏ�6-8)�Ƃ���Ă���A�n��ɂ��قȂ邪�A�ؑw�Z����ɑ��郊���p�ߊs���̕t���ɂ��Ă͈�v���Đ�������Ă���4-8)�B
�{�M�ł́A�݂̈�����ᇂɑ���W����p�Ƃ���2 �Q�����p�ߊs�����݂�2/3 �ȏ�؏����蒅���Ă���B��ᇌa��1-2 cm �̈�NET �ɂ����郊���p�ߓ]�ڕp�x��21���ł��邱��3)���l������ƁA��ᇌa1 cm �ȏ�Asm �Z�����݂�NET �ɑ��ẮA2 �Q�����p�ߊs����(�H�哴���܂߂�)�H�呤�ݐ؏��p�A���邢�͈ݑS�E�p���{�s���ׂ��ł���B�ߔN�A���o�����ݐ؏��p�����y������9)�A���Â̑I�����ƂȂ蓾��B
�y�� ���z
1�j �����L�K�A�㐼�I�v. ���W�^������_�o�������ᇂ̐f�f�Ǝ��ÁD�㕔�����ǂɂ�����_�o�������ᇂ̐f�f�Ǝ���. ���O� 2008; 109: 147-151. �i���x��Ⅵ�j
2�j Akerström G, Hellman P. Surgery on neuroendocrine tumours. Best Pract Res Clin Endocrinol Metab 2007; 21(1): 87-109.�i���x��Ⅵ�j.
3�j Soga J. Early-stage carcinoids of the gastrointestinal tract: an analysis of 1914 reported cases. Cancer. 2005; 103(8): 1587-1595. �i���x��Ⅴ�j
4�j Clark OH, Benson AB 3rd, Berlin JD, Choti MA, Doherty GM, Engstrom PF, Gibbs JF, Heslin MJ, Kessinger A, Kulke MH, Kvols L, Salem R, Saltz L, Shah MH, Shibata S, Strosberg JR, Yao JC; NCCN Neuroendocrine Tumors Panel Members. NCCN Clinical Practice Guidelines in Oncology: neuroendocrine tumors. J Natl Compr Canc Netw. 2009; 7(7): 712-747.�i���x��Ⅵ�j
5�j Kulke MH, Anthony LB, Bushnell DL, de Herder WW, Goldsmith SJ, Klimstra DS, Marx SJ, Pasieka JL, Pommier RF, Yao JC, Jensen RT. NANETS treatment guidelines: well-differentiated neuroendocrine tumors of the stomach and pancreas. Pancreas. 2010; 39(6): 735-752.�i���x��Ⅵ�j
6�j Ruszniewski P, Delle Fave G, Cadiot G, Komminoth P, Chung D, Kos-Kudla B, Kianmanesh R, Hochhauser D, Arnold R, Ahlman H, Pauwels S, Kwekkeboom DJ, Rindi G; Frascati Consensus Conference; European neuroendocrine Tumor Society. Well-differentiated gastric tumors/carcinomas. Neuroendocrinology. 2006; 84(3): 158-164.�i���x��Ⅵ�j
7�j Ramage JK, Davies AH, Ardill J, Bax N, Caplin M, Grossman A, Hawkins R, McNicol AM, Reed N, Sutton R, Thakker R, Aylwin S, Breen D, Britton K, Buchanan K, Corrie P, Gillams A, Lewington V, McCance D, Meeran K, Watkinson A; UKNET work for Neuroendocrine Tumours. Guidelines for the management of gastroenteropancreatic neuroendocrine (including carcinoid) tumours. Gut. 2005; 54 Suppl 4: iv1-16.�i���x��Ⅵ�j
8�j Janson ET, Sørbye H, Welin S, Federspiel B, Grønbaek H, Hellman P, Mathisen O, Mortensen J, Sundin A, Thiis-Evensen E, Välimäki MJ, Oberg K, Knigge U. Nordic Guidelines 2010 for diagnosis and treatment of gastroenteropancreatic neuroendocrine tumours. Acta Oncol. 2010; 49(6): 740-756.�i���x��Ⅵ�j
9�j Hoshino M, Omura N, Yano F, Tsuboi K, Matsumoto A, Yamamoto SR, Akimoto S, Kashiwagi H, Yanaga K. Usefulness of laparoscope-assisted antrectomy for gastric carcinoids with hypergastrinemia. Hepatogastroenterology. 2010; 57(98): 379-382.�i���x��Ⅴ�j
CQ3-4-3�@�\��w��NET �̎�p�K���Əp���́H
����
�\��w��NET �͎��̏ꍇ�Ɏ�p������������i�O���[�hB�j�B
��ᇌa��1cm ���z����ꍇ�A
�ŗL�ؑw�Ȑ[�̎�ᇐZ�����i�^���j�ꍇ�A
�����p�ߓ]�ڂ��i�^���j�ꍇ�A
�������I�؏��W�{�Ő؏��f�[�z�������▬�ǐZ���������ꍇ
�p���́A�����p�ߊs�����؏��p������������i�O���[�hB�j�B
�y�� ���z
�\��w��NET �́A�{�M�̏�����NET ��16.7�����߁A�����i55.7���j�Ɏ����ō��p�x�ł���1)�B����A���Ăł͑S�g��NET ��3.8�`6.5���ƋH�ł���2, 3)�B�\��w��NET �̑����͔�@�\���Ńz�������֘A�Ǐ�킸�A�U�����ŁA�������^�iG1�j��悷��4)�B��@�\��NET �ł͎�ᇍזE���K�X�g������\�}�g�X�^�`���Ȃǂ̃z������������������̂̓�����Ǐ��Ȃ����̂�ᕪ���^NET�iNEC�j�Ȃǂ��܂܂�Ă��� 5)�B�@�\��NET �ł̓K�X�g���m�[�}��60�`75���Ƒ啔�����߁A�\��w���K�X�g���m�[�}��50�`90���Ƀ����p�ߓ]�ڂ��Ƃ̕����� 5)�B
�������^�iG1�j�A��@�\���A1 cm �ȉ��̏\��w��NET �͓��������Â̓K���ƂȂ�iCQ4-1-2���Q�Ɓj�B���������Ď�p�K���́A①��ᇌa��1 cm ���z����ꍇ�A②�ŗL�ؑw�Ȑ[�̎�ᇐZ�����ꍇ�A③�����p�ߓ]�ڂ����邩�^����ꍇ�A④�������I�؏��W�{�ɐ؏��f�[�z�������▬�ǐZ������������ꍇ�A�ȂǂƂȂ�B��p�p���́A��ᇂ̋Ǎ݂Ɛi�W���x�ɂ��A��ᇓE���p�A�\��w���؏��p�A�X���\��w���؏��p�i�H��։����A���S�݉����j�A�X�����\��w���S�؏��p�Ȃǂ�����B������̏ꍇ�ɂ������p�ߊs�����s�����Ƃ���ŁA�X���\��w���؏��p�͋Ǐ������p�ߊs���̓_�ōł��D��Ă���6)�B
�y�� ���z
1�j Ito T, Sasano H, Tanaka M, Osamura RY, Sasaki I, Kimura W, Takano K, Obara T, Ishibashi M, Nakao K, Doi R, Shimatsu A, Nishida T, Komoto I, Hirata Y, Nakamura K, Igarashi H, Jensen RT, Wiedenmann B, Imamura M. Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan. J Gastroenterol. 2010; 45(2): 234-243.�i���x��Ⅳb�j
2�j Yao JC, Hassan M, Phan A, Dagohoy C, Leary C, Mares JE, Abdalla EK, Fleming JB, Vauthey JN, Rashid A, Evans DB. One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008; 26(18): 3063-3072.�i���x��Ⅴ�j
3�j Ploeckinger U, Kloeppel G, Wiedenmann B, Lohmann R; representatives of 21 German NET Centers. The German NET -registry: an audit on the diagnosis and therapy of neuroendocrine tumors. Neuroendocrinology 2009; 90: 349-363.�i���x��Ⅳa�j
4�j Scherübl H, Jensen RT, Cadiot G, Stölzel U, Klöppel G. Neuroendocrine tumors of the small bowels are on the rise: Early aspects and management. World J Gastrointest Endosc. 2010; 2(10): 325-334.�i���x��Ⅵ�j
5�j Hartel M, Wente MN, Sido B, Friess H, Büchler MW. Carcinoid of the ampulla of Vater. J Gastroenterol Hepatol. 2005; 20(5): 676-681.�i���x��Ⅵ�j
6�j Mullen JT, Wang H, Yao JC, Lee JH, Perrier ND, Pisters PW, Lee JE, Evans DB. Carcinoid tumors of the duodenum. Surgery. 2005; 138(6): 971-977.�i���x��Ⅴ�j
CQ3-4-4�@����NET �̎�p�K���Əp���́H
����
����NET ���Ǐ��̈�a�ς̏ꍇ�A�؏��p������������i�O���[�hB�j�B
�p���́A�����p�ߊs���������؏��p������������i�O���[�hB�j�B
�y�� ���z
����NET �́A���Ăł͍��p�x�i�S�g��NET ��22-34���j�ł��邪�{�M�ł͒ᗦ�ł���1)�B�{�M�̏�����NET �ɐ�߂鏬��NET �̊����́A��1.6���A��0.6���ƕ���Ă���2)�B
�A��NET�iG1�AG2�j�́A�������̎�ᇌa���������ꍇ�ł������p�ߓ]�ڂ����������X�N�������Bsm �܂ł̐Z���������J���`�m�C�h94 ��̂���37.2���ɓ]�ڂ��݂��A��ᇌa�ʂł�0.5 cm �ȉ���17.2���A1 cm �ȉ���30.2���A2 cm �ȉ���34.2���A2 cm �ȏ��53.3���ɓ]�ڂ��F�߂�ꂽ3)�B��ʓI�ɁA��ᇂ͌��������������p�ߓ]�ڑ����傫���A�����͒��Ԗ����ő@�ۉ����Ă���A���Ԗ��������E���Ȃ����邱�ƂŌ�����Q�̌����ƂȂ�4)�B
����NET �ɑ����p�K���́A�����؏��\�ȋǏ��̈�a�ςł���B�Ǐ��̈�a�ςƂ͒��ǂƂ��̗̈惊���p�߂ɂƂǂ܂����͈͂ł̕a���i�W���w���B���Â̌����͏����؏��ƒ��Ԗ��������p�ߊs���ł���A�\�Ȍ���̊O�Ȑ؏����s��4-7)�B
������NET �͒��Ǔ��ɑ������邱�Ƃ�����A�S�����ɑ��錟�����d�v�ƂȂ�4)�B�]���A���̕��@�Ƃ��Ă͏p���̐G�f�����p����Ă���4)�B�ߔN�ł́A�����Ǔ�����������Z�̐i�����������A�X�N���[�j���O��ړI�Ƃ������������Ǔ������������ɂ����鏬�������̏d�v��8)��A�_�u���o���[�������������iDBE�j9)�A�J�v�Z����������DBE �̕��p�ɂ�鏬��NET �̔����A�f�f���̌���̉\��10)���w�E����Ă���B
�y�� ���z
1�j �������V�ďC. �c����v�A���c�����. �X�E�����Ǔ�������(NET�j�f�f���Î��H�}�j���A��, pp128-147, ������w��, ���� , 2011. �i���x��Ⅵ�j
2�j Ito T, Sasano H, Tanaka M, Osamura RY, Sasaki I, Kimura W, Takano K, Obara T, Ishibashi M, Nakao K, Doi R, Shimatsu A, Nishida T, Komoto I, Hirata Y, Nakamura K, Igarashi H, Jensen RT, Wiedenmann B, Imamura M. Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan. J Gastroenterol. 2010; 45(2): 234-243.�i���x��Ⅳb�j
3�j Soga J. Early-stage carcinoids of the gastrointestinal tract: an analysis of 1914 reported cases. Cancer. 2005; 103(8): 1587-1595.�i���x��Ⅴ�j
4�j Boudreaux JP, Klimstra DS, Hassan MM, Woltering EA, Jensen RT, Goldsmith SJ, Nutting C, Bushnell DL, Caplin ME, Yao JC. The NANETS consensus guideline for the diagnosis and management of neuroendocrine tumors: well-differentiated neuroendocrine tumors of the Jejunum, Ileum, Appendix, and Cecum. Pancreas 2010; 39(6): 753-766.�i���x��Ⅵ�j
5�j Clark OH, Benson AB 3rd, Berlin JD, Choti MA, Doherty GM, Engstrom PF, Gibbs JF, Heslin MJ, Kessinger A, Kulke MH, Kvols L, Salem R, Saltz L, Shah MH, Shibata S, Strosberg JR, Yao JC; NCCN Neuroendocrine Tumors Panel Members. NCCN Clinical Practice Guidelines in Oncology: neuroendocrine tumors. J Natl Compr Canc NET w. 2009; 7(7): 712-747.�i���x��Ⅵ�j
6�j Eriksson B, Klöppel G, Krenning E, Ahlman H, Plöckinger U, Wiedenmann B, Arnold R, Auernhammer C, Körner M, Rindi G, Wildi S; Frascati Consensus Conference participants. Consensus guidelines for the management of patients with digestive neuroendocrine tumors: well-differentiated jejunal-ileal tumor/carcinoma. Neuroendocrinology. 2008; 87(1): 8-19.�i���x��Ⅵ�j
7�j Norlén O, Stålberg P, Oberg K, Eriksson J, Hedberg J, Hessman O, Janson ET, Hellman P, Akerström G. Long-Term Results of Surgery for Small Intestinal Neuroendocrine Tumors at a Tertiary Referral Center. World J Surg. 2012; 36(6): 1419-1431.�i���x��Ⅴ�j
8�j Buitrago D, Trencheva K, Zarnegar R, Finnerty B, Aldailami H, Lee SW, Sonoda T, Milsom JW, Fahey TJ 3rd. The impact of incidental identification on the stage at presentation of lower gastrointestinal carcinoids. J Am Coll Surg. 2011; 213(5): 652-656.�i���x��Ⅴ�j
9�j Bellutti M, Fry LC, Schmitt J, Seemann M, Klose S, Malfertheiner P, Mönkemüller K.Detection of neuroendocrine tumors of the small bowel by double balloon enteroscopy. Dig Dis Sci. 2009; 54(5): 1050-1058.�i���x��Ⅴ�j
10�j Yamagishi H, Fukui H, Shirakawa K, Oinuma T, Hiraishi H, Terano A, Fujimori T, Nakamura T. Early diagnosis and successful treatment of small-intestinal carcinoid tumor: useful combination of capsule endoscopy and double-balloon endoscopy. Endoscopy. 2007; 39 Suppl 1: E243-244.�i���x��Ⅴ�j
CQ3-4-5�@����NET �̎�p�K���Əp���́H
����
����NET �͈ȉ��̏ꍇ�ɁA�؏��p������������i�O���[�hB�j�B
��ᇌa��1 cm ���z���A�ŗL�ؑw�Z����Ǐ������p�ߓ]�ڂ��^����ꍇ
�������I�؏��W�{�ɂ����Ēlj����×v�������݂���ꍇ
�p���́A�����p�ߊs�������ǐ؏��p������������i�O���[�hB�j�B
�y�� ���z
����NET �́A�Ӓ��ɍD�����A�{�M�̏�����NET ��2.1�����߂�1)�B����NET �͏Ǐ��܂ő��債�A��r�I�傫�Ȏ�ᇌa�Ƃ��Ĕ�������邱�Ƃ�����2)�B���������āA��ᇂ͋Ǐ��ߐi�W��悷�邱�Ƃ�����2)�A�����p�ߓ]�ځi30-40���j��̓]�ځi20-40���j�����p�x�ɔ���3-5)�B
�ߔN�ł́A�X�N���[�j���O��ړI�Ƃ��鉺�������Ǔ�������������NET �̏��a�ς����R���������@������Ă���4)�B
����NET �̎�p�K���͋Ǐ��̈�a�ςł���B�Ǐ��̈�a�ςƂ͒��ǂƂ��̗̈惊���p�߂ɂƂǂ܂����͈͂ł̕a���i�W���w���B�ʏ�́A��ᇌa��1 cm ���z���A�e��摜�f�f�ɂČŗL�ؑw�Z������p�ߓ]�ڂ��ꍇ�ƁA���������Ì�̐؏��W�{�ɌŗL�ؑw�Z���A�؏��f�[�z���A���ǐN�P�A�Ƃ������lj����Â�v������q��F�߂��ꍇ�ł���2, 6)�B
�Ǐ��̈�a�ςɑ���p���I���́A�����p�ߊs�������ǐ؏��p�ł���2, 6)�B
�y�� ���z
1�j Ito T, Sasano H, Tanaka M, Osamura RY, Sasaki I, Kimura W, Takano K, Obara T, Ishibashi M, Nakao K, Doi R, Shimatsu A, Nishida T, Komoto I, Hirata Y, Nakamura K, Igarashi H, Jensen RT, Wiedenmann B, Imamura M. Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan. J Gastroenteroll. 2010; 45(2): 234-243.�i���x��Ⅳb�j
2�j Boudreaux JP, Klimstra DS, Hassan MM, Woltering EA, Jensen RT, Goldsmith SJ, Nutting C, Bushnell DL, Caplin ME, Yao JC. The NANETS consensus guideline for the diagnosis and management of neuroendocrine tumors: well-differentiated neuroendocrine tumors of the Jejunum, Ileum, Appendix, and Cecum. Pancreas. 2010; 39(6): 753-766.�i���x��Ⅵ�j
3�j Konishi T, Watanabe T, Kishimoto J, Kotake K, Muto T, Nagawa H; Japanese Society for Cancer of the Colon and Rectum. Prognosis and risk factors of metastasis in colorectal carcinoids: results of a nationwide registry over 15 years. Gut. 2007; 56(6): 863-868.�i���x��Ⅴ�j
4�j Buitrago D, Trencheva K, Zarnegar R, Finnerty B, Aldailami H, Lee SW, Sonoda T, Milsom JW, Fahey TJ 3rd. The impact of incidental identification on the stage at presentation of lower gastrointestinal carcinoids. J Am Coll Surg. 2011; 213(5): 652-656.�i���x��Ⅴ�j
5�j Yao JC, Hassan M, Phan A, Dagohoy C, Leary C, Mares JE, Abdalla EK, Fleming JB, Vauthey JN, Rashid A, Evans DB. One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008; 26(18): 3063-3072.�i���x��Ⅴ�j
6�j Clark OH, Benson AB 3rd, Berlin JD, Choti MA, Doherty GM, Engstrom PF, Gibbs JF, Heslin MJ, Kessinger A, Kulke MH, Kvols L, Salem R, Saltz L, Shah MH, Shibata S, Strosberg JR, Yao JC, NCCN Neuroendocrine Tumors Panel Members. NCCN Clinical Practice Guidelines in Oncology: neuroendocrine tumors. J Natl Compr Canc Netw. 2009; 7(7): 712-747.�i���x��Ⅵ�j
CQ3-4-6�@����NET �̎�p�K���Əp���́H
����
����NET �͈ȉ��̏ꍇ�A�؏��p������������i�O���[�hB�j�B
��ᇌa��2 cm ����ꍇ
��ᇌa��1-2 cm �ŌŗL�ؑw�Z���A���ǐN�P�A�Ǐ������p�ߓ]�ڂ̋^��������ꍇ
�p���́A�����p�ߊs���������؏�(�f)�p������������i�O���[�hB�j�B
���������Í���ȏ��a�ςɑ��Ă͌o���E�o�卜�I�؏��p�܂��͒����؏�(�f)�p������������i�O���[�hB�j�B
| ��ᇌa��1 cm | ⇒�@���������ÁiCQ4-1-3���Q�Ɓj |
| ��ᇌa��2 cm | ⇒�@�����؏��i�f�j�p�{�����p�ߊs�� |
| ��ᇌa1-2 cm�{�ŗL�ؑw�Z�� �܂��� ���ǐN�P �܂��� �����p�ߓ]�ڂ��� | |
| ⇒�@�����؏��i�f�j�p�{�����p�ߊs�� | |
| ��ᇌa1-2 cm�{�ŗL�ؑw�Z���E���ǐN�P�E�����p�ߓ]�ڂ��Ȃ��A���������Í���ȏꍇ | |
| ⇒�@�o���E�o�卜�I�؏��܂��͒����؏��i�f�j�p | |
| �]�ڐ��a�� | ⇒�@CQ3-5 �� |
�y�� ���z
�{�M�ɂ����钼��NET �̊����́A������NET ��55.7���ƍ��p�x�ł���1)�B�����ɂ�����D�����ʂ͉��������ƕ���2, 3)�A80���̏Ǘ�ɂ����Ď��������10 cm �ȓ��ɔ�������3)�B
�{�M�ł͍��x�ȏ����Ǔ������f�f�E���Â���������Ă��邱�Ƃ���A��ᇌa1 cm �ȉ��̒���NET �ɑ��ẮA�������EEUS ������������A�[�B�xsm �Ȑ�̏ꍇ�͓������I�ꊇ�؏����s�����邱�Ƃ���ʓI�ł���iCQ4-1-3���Q�Ɓj�B�؏��ޗ��̕a���g�D�w�I�����ɂ��ŗL�ؑw�Z���A�؏��f�[�z���A���ǐN�P�Ȃǂ��������ꂽ�ۂ́A�����p�ߊs���������p��K������B��ᇌa2 cm �ȏ�̏ꍇ�A58-76���������p�ߓ]�ڗz���ł���2-5)���Ƃ���A�����p�ߊs���������p�̓K���ł���B�����p�Ƃ͐i�s�������ɑ��鍪���p���ɏ������A�����Ԗ��E�����Ԗ����̃����p�ߊs���������؏��i�f�j�p���w���B��ᇌa��1-2 cm �̏ꍇ�A�����p�ߓ]�ڕp�x��18.5-30.4���ƍ��p�x�ł���2, 3)���Ƃ���A�����Ƃ��ă����p�ߊs���������p�̓K���ƂȂ�B��O�I�ɌŗL�ؑw�Z���E���ǐN�P�E�����p�ߓ]�ڂ�Ȃ��a�ςɊւ��ẮA�������I���邢�͊O�ȓI�Ǐ��؏��݂̂Ŏ��Â��I�����邱�Ƃ��\�ł���6-8)�B
����NET �ɂ����郊���p�ߓ]�ڂ̊댯���q�́A��ᇌa��1 cm 3-5)�A��ᇕ\�ʐ���i���A��ᇌ`���j3)�A���ǐN�P�z��3-5)�ł���A���Õ��j�����������ŗ��ӂ��ׂ��ł���B�܂��A�{�M648 ��̉�͌��ʂ���A��ᇌa1.1-1.5 cm �̕a�ςł����Ă��Asm �Z������4,000 ��m �����ł���Ǐ��؏����s�����A���ǐN�P�̗L���ɂ�荪���p��K������Ƃ��������݂�����2)�B
�O�ȓI�Ǐ��؏��ɂ́A�o���I�؏��p9)�ƌo�卜�I�؏��p10)������B�o���I�؏��p��TEM �ƌď̂���9)�A��ᇌa���傫���A�������I�؏�������Ȑ[�B�xsm �Ȑ�̕a�ςɑ��K���ƂȂ�B�ߔN�A�������I���Â̐i���ɔ����ATEM �̎��{�͌������Ă���B����A�o�卜�I�؏��p�́A�Ǎ݂����ʒ����̂���TEM �ł̓��B������A���邢�͎�ᇌa�̑傫�Ȓ����a�ς̏ꍇ�ɐ��������7)�B�o�卜�I�؏��̓��F�́A�����Ԗ����̃����p�߂��T���v�����O���A�lj��؏��i�����p�j�̗v�ۂ��A�Ǐ��؏���̕a�������ʼn\�ȓ_�ł���10)�B
�y�� ���z
1�j Ito T, Sasano H, Tanaka M, Osamura RY, Sasaki I, Kimura W, Takano K, Obara T, Ishibashi M, Nakao K, Doi R, Shimatsu A, Nishida T, Komoto I, Hirata Y, Nakamura K, Igarashi H, Jensen RT, Wiedenmann B, Imamura M. Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan. J Gastroenterol. 2010; 45(2): 234-243. �i���x��Ⅳb�j
2�j �֓��S��A�≺�����A�ѓc�O�Y: �咰�J���`�m�C�h��ᇂ̑S���W�v. �݂ƒ� 2005; 40(2): 200-213.�i���x��Ⅴ�j
3�j ����N�Y�A�|�{��V�A��������. �咰�J���`�m�C�h�̃����p�ߓ]�ڊ댯���q(�A���P�[�g����). �����O��Y�ďC. �咰����NOW 2007, ���{���f�B�J���Z���^-, ����, pp121-128, 2007. �i���x��Ⅴ�j
4�j Konishi T, Watanabe T, Kishimoto J, Kotake K, Muto T, Nagawa H; Japanese Society for Cancer of the Colon and Rectum. Prognosis and risk factors of metastasis in colorectal carcinoids: results of a nationwide registry over 15 years. Gut. 2007; 56(6): 863-868.�i���x��Ⅴ�j
5�j Shields CJ, Tiret E, Winter DC; International Rectal Carcinoid Study Group. Carcinoid tumors of the rectum: a multi-institutional international collaboration. Ann Surg. 2010; 252(5): 750-755.�i���x��Ⅴ�j
6�j Clark OH, Benson AB 3rd, Berlin JD, Choti MA, Doherty GM, Engstrom PF, Gibbs JF, Heslin MJ, Kessinger A, Kulke MH, Kvols L, Salem R, Saltz L, Shah MH, Shibata S, Strosberg JR, Yao JC, NCCN Neuroendocrine Tumors Panel Members. NCCN Clinical Practice Guidelines in Oncology: neuroendocrine tumors. J Natl Compr Canc Netw. 2009; 7(7): 712-747.�i���x��Ⅵ�j
7�j Anthony LB, Strosberg JR, Klimstra DS, Maples WJ, O'Dorisio TM, Warner RR, Wiseman GA, Benson AB 3rd, Pommier RF. The NANETS consensus guidelines for the diagnosis and management of gastrointestinal neuroendocrine tumors (nets): well-differentiated nets of the distal colon and rectum. Pancreas. 2010; 39(6): 767-774. �i���x��Ⅵ�j
8�j Ramage JK, Goretzki PE, Manfredi R, Komminoth P, Ferone D, Hyrdel R, Kaltsas G, Kelestimur F, Kvols L, Scoazec JY, Garcia MI, Caplin ME; Frascati Consensus Conference participants. Consensus guidelines for the management of patients with digestive neuroendocrine tumours: well-differentiated colon and rectum tumour/carcinoma. Neuroendocrinology. 2008; 87(1): 31-39.�i���x��Ⅵ�j
9�j Kinoshita T, Kanehira E, Omura K, Tomori T, Yamada H. Transanal endoscopic microsurgery in the treatment of rectal carcinoid tumor. Surg Endosc. 2007; 21(6): 970-974.�i���x��Ⅴ�j
10�j ���c�@�L. �����Ǐ��؏�. �V���̊O��-��p��Z�V���[�Y4, �咰��,pp45-51, ���a�J�������[��, �X�J�dᩁ@��, �_�Y�����@�ďC�A2003, ����. �i���x��Ⅳ�j
CQ3-4-7�@����NET �̎�p�K���Əp���́H
����
����NET �Ɛf�f���邢�͋^��ꂽ�ꍇ�A�؏��p������������i�O���[�hB�j�B
�p���́A��ᇌa��Z�������ɑ����đI������悤����������i�O���[�hB�j�B
��ᇌa��2 cm �ȉ��������Ɍ��ǂ���ꍇ�A�����؏��p������������i�O���[�hB�j
��ᇌa��2 cm ���z����A���邢��1�`2 cm �ŐZ����������p�ߓ]�ڂ�����ꍇ�A�����p�ߊs���������E���؏��p�܂��͉�ӕ��؏��p������������i�O���[�hB�j�B
| ��p�K�� | ⇒�@NET �̐f�f���邢�͋^�f |
| ��ᇌa��2 cm �������Ɍ��� | ⇒�@�����؏��p |
| ��ᇌa��2 cm ���邢��1�`2 cm �ŐZ����������p�ߓ]�ڂ����� | |
| ⇒�@�����E���؏��p�܂��͉�ӕ��؏��p�{�����p�ߊs�� | |
�y�� ���z
����NET �ɑ�����������Â͕s�\�ł��邽�߁A�S�Ⴊ��p�K���ł���B�p���I���ɂ��ẮA��ᇌa��2 cm �ȉ��ŁA�������Ɍ��ǂ���Β����؏��p�ɂ�荪���\�ł���A2 cm ���z����ƃ����p�ߊs����lj����������p���K�v�ł���B�������A��ᇌa1-2 cm �̏ꍇ�ł����Ă��A�����ǂ⒎���Ԗ��ւ̐Z���A������ւ̐i�W�A�����p�ǐN�P�A�����p�ߓ]�ڂ�F�߂�ꍇ�A���邢�͑g�D�^(goblet cell/adenocarcinoid)��Ki67 �w���ɂ���Ēlj����Â̓K���ƂȂ�A�����p�ߊs�����܂ލ����p�̓K�����l������1-3)�B�����p�Ƃ́A�����E���؏��p�p�܂��͉�ӕ��؏��p���w���A�������I�����邩�ɂ��Ă̓����p�ߓ]�ڂ̉\���ɂ�茈�肳���ׂ��ł���B
�{�M�ɂ����钎��NET �́A���ĂƔ�r���Ē�p�x�ł���A�咰�J���`�m�C�h��ΏۂƂ������{�ݏǗ�W�ό����in=1,069�j�ł�2.5%�����������ł�����4)�B����NET �́A�}���������Ƃ��ċً}��p���{�s���ɁA���邢�͎{�s��ɔ��o���邱�Ƃ������ł���B�}���������Ƃ��Ď�p���s�����A��1,485��ɂ����āA����NET ��0.47���i7��j���߁A�N��̒����l��32.7 �i20�`59�j�ł�����5)�B���̂悤�ȏꍇ�A������ᇂƂ��Ă̏p���ύX�����I�����p�̓K���ɂ��āA①�p����NET�i�J���`�m�C�h�j���^�����ۂ́A���o��������J���ֈڍs����K�v�����邩�A②�����؏��p�ŏI���Ă悢���A③���o���i�⏕�j����p�͍����p�Ƃ��ċ��e����邩�A�ɂ��ĐT�d�ɍl������B①�ɂ��ẮA���K�͂Ȍ����������ɂ��ƁA�J�����邢�͕��o���������؏��Ǘ�̒Z���E�����\��͂Ƃ��ɗǍD�ł�����6)�B�{�M�ɂ����Ă����l�ɕ��o���������؏��ɂ�钎��NET �̎��×Ⴊ�������Ă���A�}���������Ƃ��ĕ��o���������؏����{�s����NET ���^�����ꍇ�ł����Ă��Aoncological resection ���\�ł���ΊJ���ڍs�����Ɋ������邱�Ƃ͑I�����Ƃ��ċ��e�����B②�ɂ��ẮA��ᇌa1 cm �ȉ��̏ꍇ�͖��ƂȂ�Ȃ����A��ᇌa1-2 cm �̒���NET �ɑ��Ē����؏��݂̂ł͕s�\���Ȃ��Ƃ�����A�O�q�̔@���؏��W�{�̕a���g�D�w�I��������lj����Âɂ��Č������ׂ��ł���B③�ɂ��ẮA�������ɑ��镠�o������p���e�F�������ߔN�̌���ƁA���o���i�⏕�j���E�������؏����邢�͉�ӕ��؏��ɂ�钎��NET �̎��×Ⴊ�������Ă���A�I�����Ƃ��ċ��e�����B
����NET �̃����p�ߓ]�ڕp�x�͑ΏۏW�c�ɂ��قȂ邪�A������ᇂ̃f�[�^�x�[�X����ɂ����ł�24-49���ł�����7-10)�B���������āA�����p�ߓ]�ڂ�L����Ǘ�ɂ����ẮA�L�͈͂��O�ꂵ�������p�ߊs����v���邱�Ƃ�����A�W����Z�ɂ��m���ȍ����p��ڎw���ׂ��ł���B
�y�� ���z
1�j Clark OH, Benson AB 3rd, Berlin JD, Choti MA, Doherty GM, Engstrom PF, Gibbs JF, Heslin MJ, Kessinger A, Kulke MH, Kvols L, Salem R, Saltz L, Shah MH, Shibata S, Strosberg JR, Yao JC; NCCN Neuroendocrine Tumors Panel Members. NCCN Clinical Practice Guidelines in Oncology: neuroendocrine tumors. J Natl Compr Canc NETw. 2009; 7(7): 712-747.�i���x��Ⅵ�j
2�jBoudreaux JP, Klimstra DS, Hassan MM, Woltering EA, Jensen RT, Goldsmith SJ, Nutting C, Bushnell DL, Caplin ME, Yao JC. The NANETS consensus guideline for the diagnosis and management of neuroendocrine tumors: well-differentiated neuroendocrine tumors of the Jejunum, Ileum, Appendix, and Cecum. Pancreas. 2010; 39(6): 753-766.�i���x��Ⅵ�j
3�jPlöckinger U, Couvelard A, Falconi M, Sundin A, Salazar R, Christ E, de Herder WW, Gross D, Knapp WH, Knigge UP, Kulke MH, Pape UF; Frascati Consensus Conference participants. Consensus guidelines for the management of patients with digestive neuroendocrine tumours: well-differentiated tumour/carcinoma of the appendix and goblet cell carcinoma. Neuroendocrinology. 2008; 87(1): 20-30.�i���x��Ⅵ�j
4�j�͓��@�m�A���r���Y. �咰�J���`�m�C�h����ѓ�����זE��(�A���P�[�g����). �����O��Y�ďC. �咰����NOW 2006, ���{���f�B�J���Z���^-, ����, pp179-185, 2006.�i���x��Ⅴ�j
5�jIn't Hof KH, van der Wal HC, Kazemier G, Lange JF. Carcinoid tumour of the appendix: an analysis of 1,485 consecutive emergency appendectomies. J Gastrointest Surgg. 2008; 12(8): 1436-1438.�i���x��Ⅴ�j
6�jBucher P, Gervaz P, Ris F, Oulhaci W, Inan I, Morel P. Laparoscopic versus open resection for appendix carcinoid. Surg Endosc. 2006; 20(6): 967-970.�i���x��Ⅳb�j
7�jMcCusker ME, Coté TR, Clegg LX, Sobin LH. Primary malignant neoplasms of the appendix: A population-based study from the surveillance, epidemiology and end-results program, 1973-1998. Cancer. 2002; 94(12): 3307-3312.�i���x��Ⅳa�j
8�jLandry CS, Woodall C, Scoggins CR, McMasters KM, Martin RC 2nd. Analysis of 900 appendiceal carcinoid tumors for a proposed predictive staging system. Arch Surg. 2008; 143(7): 664-670.�i���x��Ⅳa�j
9�jYao JC, Hassan M, Phan A, Dagohoy C, Leary C, Mares JE, Abdalla EK, Fleming JB, Vauthey JN, Rashid A, Evans DB. One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008; 26(18): 3063-3072.�i���x��Ⅴ�j
10�jMullen JT, Savarese DM. Carcinoid tumors of the appendix: a population-based study. J Surg Oncol. 2011; 104(1): 41-44. �i���x��Ⅳa�j
CQ3-5�@�]�ڂ�������NET �̎�p�K���́H
����
�摜�]���Ŏ�ᇈ�c�̂Ȃ���p���\�ł���A�����p�ߊs�����؏��p������������i�O���[�hB�j�B
�̓]�ڂ́A��ᇌ��ʌ��ʂ����҂ł���ꍇ�A�̐؏��p������������i�O���[�hC1�j�B
�摜�]���Ŏ�ᇈ�c�̂Ȃ���p���\�ł���A�x�]�ځA�����d���؏����邱�Ƃ͋��e������i�O���[�hC1�j�B
�y�� ���z
�]�ڂ�������NET �ɑ��鑽����؏��p�́A��p�N�P���ߑ�ƂȂ邱�Ƃ���A��p���X�N�Ɨ\�㉄�����ʂ�T�d�ɗ\�����������Ŕ��f���邱�Ƃ����������B��̓I�ɂ́A�����y�ѓ]�ڑ����؏��\�ȍ������^NET �ŁA���p�������ǔ������A��p�֘A���S�����T�ˑ��̏�������̍����p�Ɠ������邢�͂���ȉ��i�����ǔ�����30���ȉ��A���S��5���ȉ��j�ł��邱�ƁA�E�S�s�S���Ȃ��A���o�O�]�ځE�����d�킪�Ȃ��A�Ȃǂ�����Ă���1)�B
NET �̊̓]�ڂ͐����\��ɉe�����y�ڂ����q�ƂȂ�B�̂Ɍ��ǂ����]�ڂ̏ꍇ�A���S�؏��݂̂Ȃ炸�A90���ȏ�̎�ᇌ��ʂ͐����\���QOL�����P����\��������1-5)�B�̐؏��p���́A��U�w�I�؏��Ɍ��炸�A�����؏���l�X�ȏĎܗÖ@�̕��p���\�ł���B�܂��A�������؏��ɂ��؏��s�\�̓]�ڑ��̃R���g���[�����L���ƂȂ�\��������6)�B
���Ԗ����̑傫�ȃ����p�ߓ]�ڂ̎�舵���͒��ӂ�v����B���̂悤�ȓ]�ڑ��́A���Ԗ��̐��ې�����A���Ԗ������̒ቺ�A���ǂ̋��ȁE�ǂ̌����ƂȂ�7)�B�����؏����s����ŏd�v�Ȃ��Ƃ́A���ǖ������̖��lj�U�ɏn�m�����o���̂���O�ȃ`�[�����s���A�Z���nj�Q���������悤�ɒ��ǐ؏����ŏ����Ƃ��邱�Ƃ����������8)�B
�x�]�ڂ��ẮA���̓]�ڑ��킪�R���g���[������A�Տ��I��ᇈ�c�Ȃ��؏��\�ł���ΓK���ƂȂ�8, 9)�B�����d��ɑ��錸�ʐ؏��i�ƕ������w�Ö@�j�́A�d�푃�Ɋ֘A���������ǂ�ጸ������\��������10, 11)�B���]�ڂɑ��Ă͒ʏ�A��p�͐�������Ȃ����A�ō��]�ڂɂ��Ґ�������a�I���܂ɑ����p�͐��������11)�B
�y�� ���z
1�j Eriksson B, Klöppel G, Krenning E, Ahlman H, Plöckinger U, Wiedenmann B, Arnold R, Auernhammer C, Körner M, Rindi G, Wildi S; Frascati Consensus Conference participants. Consensus guidelines for the management of patients with digestive neuroendocrinetumors: well-differentiated jejunal-ileal tumor/carcinoma. Neuroendocrinology. 2008; 87(1): 8-19.�i���x��Ⅳ�j
2�j Steinmüller T, Kianmanesh R, Falconi M, Scarpa A, Taal B, Kwekkeboom DJ, Lopes JM, Perren A, Nikou G, Yao J, Delle Fave GF, O'Toole D; Frascati Consensus Conference participants. Consensus guidelines for the management of patients with liver metastases from digestive (neuro)endocrine tumors: foregut, midgut, hindgut, and unknown primary. Neuroendocrinology. 2008; 87(1): 47-62.�i���x��Ⅵ�j
3�j Osborne DA, Zervos EE, Strosberg J, Boe BA, Malafa M, Rosemurgy AS, Yeatman TJ, Carey L, Duhaine L, Kvols LK. Improved outcome with cytoreduction versus embolization for symptomatic hepatic metastases of carcinoid and neuroendocrine tumors. Ann Surg Oncol. 2006; 13(4): 572-581. �i���x��Ⅴ�j
4�j Sarmiento JM, Heywood G, Rubin J, Ilstrup DM, Nagorney DM, Que FG.. Surgical treatment of neuroendocrine metastases to the liver: a plea for resection to increase survival. J Am Coll Surg. 2003; 197(1): 29-37. �i���x��Ⅴ�j
5�j Musunuru S, Chen H, Rajpal S, Stephani N, McDermott JC, Holen K, Rikkers LF, Weber SM. Metastatic neuroendocrine hepatic tumors: resection improves survival. Arch Surg. 2006; 141(10): 1000-1004.�i���x��Ⅴ�j
6�j Givi B, Pommier SJ, Thompson AK, Diggs BS, Pommier RF. Operative resection of primary carcinoid neoplasms in patients with liver metastases yields significantly better survival. Surgery. 2006; 140(6): 891-897.�i���x��Ⅴ�j
7�j Boudreaux JP, Klimstra DS, Hassan MM, Woltering EA, Jensen RT, Goldsmith SJ, Nutting C, Bushnell DL, Caplin ME, Yao JC. The NANETS consensus guideline for the diagnosis and management of neuroendocrine tumors: well-differentiated neuroendocrine tumors of the Jejunum, Ileum, Appendix, and Cecum. Pancreas. 2010; 39(6): 753-766.�i���x��Ⅵ�j
8�j Clark OH, Benson AB 3rd, Berlin JD, Choti MA, Doherty GM, Engstrom PF, Gibbs JF, Heslin MJ, Kessinger A, Kulke MH, Kvols L, Salem R, Saltz L, Shah MH, Shibata S, Strosberg JR, Yao JC; NCCN Neuroendocrine Tumors Panel Members. NCCN Clinical Practice Guidelines in Oncology: neuroendocrine tumors. J Natl Compr Canc Netw. 2009; 7(7): 712-747.�i���x��Ⅵ�j
9�j Kos-Kudła B, O'Toole D, Falconi M, Gross D, Klöppel G, Sundin A, Ramage J, Oberg K, Wiedenmann B, Komminoth P, Van Custem E, Mallath M, Papotti M, Caplin M; Palma de Mallorca Consensus Conference Participants. ENETS consensus guidelines for the management of bone and lung metastases from neuroendocrine tumors. Neuroendocrinology. 2010; 91(4): 341-350.�i���x��Ⅵ�j
10�j Elias D, Sideris L, Liberale G, Ducreux M, Malka D, Lasser P, Duvillard P, Baudin E. Surgical treatment of peritoneal carcinomatosis from well-differentiated digestive endocrine carcinomas.Surgery. 2005; 137(4): 411-416.�i���x��Ⅴ�j
11�j Kianmanesh R, Ruszniewski P, Rindi G, Kwekkeboom D, Pape UF, Kulke M, Sevilla Garcia I, Scoazec JY, Nilsson O, Fazio N, Lesurtel M, Chen YJ, Eriksson B, Cioppi F, O'Toole D, Palma de Mallorca Consensus Conference Participants. ENETS consensus guidelines for the management of peritoneal carcinomatosis from neuroendocrine tumors. Neuroendocrinology. 2010; 91(4): 333-340.�i���x��Ⅵ�j
CQ3-6�@������NET �̋Ǐ��Ĕ��a���̎�p�K���́H
����
�摜�]���ɂĎ�ᇈ�c�̂Ȃ���p���\�ł���A�؏��p������������i�O���[�hC1�j�B
���ʐ؏��p�ɂ��Ǐ�ɘa�����҂ł���ꍇ�A�؏��p������������i�O���[�hC1�j�B
�����ǕǏǏ�ɑ��ẮA�Ǐ���P��ړI�Ƃ�����p������������i�O���[�hC1�j�B
�y�� ���z
������NET �̍Ĕ��a���ɑ����p�K���͌���I�ł���B�Ǘ��E�U�ݐ��̊́E�x�]�ځA���o�������p�ߓ]�ڑ��ɑ��鍪����p�ɂ��ẮA�ǍD��PS �̊��҂ɂ����đ�����̓]�ڑ����R���g���[������A�Տ��I��ᇈ�c�̂Ȃ��p�����Ă��\�ł���ꍇ�Ɍ���K���ƂȂ�1)�B
�z�������Ǐ���ᇂɂ��Ǐ��Ǐ�i�����Nj���E�ǁA�אڑ���ւ̈��r�j�ɑ��錸�ʎ�p���{�s�����ŁA�����̗Տ��Ǐ�i���ɁA�z�������ߕ���ɂ��Ǐ�)�����P������ɂ́A90���ȏ�̎�ᇗʌ��ʂ��K�v�ł���1)�B�����d��⌴�����ɂ�鏔�Ǐ�i����̈��r�A����A�ǁj�ɑ��A�����Ǖǂ̉����QOL �̉��P��ړI�Ƃ��ď����ǃo�C�p�X�A�d�푃�؏��A�l�H���E��ᑑ��݂Ȃǂ̓K�����������邱�Ƃ͏d�v�ł���2, 3)�B
�y�� ���z
1�j Clark OH, Benson AB 3rd, Berlin JD, Choti MA, Doherty GM, Engstrom PF, Gibbs JF, Heslin MJ, Kessinger A, Kulke MH, Kvols L, Salem R, Saltz L, Shah MH, Shibata S, Strosberg JR, Yao JC; NCCN Neuroendocrine Tumors Panel Members. NCCN Clinical Practice Guidelines in Oncology: neuroendocrine tumors. J Natl Compr Canc NET w. 2009; 7(7): 712-747.�i���x��Ⅵ�j
2�j Elias D, Sideris L, Liberale G, Ducreux M, Malka D, Lasser P, Duvillard P, Baudin E. Surgical treatment of peritoneal carcinomatosis from well-differentiated digestive endocrine carcinomas. Surgery. 2005; 137(4): 411-416.�i���x��Ⅴ�j
3�j Kianmanesh R, Ruszniewski P, Rindi G, Kwekkeboom D, Pape UF, Kulke M, Sevilla Garcia I, Scoazec JY, Nilsson O, Fazio N, Lesurtel M, Chen YJ, Eriksson B, Cioppi F, O'Toole D; Palma de Mallorca Consensus Conference Participants. ENETS consensus guidelines for the management of peritoneal carcinomatosis from neuroendocrine tumors.Neuroendocrinology. 2010; 91(4): 333-340.�i���x��Ⅵ�j
CQ3-7�@�X�E������NET �̐��������p��o�ߊώ@�@�́H
����
����I�Ȑf�@�ɂ��Ǐ�̊ώ@�ƁA�摜�����E�z���������肪����������i�O���[�hB�j�B
�y�� ���z
��ᇃ}�[�J�[����Ɖ摜�f�f���Ĕ�����ɗL�p�ł���1, 2)�B�L�p�Ȏ�ᇃ}�[�J�[�́ANET �̎�ނɂ���ĈقȂ�3)�B�X�@�\��NET �ł́A���ٓI�ɕ��傪���i���Ă���z�������i�C���X�����A�K�X�g�����A�O���J�S���AVIP�j���L�p�ł���A���ɃK�X�g���m�[�}�ɂ�����������K�X�g�����l�ƃZ�N���`���������́A�摜�f�f���������ɍĔ���f�f�ł���3, 4)�BNET �̎�ނ��킸�A�ł��L�p�ƍl�����Ă���̂͌����N�����O���j��A ����ł���3, 5, 6)���A�㒰�R����NET �ł͏㏸���Ȃ����Ƃ�����6)�B�܂��A����NSE ����͒ᕪ���^��ᇂ̎�ᇃ}�[�J�[�Ƃ��ėL�p�ł���3)�B��ᇃ}�[�J�[�̑���́A3 ���������]�܂���1)�B
�Ĕ����̓���ɗL�p�ȉ摜�f�f�ɂ��ẮACQ1-5���Q�ƁB�摜�f�f�́A�p����̎����܂ł�6 �������ƁA���̌��1 �N���Ƃ̎{�s�����������1)�B�����Ԍo�ߌ�̍Ĕ������蓾�邽�߁A���Ȃ��Ƃ�10 �N�Ԃ̃t�H���[�A�b�v���]�܂���1)�B
�K�X�g���m�[�}�Ǘ�ł́A�����؏��ɂ�茌���K�X�g�����Z�x�����퉻���������r�I�����ɂ킽���Ĉݎ_���嘴�i���������邽�߁A�p�O������p�ʂ̎_����}���܂̎g�p���K�v�ƂȂ�7)�B
�y�� ���z
1�j Kimura W, Tezuka K, Hirai I. Surgical management of pancreatic neuroendocrine tumors. Surg Today. 2011; 41(10): 1332-1343.�i���x��Ⅳb�j
2�j Gibril F, Reynolds JC, Doppman JL, Chen CC, Venzon DJ, Termanini B, Weber HC, Stewart CA, Jensen RT. Somatostatin receptor scintigraphy: its sensitivity compared with that of other imaging methods in detecting primary and metastatic gastrinomas. A prospective study. Ann Intern Med. 1996; 125(1): 26-34.�i���x��Ⅳb�j
3�j Oberg K, Janson ET, Eriksson B. Tumour markers in neuroendocrine tumours. Ital J Gastroenterol Hepatol. 1999; 31 Suppl 2: S160-162.�i���x��Ⅳb�j
4�j Fishbeyn VA, Norton JA, Benya RV, Pisegna JR, Venzon DJ, Metz DC, Jensen RT. Assessment and prediction of long-term cure in patients with the Zollinger-Ellison syndrome: the best approach. Ann Intern Med. 1993; 119(3): 199-206.�i���x��Ⅳb�j
5�j Nobels FR, Kwekkeboom DJ, Coopmans W, Schoenmakers CH, Lindemans J, De Herder WW, Krenning EP, Bouillon R, Lamberts SW. Chromogranin A as serum marker for neuroendocrine neoplasia: comparison with neuron-specific enolase and the alpha-subunit of glycoprotein hormones. J Clin Endocrinol Metab. 1997; 82(8): 2622-2628.�i���x��Ⅳb�j
6�j Arnold R, Wilke A, Rinke A, Mayer C, Kann PH, Klose KJ, Scherag A, Hahmann M, Müller HH, Barth P. Plasma chromogranin A as marker for survival in patients with metastatic endocrine gastroenteropancreatic tumors. Clin Gastroenterol Hepatol. 2008; 6(7): 820-827.�i���x��Ⅳb�j
7�j Pisegna JR, Norton JA, Slimak GG, Metz DC, Maton PN, Gardner JD, Jensen RT. Effect of curative gastrinoma resection on gastric acid secretary function and antisecretory drug requirement in the Zollinger-Ellison syndrome. Gastroenterology. 1992; 102(3): 767-778..�i���x��Ⅳa�j
���Ȏ��ÁE�W�w�I����
�܂�����
�X�E������NET �ɑ��鎡�Âɂ����ẮA��ᇂ̋@�\���A�i�B�x�A�]�ڂ̗L���𐳊m�ɕ]�����A��ᇂ̕����x����ш����x�ɍ��킹�����Â��K�v�ł���B�O�ȓI�؏��ɂ�鎡����ڎw���̂��W���ł��邪�A�؏��s�\��ł́A��ᇑ��B��}���������\������P�����邱�ƂƁA�Տ��Ǐ�̉��P�̗�����ړI�Ƃ������Â��K�v�ł���B�{���ڂł͓��������ÁA������Ǐ�ɑ���Ö@�A�R��ᇖ�Ö@�A�؏��s�\�̓]�ڂɑ���Ǐ��Ö@�A�W�w�I���Â���ѕ��ː��Ö@�ɂ��Ă�CQ �ɑ��鐄������щ�����L�ڂ��Ă���B�XNET �ɑ�����������Â͎{�s����Ă��Ȃ��̂ŏ�����NET �݂̂̋L�ڂł���B�������A�����ɑ�����������ÂɊւ��Ă͑S���G�r�f���X���Ȃ��L�ڂ��Ă��Ȃ��B���ɁA�X�������NET �ɑ���R��ᇖ�Ɋւ��āA�{�M�ł͉��w�Ö@�͖����R���Z���T�X���Ȃ��A�ی��K���O���W�������w�ǂł���B����A��ᇕ��q�����w�̔��W�ɂ���āA�V�K���q�W�I��̃G�x�������X�ƃX�j�`�j�u����K�͗Տ������ŗL�p���������Ă���B
CQ4-1�@������NET �ɑ���������I���Â̓K������ѐ���������Z�͉����H
CQ4-1-1�@��NET �ɑ���������I���Â̓K������ѐ���������Z�͉����H
����
Rindi ����Ⅰ�^�AⅡ�^�Ŏ�ᇃT�C�Y1 cm �ȉ��A��5 �ȉ��A�[�B�x��sm �܂łɎ~�܂��NET �͓������I���Â�����������i�O���[�hB�j�B��NET �ɑ���������I���ÂƂ��Đ��������̂́A�z���@�A2 �`�����l���@�Ȃǂ̓������I�S���؏��p�iEMR�j�ł����i�O���[�hB�j�B
�y�� ���z
��NET �̎��ÂɊւ��ẮA�G�r�f���X�����Ȃ��A�܂��R���Z���T�X�������Ă��Ȃ��BRindi ����Ⅰ�^��Ⅱ�^�͈����x���Ⴍ�������I���Â̓K���ƂȂ蓾�邪�AⅢ�^�͈����x��������{�I�ɓK���ƂȂ�Ȃ�1)�B��ʓI�ɁAⅠ�AⅡ�^�Ŏ�ᇃT�C�Y1 cm �ȉ��A����5 �ȉ��A�[�B�xsm �Ȑ�ł���A�������I�؏��p���s����2)�B��NET �ɂ����Ă͔S���a�ς͏��Ȃ��A���������Â̓K���ƂȂ�a�ς̑����͐[�B�xsm �ł��邽�߁A�؏��f�[�A�������㏸������ړI�ŁA�z���@3)��2 �`�����l���@4)�ɂ��EMR ���s���Ă���A�L�p�ł���B�������I�S�����w�����p�iESD�j���L�p�ł��鎖���\�z����邪�A����܂ł̕͏Ǘ�⏭����̏Ǘ�W�ςɂƂǂ܂��Ă���A�܂��\���ȃG�r�f���X�������Ă��Ȃ��B
�y�� ���z
1�j Rindi G, Luinetti O, Cornaggia M, Capella C, Solcia E. Three subtypes of gastric argyrophil carcinoid and the gastric neuroendocrine carcinoma: a clinicopathologic study. Gastroenterology. 1993; 104(4): 994-1006.�i���x��Ⅴ�j
2�j Ichikawa J, Tanabe S, Koizumi W, Kida Y, Imaizumi H, Kida M, Saigenji K, Mitomi H. Endoscopic mucosal resection in the management of gastric carcinoid tumors. Endoscopy. 2003; 35(3): 203-206. �i���x��Ⅴ�j
3�j Hopper AD, Bourke MJ, Hourigan LF, Tran K, Moss A and Swan MP. En-bloc resection of multiple type 1 gastric carcinoid tumors by endoscopic multi-band mucosectomy. J Gastroenterol Hepatol. 2009; 24(9): 1516-1521.�i���x��Ⅴ�j
4�j Higashino K, Iishi H, Narahara H, Uedo N, Yano H, Ishiguro S and Tatsuta M. Endoscopic resection with a two-channel videoendoscope for gastric carcinoid tumors. Hepatogastroenterology. 2004; 51(55): 269-272.�i���x��Ⅴ�j
�R����
��Rindi ���ށ�
Rindi ��1)�́A��NET ����b�����A���K�X�g�������ǂ̗L������ȉ���3 �^�ɕ��ނ��Ă���A��ᇂ̈����x��Տ��o�߂Ƃ悭���ւ��邽�߁A�ėp����Ă���B
| �^�C�v | ��b���� | ���K�X�g�������� | �����x |
| Ⅰ | ���ȖƉu���݉��iA �^�݉��j | �L | �� |
| Ⅱ | Zollinger-Ellison �nj�Q�iMEN1 �j | �L | �� |
| Ⅲ | �U���� | �� | �� |
Ⅰ�^�͎��ȖƉu���݉��iA �^�݉��j�AⅡ�^��Zollinger-Ellison �nj�Q����b�����Ƃ�����̂ŁA���K�X�g�������ǂ��B�ݒ�B��ECL �זE�����̑��B���q�ł���K�X�g�����h���̑����ɂ���ᇉ��������̂ŁA�����ɂ̓K�X�g�����ɔ������̏�Ԃ����݂���ƍl������B�ݒ�B�̈��1 cm �ȉ��ő������邱�Ƃ������A�����x�͒Ⴂ�B����Ⅰ�^�͒ʏ�A�ǐ��̌o�߂������B
Ⅲ�^�͊�b������Ȃ��U����ł���A���K�X�g�������ǂ�Ȃ��B�ʏ�A�P���ł���A������1 cm �ȏ�ł��邱�Ƃ������ł���B�ݑ̕��݂̂ł͂Ȃ��O�땔�ɂ���������B�����x�͍����A�����p�ߓ]�ځA�̓]�ڂ𗈂��m���������B
�y�� ���z
1�j Rindi G, Luinetti O, Cornaggia M, Capella C, Solcia E. Three subtypes of gastric argyrophil carcinoid and the gastric neuroendocrine carcinoma: a clinicopathologic study. Gastroenterology. 1993; 104(4): 994-1006.�i���x��Ⅳb�j
CQ4-1-2�@ �\��w��NET �ɑ���������I���Â̓K������ѐ���������Z�͉����H
����
��ᇃT�C�Y1 cm �ȉ��A�[�B�x��sm �܂łɎ~�܂�\��w��NET �ɑ��ē������I���Â��s���鎖�����邪�A�����I�i�K�ł����i�O���[�hB�j�B�\��w��NET �ɑ���������I���ÂƂ��Đ��������̂́A�������I�S���؏��p�iEMR�j�ł����i�O���[�hB�j�B
�y�� ���z
�\��w��NET �̎��ÂɊւ��ẮA�G�r�f���X�����Ȃ��A�܂��R���Z���T�X�������Ă��Ȃ��B��ʓI�ɁA��ᇃT�C�Y1 cm �ȉ��A�[�B�xsm�ł���A�]�ڗ�����r�I�Ⴂ����1)�A�������I�؏��p���s���{�݂�������2, 3)�B���ɁA�\��w���K�X�g���m�[�}�̃����p�ߓ]�ڗ���60%����A�J����p�ɂ�郊���p�ߊs���͌������Ȃ�4)�B
�y�� ���z
1�j Soga J. Early-stage carcinoids of the gastrointestinal tract. An analysis of 1914 reported cases. Cancer. 2005; 103(8): 1587-1595.�i���x��Ⅴ�j
2�j Yoshikane H, Goto H, Niwa Y, Matsui M, Ohashi S, Suzuki T, Hamajima E, Hayakawa T. Endoscopic resection of small duodenal carcinoid tumors with strip biopsy technique. Gastrointest Endosc. 1998; 47(6): 466-470. �i���x��Ⅴ�j
3�j Dalenbäck J, Havel G. Local endoscopic removal of duodenal carcinoid tumors. Endoscopy 2004; 36(7): 651-655.�i���x��Ⅴ�j
4�j Gibril F, Libutti SK, Norton JA, White DE, Jensen RT, Alexander HR. Management and outcome of patients with sporadic gastrinoma arising in the duodenum. Ann Surg. 2003; 238(1): 42-48.�i���x��Ⅳa�j
CQ4-1-3�@ ����NET �ɑ���������I���Â̓K������ѐ���������Z�͉����H
����
��ᇃT�C�Y1 cm �ȉ��A�[�B�x��sm �܂łɎ~�܂钼��NET �͓������I���Â�����������i�O���[�hB�j�B
����NET �ɑ���������I���ÂƂ��Đ��������̂́A�z���@�A2 �`�����l���@�Ȃǂ̓������I�S���؏��p(EMR)�A�������I�S�����w�����p�iESD�j����ьo���I���������}�C�N���T�[�W�����[�iTEM�j�ł����i�O���[�hB�j�B
�y�� ���z
�����x�̎w�W�Ƃ��Ď�ᇌa�A�ŗL�ؑw�ւ̐Z���A���S���E��ᇌ`���A���ǐN�P�A�j�������AKi67 �w�����l�Ȃǂ���������1-3)�B��ᇌa1 cm �ȉ��A�[�B�x��sm �ɂƂǂ܂�A���S���E��ᇌ`����F�߂Ȃ���ᇂ͓]�ڗ����Ⴍ�AEUS ��CT �Ȃǂ̉摜�f�f�Ń����p�ߓ]�ځA���u�]�ڂ̏�����F�߂Ȃ��ꍇ�A�ʏ�A�������I���Â̓K���Ƃ����4, 5)�B�؏��W�{�̕a���g�D�w�I�f�f�Ŗ��ǐN�P�A�����̊j�������AKi67 �w�����l����F�߂�ꍇ�́A�]�ڂ̃��X�N������2, 3)�lj����Â̌������s���B
������NET �͔������ɔS�����ɂƂǂ܂��Ă��邱�Ƃ͏��Ȃ��A�������I���Â̓K���ƂȂ�a�ς̑����͐[�B�xsm �ł���B�ʏ�̓������I�|���y�N�g�~�[��EMR �ł͐؏��f�[���z���ƂȂ�\���������B���̂���EMR �ł��z���@(�H���Ö�ᎎ��×pligation device ��p����ESMR-L ��A��������[�ɑ��������L���b�v���ɋz������EMR-C �Ȃ�)��2 �`�����l���@�ȂǁA�؏��@�ɍH�v���Ȃ���Ă���4)�B�܂��AESD �̐��т��ǍD�ŁA���ꂼ��ʏ�̃|���y�N�g�~�[��EMR �Ɣ�ׂėL�ӂɍ����؏��f�[�A����������Ă���6-9)�B�Ȃ��A2012 �N4 ���ɑ咰ESD �͑����咰���A�咰�B��ɑ��ĕی��K�p�ƂȂ��Ă���B
TEM ������NET �̋Ǐ��؏��@�Ƃ��āA���ɋ߈ʑ������̎�ᇂɑ�����S�Œ�N�P�Ȏ��Ö@�ł���BEMR ��̈�c�Ǘ���܂߂āA�����؏��f�[�A����������Ă���10)�B
�y�� ���z
1�j Soga J. Carcinoids of the rectum: An evaluation of 1271 reported cases. Surg Today. 1997; 27(2): 112-119.�i���x��Ⅴ�j
2�j �≺�����C�������i�C�r�c�\�S�C�Óc���Y�C�A�ؕq���C���@�G�C�㓈�����C�������j�C���R���C�I������D�����J���`�m�C�h��ᇂ̗Տ��a���w�I�����D�݂ƒ�. 2005; 40(2): 151-162. �i���x��Ⅳb�j
3�j Hotta K, Shimoda T, Nakanishi Y, Saito D. Usefulness of Ki67 for predinting the metastatic potential of rectal carcinoids. Pathol Int. 2006; 56(10): 591-596.�i���x��Ⅳa�j
4�j ashimo Y, Matsuda T, Uraoka T, Saito Y, Sano Y, Fu K, Kozu T, Ono A, Fujii T, Saito D. Endoscopic submucosal resection with a ligation device is an effective and safe treatment for carcinoid tumors in the lower rectum. J Gastroenterol Hepatol. 2008; 23(2): 218-221.�i���x��Ⅴ�j
5�j Park CH, Cheon JH, Kim JO, Shin JE, Jang BI, Shin SJ, Jeen YT, Lee SH, Ji JS, Han DS, Jung SA, Park DI, Baek IH, Kim SH, Chang DK. Criteria for decision making after endoscopic resection of well-differentiated rectal carcinoids with regard to potential lymphatic spread. Endoscopy. 2011; 43(9): 790-795.�i���x��Ⅳb�j
6�j Ono A, Fujii T, Saito Y, Matsuda T, Lee DTY, Gotoda T, Saito D. Endoscopic submucosal resection of rectal carcinoid tumors with a ligation device. Gastrointest Endosc. 2003; 57(4): 583-587.�i���x��Ⅳa�j
7�j Sakata H, Iwakiri R, Ootani A, Tsunada S, Ogata S, Ootani H, Shimoda R, Yamaguchi K, Sakata Y, Amemori S, Mannen K, Mizoguchi M, Fujimoto K. A pilot randomized control study to evaluate endoscopic resection using a ligation device for rectal carcinoid tumors. World J Gastroenterol. 2006; 12(25): 4026-4028.�i���x��Ⅱ�j
8�j Zhou PH, Yao LQ, Qin XY, Xu MD, Zhong YS, Chen WF, Ma LL, Zhang YQ, Qin WZ, Cai MY, Ji Y. Advantages of endoscopic submucosal dissection with needle-knife over endoscopic mucosal resection for small rectal carcinoid tumors: A retrospective study. Surg Endosc. 2010; 24(10): 2607-2612.�i���x��Ⅳa�j
9�j Lee DS, Jeon SW, Park SY, Jung MK, Cho CM, Tak WY, Kweon YO, Kim SK. The feasibility of endoscopic submucosal dissection for rectal carcinoid tumors: Comparison with endoscopic mucosal resection. Endoscopy 2010; 42: 647-651.�i���x��Ⅳa�j
10�j Kinoshita T, Kanehira E, Omura K, Tomori T, Yamada H. Transanal endoscopic microsurgery in the treatment of rectal carcinoid tumor. Surg Endosc. 2007; 21(6): 970-974.�i���x��Ⅴ�j
CQ4-2�@�X�E������NET �̓�����Ǐ�ɑ��Đ����������Â͉����H
����
�X�E������NET �̓�����Ǐ�̎��Âɂ́A�\�}�g�X�^�`���A�i���O�ƁA���̑��̖Ö@������������i�O���[�hA�j�B
�y�� ���z
- �X�E������NET �̓�����Ǐ�̊ɘa�ɂ̓\�}�g�X�^�`���A�i���O�����������1, 2)�B�L�����͎����ɂ���ĈقȂ�B�C���X���m�[�}�ŁA�\�}�g�X�^�`���A�i���O�̃C���X�����}�����ア�ꍇ�́A�O���J�S���Ȃǂ̝h�R�z�������̕����}���邽�ߋp���Ēጌ�������������邱�Ƃ�����̂Œ��ӂ��K�v�ł���3�j�B
- �K�X�g���m�[�}�ɂ���������ᇂ̎��ÁA�����Ȃǂ̓�����Ǐ�ɑ��Ă͍��p�ʂ�PPI �����������4)�B
- VIP �I�[�}�ɂ��}���ȉ����ɂ��E���Ǐ�ɑ��āA�d�����t�̑�ʂ̕�t�����������5)�B
- �C���X���m�[�}�ɂ��}�����ጌ���ɑ��č��Z�x�̃u�h�E����[���L���ł��邪�A�ጌ������̕p�x�̗}���ɃW�A�]�L�V�h6)��G�x�������X7)���L���Ȏ�������B
- �O���J�S�m�[�}�ɂ��V�������g���ɃA�~�m�_�Ǝ��b�_�̒���I�A�����L���ł���8)�B
- �J���`�m�C�h�nj�Q�̉����ɑ��ă��y���~�h�Ȃǂ̎~���L���ł���B������Ǐ�ɑ��ăI���_���Z�g�����̗L�p��������Ă���i���̖ړI�ł͖{�M�����F�j9)�B�J���`�m�C�h�N���[�[����p�A�����A�����A��ᇂ̐G�f�A�X�g���X�Ȃǂɂ���Ĉ����N������邱�Ƃ�����A���̍ۂ͌������܂̗A���ƃ\�}�g�X�^�`���A�i���O�ɂ�鎡�Â����������10)�A��p�▃���A������\�肵�Ă���J���`�m�C�h�nj�Q���҂ɂ̓\�}�g�X�^�`���A�i���O�̏p�O�g�p�����������10)�B
�y�� ���z
1�j Maton PN, Gardner JD, Jensen RT. Use of long-acting somatostatin analog SMS 201-995 in patients with pancreatic islet cell tumors. Dig Dis Sci. 1989; 34(3 Suppl): 28S-39S.�i���x��Ⅴ�j.
2�j Kvols LK, Moertel CG, O'Connell MJ, Schutt AJ, Rubin J, Hahn RG. Treatment of the malignant carcinoid syndrome. Evaluation of a long-acting somatostatin analogue. N Engl J Med. 1986; 315(11): 663-666.�i���x��Ⅴ�j.
3�j Stehouwer CD, Lems WF, Fischer HR, Hackeng WH, Naafs MA. Aggravation of hypoglycemia in insulinoma patients by the long-acting somatostatin analogue octreotide (Sandostatin). Acta Endocrinol (Copenh). 1989; 121(1): 34-40.�i���x��Ⅴ�j
4�j Maton PN, Vinayek R, Frucht H, McArthur KA, Miller LS, Saeed ZA, Gardner JD, Jensen RT. Long-term efficacy and safety of omeprazole in patients with Zollinger-Ellison syndrome: a prospective study. Gastroenterology. 1989; 97(4):827-836.�i���x��Ⅴ�j.
5�j O'Dorisio TM, Mekhjian HS, Gaginella TS, Medical therapy of VIPomas. Endocrinol Metab Clin North Am. 1989; 18(2): 545-556.�i���x��Ⅵ�j
6�j Gill GV, Rauf O, MacFarlane IA. Diazoxide treatment for insulinoma: a national UK survey. Postgrad Med J. 1997; 73(864): 640-641.�i���x��Ⅴ�j
7�j Kulke MH, Bergsland EK, Yao JC. Glycemic control in patients with insulinoma treated with everolimus. N Engl J Med. 2009; 360(2): 195-197.�i���x��Ⅴ�j
8�j Alexander EK, Robinson M, Staniec M, Dluhy RG. Peripheral amino acid and fatty acid infusion for the treatment of necrolytic migratory erythema in the glucagonoma syndrome. Clin Endocrinol (Oxf). 2002; 57(6): 827-831.�i���x��Ⅴ�j
9�j Wymenga AN, de Vries EG, Leijsma MK, Kema IP, Kleibeuker JH. Effects of ondansetron on gastrointestinal symptoms in carcinoid syndrome. Eur J Cancer. 1998; 34(8): 1293-1294.�i���x��Ⅵ�j
10�j Oberg K, Kvols L, Caplin M, Delle Fave G, de Herder W, Rindi G, Ruszniewski P, Woltering EA, Wiedenmann B. Consensus report on the use of somatostatin analogs for the management of neuroendocrine tumors of the gastroenteropancreatic system. Ann Oncol. 2004; 15(6): 966-973.�i���x��Ⅵ�j
CQ4-3�@�XNET �ɑ��Đ��������R��ᇖ�͉����H
CQ4-3-1�@�XNET�iG1/G2�j�ɑ��Đ��������R��ᇖ�͉����H
����
�G�x�������X�܂��̓X�j�`�j�u������������i�O���[�hB�j�B�X�g���v�g�]�V����p�������w�Ö@���I������1 �ł����i�O���[�hC1�j�B
�y�� ���z
�XNET�iG1/G2�j�ɑ���R��ᇌ��ʂ�ڎw�����S�g���ẤA�؏��s�\��̂��������܂��͗Տ��I�Ɏ�ᇗʂ������Ɣ��f�����ꍇ�ɂ����ēK���ƂȂ�BNET G1/G2 �͐��N�ȏ�̌o�߂ɂ����Ď�ᇑ��傪�����Ȃ��ǗႪ�܂܂�Ă��邽�߁A�R��ᇌ��ʂ�ڎw�����S�g���ẤA��ᇑ��傪���炩�ȗ��A��ᇂ��L�͂ɑ��݂���ᇑ��傪�N����Ƒ���@�\����ɂ�����鋰��̂���Ⴊ�K���ƂȂ�B�����_������r�����ł͍ŋ߃G�x�������X1)�A�X�j�`�j�u2)�A�������I�`�h�i�ی������F�j3)�����ꂼ��v���Z�{�Ɣ�r���āA�L�ӂȖ������������Ԃ̉����������Ă���B�X�g���v�g�]�V���{�h�L�\���r�V���i�h�L�\���r�V���͕ی������F�j4)�����̎��Ã��W�����ɔ�ׂėL�ӂȐ������ԉ����������Ă��邪�A1990 �N�㏉���̌����ł���A�Տ������̃N�I���e�B�Ɋւ��錜�O���w�E����Ă���B�������A�X�g���v�g�]�V���͒P�Ɠ��^�̍�����U�����������{����Ă���A�䂪���ł��ی����F�������Ă���B���̑��̍R���܁i�_�J���o�W��5�j�A�e���]���~�h�}�J�y�V�^�r��6)�Ȃǁj�A�C���^�[�t�F����7)�Ȃǂ����̍R��ᇌ��ʂ�����Ă���i��������ی������F�j���A�XNET ��ΏۂƂ��������_������r�����͂̕Ȃ��B
| �Ǘᐔ | �������������� | �������� | �ҁA�N | |||
|---|---|---|---|---|---|---|
| �����l�i���j | p�l | �����l�i���j | p�l | |||
| Chlorozotocin | 33 | 18 | <0.003*1 | Moertel C; 1992 | ||
| Streptozocin + 5-FU | 33 | 16.8 | <0.004*2 | |||
| Streptozocin + Doxorubicin | 36 | 26.4 | ||||
| Sunitinib | 86 | 11.4 | <0.01 | 0.02*3 | Raymond E; 2011 | |
| Placebo | 85 | 5.5 | ||||
| Evelorimus | 207 | 11.0 | <0.01 | 0.564 | Yao JC; 2011 | |
| Placebo | 203 | 4.6 | ||||
| Lanreotide | 101 | NR | <0.01 | Caplin ME; 2014��4 | ||
| Placebo | 103 | 18.0 | ||||
��1 Streptozocin + Doxorubicin vs. Chlorozotocin
��2 Streptozocin + Doxorubicin vs. Streptozocin + 5-FU
��3 Sunitinib vs. Placebo �͘_�����\��̒ǐՒ����ł͐������Ԃɂ��Ă̗L�Ӌ`�͏������Ă���B
��4 �{�����ɂ��X�ȊO�ɒ����A�㒰�A�����s����NET ���܂܂�Ă���B
�y�� ���z
1�j Yao JC, Shah MH, Ito T, Bohas CL, Wolin EM, Van Cutsem E, Hobday TJ, Okusaka T, Capdevila J, de Vries EG, Tomassetti P, Pavel ME, Hoosen S, Haas T, Lincy J, Lebwohl D, Öberg K�GRAD001 in Advanced Neuroendocrine Tumors, Third Trial�iRADIANT-3�jStudy Group. Everolimus for advanced pancreatic neuroendocrine tumors. N Engl J Med. 2011�G364�i6�j�F514-523.�i���x��Ⅱ�j
2�j Raymond E, Dahan L, Raoul JL, Bang YJ, Borbath I, Lombard-Bohas C, Valle J, Metrakos P, Smith D, Vinik A, Chen JS, HÖrsch D, Hammel P, Wiedenmann B, Van Cutsem E, Patyna S, Lu DR, Blanckmeister C, Chao R, Ruszniewski P. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. N Engl J Med. 2011�G364�i6�j�F501-513�i.�i���x��Ⅱ�j
3�j Caplin ME, Pavel M, Ćwikła JB, Phan AT, Raderer M, Sedláčková E, Cadiot G, Wolin EM, Capdevila J, Wall L, Rindi G, Langley A, Martinez S, Blumberg J, Ruszniewski P�GCLARINET Investigators. Lanreotide in metastatic enteropancreatic neuroendocrine tumors. N Engl J Med. 2014�G371�i3�j�F224-233.�i���x��Ⅱ�j
4�j Moertel CG, Lefkopoulo M, Lipsitz S, Hahn RG, Klaassen D. Streptozocin-doxorubicin, streptozocin-fluorouracil or chlorozotocin in the treatment of advanced islet-cell carcinoma. N Engl J Med. 1992�G326�i8�j�F 519-523.�i���x��Ⅱ�j
5�j Ramanathan RK, Cnaan A, Hahn RG, Carbone PP, Haller DG. Phase II trial of dacarbazine�iDTIC�jin advanced pancreatic islet cell carcinoma. Study of the Eastern Cooperative Oncology Group-E6282. Ann Oncol. 2001�G12�i8�j�F1139-1143.�i���x��Ⅲ�j
6�j Strosberg JR, Fine RL, Choi J, Nasir A, Coppola D, Chen DT, Helm J, Kvols L. First-line chemotherapy with capecitabine and temozolomide in patients with metastatic pancreatic endocrine carcinomas. Cancer. 2011�G117�i2�j�F268-275.�i���x��Ⅲ�j
7�j Bajetta E, Zilembo N, Di Bartolomeo M, Di Leo A, Pilotti S, Bochicchio AM, Castellani R, Buzzoni R, Celio L, Dogliotti L, et al. Treatment of metastatic carcinoids and other neuroendocrine tumors with recombinant interferon-alpha-2a. A study by the Italian Trials in Medical Oncology Group. Cancer. 1993�G72�i10�j�F3099-3105.�i���x��Ⅲ�j
CQ4-3-2�@�XNEC�iG3�j�ɑ��Đ��������R��ᇖ�͉����H
����
���זE�x���̎��Âɏ����C�������܂��x�[�X�Ƃ��镹�p�Ö@������������i�O���[�hC1�j�B
�y�� ���z
�@�a���w�I�E�Տ��I�ɗގ��ł��鏬�זE�x���ł̃G�r�f���X�ɏ����A�������܂��x�[�X�Ƃ������p�Ö@�i�G�g�|�V�h�{�V�X�v���`��1�j�A�C���m�e�J���{�V�X�v���`��2)�F��������ی������F�j���p�����A�����t������������Ă��邪�A�����_������r�����͎��{����Ă��Ȃ��B
| �������� | �Ǘᐔ | �t�����i���j | �������Ԓ����l�i���j | �ҁA�N |
|---|---|---|---|---|
| �����ǁE�X | 18 | 67 | 19 | Moertel CG; 1991 |
| �����ǁE�X | 41 | 42 | 15 | Mitry E; 1999 |
| �X | 3 | 67 | NA | Fjällskog ML; 2001 |
| �̑��E�_���E�X | 21 | 14 | 5.8 | Iwasa S; 2010 |
NA; �]���s�\
| �������� | �Ǘᐔ | �t�����i���j | �������Ԓ����l�i���j | �ҁA�N |
|---|---|---|---|---|
| �����ǁE�X* | 15 | 7 | 11 | Kulke MH; 2006 |
| �����ǁE�X | 19 | 58 | NA | Mani MA 2008 |
��NET G1/G2 ���܂�
NA; �]���s�\
�y�� ���z
1�j Fjällskog ML, Granberg DP, Welin SL, Eriksson C, Oberg KE, Janson ET, Eriksson BK. Treatment with cisplatin and etoposide in patients with neuroendocrine tumors. Cancer. 2001�G92�i5�j�F1101-1107�i.�i���x��Ⅲ�j
2�j Kulke MH, Wu B, Ryan DP, Enzinger PC, Zhu AX, Clark JW, Earle CC, Michelini A, Fuchs CS. A phase Ⅱtrial of irinotecan and cisplatin in patients with metastatic neuroendocrine tumors. Dig Dis Sci. 2006�G51�i6�j�F1033-1038.�i���x��Ⅳa�j
| CQ4-4-1 | ������NET�iG1/G2�j�ɑ��Đ��������R��ᇖ�͉����H �� G1/G2 �Ɍ��� |
����
������NET�iG1/G2�j�ɑ��Ă̓I�N�g���I�`�h������������i�O���[�hB�j�B
������ NET�iG1/G2�j�ɑ��đ��̎��ÑI�������Ȃ��ꍇ�ɂ́A�X�g���v�g�]�V����p�������w�Ö@���I������1 �ł����i�O���[�hC1�j�B
�y�� ���z
������NET �ɑ��鎡�Ö@��I������ۂɂ́A�g�D�w�Igrade�A�̓]�ڂ̒��x�A������Ǐ�̗L���A���҂̑S�g��ԁA�g�p�\�Ȏ��Ö@�Ȃǂ��猩�������I�Ȕ��f���K�v�ł�1)�B
- 1�j�\�}�g�X�^�`���A�i���O�Ö@
�\�}�g�X�^�`���A�i���O�̃I�N�g���I�`�h��NET �̓�����Ǐ�����P����ړI�ŗp�����Ă����iCQ4-2 ���Q�Ɓj�B2009 �N�ɒ����R���̓]�ڐ��������^NET ���҂�ΏۂɑO����������v���Z�{�ΏƓ�d�ӌ������ɂ��I�N�g���I�`�hLAR �̍R��ᇌ��ʂ��������ꂽ�iPROMID �����j2)�BTTP�iTime to Tumor Progression�j�̒����l�̓I�N�g���I�`�hLAR �Q��14.3 �J���A�v���Z�{�Q��6.0 �J���ƃI�N�g���I�`�hLAR �Q�ɂėL�ӂȉ�����F�߂��B�R��ᇌ��ʂ͊̎�ᇗʂ�10���ȉ��̏Ǘ�A�������̐؏���ōł������F�߂��A�@�\���E��@�\���̕ʁA�����N�����O���j��A �l�APS ��N��ɂ͊��Ȃ����Ƃ������ꂽ�B�{�M�ł�������NET �ɃI�N�g���I�`�hLAR ���ی����F���ꂽ�B
- 2�j������NET�iG1/G2�j�ɑ���S�g���w�Ö@
�S�g���w�Ö@�́A�t�������Ⴍ�A�L�ӂȖ������������Ԃ�S�������Ԃɑ�����ʂ���������r�����͂Ȃ��i�\1�j3-5)�B�������A�S�g���w�Ö@�ɂ���Ď�ᇏk����������ǗႪ����A�u�����������A���A���̎��ÑI�������Ȃ��ꍇ�v�ɂ͑I������1 �Ƃ��Č�������K�v������ƍl������B
�C�O�ł̓t�b���s���~�W�����܁A�X�g���v�g�]�V���A�_�J���o�W���A�e���]���~�h�Ȃǂ��p�����Ă���B5-FU �͌Â�����X�g���v�g�]�V���ƕ��p����A��r�I����20�`30���O��̑t������������Ă���3-5)�B�ŋ߂̕ł́A5-FU�{�h�L�\���r�V�� vs. 5-FU�{�X�g���v�g�]�V���̔�r����5)������B�t�����͂������16���ƍ����Ȃ��A�������������Ԃ�4.5 �J��vs. 5.3 �J���ł��������A�S�������Ԃł�5-FU�{�X�g���v�g�]�V���Q�̕����ǍD�ł������ƕ���Ă���B�ŋ߁A�X�g���v�g�]�V���P�Ɠ��^�̍�����Ⅱ�����������{����A�䂪���ł��ی����F�������Ă���B
�l�X�ȑ���R����NET �ɑ��āA�J�y�V�^�r���ƃI�L�T���v���`�����p�����i�J���`�m�C�h�nj�Q���Ǘ�ɂ̓I�N�g���I�`�h�p���j���s��ꂽ6)�BLow-grade �Q�in��27�j�ɑ��đt����30���ATTP 20 �J���Ȃǂ̗ǍD�Ȑ��т�������6)�i�ی������F�j�BS-1 ��NET �ɑ���O�����̗Տ������͂̕Ȃ��A������NET �ɑ���Q���V�^�r���̌��ʂ��s���ł���B�܂��A�_�J���o�W��5)�A�e���]���~�h7)�����ڂ���Ă��邪�A�e���]���~�h�ƃT���h�}�C�h�Ƃ̕��p�����ɂ����āA�X�R����NET �ł͑t����45���ł��������A���̃J���`�m�C�h�ł�7���ɂ����Ȃ������ƕ���Ă���8)�B
| �N | �Ώ� | ���W���� | �Ǘᐔ | �t���� | mPFS | MST | ���� |
| 1979 | �J���`�m�C�h | 5-FU + STZ 5-FU + CPA |
42 47 |
33% 27% |
- - |
27 �T 46 �T |
3 |
| 1984 | �J���`�m�C�h | DOX 5-FU + STZ |
81 80 |
21% 22% |
6.5 ���� 8 ���� |
12 ���� 16 ���� |
4 | 2005 | �J���`�m�C�h | 5-FU + DOX 5-FU + STZ |
25 27 |
16% 15.9% |
4.5 ���� 5.3 ���� |
15.7 ���� 24.3 ���� |
5 |
�y�� ���z
1�j NCCN Guideline for Treatment of Cancer by Site.
http://www.nccn.org/professionals/physician_gls/f_guidelines.asp�i���x��Ⅵ�j
2�j Rinke A, Müller HH, Schade-Brittinger C, Klose KJ, Barth P, Wied M, Mayer C, Aminossadati B, Pape UF, Bläker M, Harder J, Arnold C, Gress T, Arnold R�GPROMID Study Group. Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors�Fa report from the PROMID Study Group. J Clin Oncol. 2009�G27�i28�j�F4656-4663�i.�i���x��Ⅱ�j
3�j Moertel CG, Hanley JA. Combination chemotherapy trials in metastatic carcinoid tumor and the malignant carcinoid syndrome. Cancer Clin Trials. 1979�G2�i4�j�F327-334.�i���x��Ⅱ�j
4�j Engstrom PF, Lavin PT, Moertel CG, Folsch E, Douglass HO Jr. Streptozocin plus fluorouracil versus doxorubicin therapy for metastatic carcinoid tumor. J Clin Oncol. 1984�G2�i11�j�F1255-1259.�i���x��Ⅲ�j
5�j Sun W, Lipsitz S, Catalano P, Mailliard JA, Haller DG�GEastern Cooperative Oncology Group. Phase Ⅱ/Ⅲ study of doxorubicin with fluorouracil compared with streptozocin with fluorouracil or dacarbazine in the treatment of advanced carcinoid tumors�FEastern Cooperative Oncology Group Study E1281. J Clin Oncol. 2005�G23�i22�j�F4897-4904.�i���x��Ⅱ�j
6�j Bajetta E, Catena L, Procopio G, De Dosso S, Bichisao E, Ferrari L, Martinetti A, Platania M, Verzoni E, Formisano B, Bajetta R. Are capecitabine and oxaliplatin�iXELOX�jsuitable treatments for progressing lowgrade and high-grade neuroendocrine tumours? Cancer Chemother Pharmacol. 2007�G59�i5�j�F637-642.�i���x��Ⅴ�j
7�j Ekeblad S, Sundin A, Janson ET, Welin S, Granberg D, Kindmark H, Dunder K, Kozlovacki G, Orlefors H, Sigurd M, Oberg K, Eriksson B, Skogseid B. Temozolomide as monotherapy is effective in treatment of advanced malignant neuroendocrine tumors. Clin Cancer Res. 2007�G13�i10�j�F2986-2991.�i���x��Ⅴ�j
8�j Kulke MH, Stuart K, Enzinger PC, Ryan DP, Clark JW, Muzikansky A, Vincitore M, Michelini A, Fuchs CS. Phase Ⅱ study of temozolomide and thalidomide in patients with metastatic neuroendocrine tumors. J Clin Oncol. 2006�G24�i3�j�F401-406.�i���x��Ⅴ�j
CQ4-4-2�@������NEC�iG3�j�ɑ��Đ��������R��ᇖ�͉����H
����
������NEC�iG3�j�ɑ��Ă͏��זE�x���̎��Âɏ����A�������܂��x�[�X�Ƃ��镹�p�Ö@�����ÑI�����ƂȂ��i�O���[�hC1�j�B
�y�� ���z
������NEC �́A���ɉ��u�]�ڂ��ꍇ�ɂ͋ɂ߂ė\��s�ǂł���A���זE�x���ɏ��������Ð헪���Ƃ邱�Ƃ����������BNEC �ɑ��Ă͔������܂��܂ޕ��p�Ö@����{�ł��邪�A���E�I�ɂ̓V�X�v���`���{�G�g�|�V�h���p�����邱�Ƃ������i�ی������F�j1)�B�{�M�ł͏��זE�x���ɑ��ăV�X�v���`���{�C���m�e�J�����V�X�v���`���{�G�g�|�V�h�����D�z�������������Ƃ��2)�A�V�X�v���`���{�C���m�e�J�����p�����邱�Ƃ����Ȃ��Ȃ��i�ی������F�j�B�{�M�ł̑��{�����̌����������ɂ��A������NEC 142 ��ɑ���V�X�v���`���{�C���m�e�J���ɂ���đt����51���A�������������Ԃ̒����l5.4 �J���A�S�������Ԃ̒����l13.4�J���ƕ���Ă���3)�B
����ɂ́A�^�L�T���n�̖�܂�lj�����3 �ܕ��p�Ö@�i�J���{�v���`���{�G�g�|�V�h�{�p�N���^�L�Z���j�ł́A�t����53���A�������������Ԃ̒����l7.5 �J���A�S�������Ԃ̒����l14.5 �J���ƕ���Ă��邪�A�{�M�ł�3 �܂̐����p�ʂ͊m�肵�Ă��Ȃ�4)�B���זE�x���Ɠ��l��NEC �͉��w�Ö@�̊��͍���������̎��Âł������t�����������邪�A�����������邱�Ƃ͋ɂ߂ċH�ł���A������̎�ᇐi�W���x�͑����\��s�ǂł���B���������L���ȓ��Â͂Ȃ��B
| �N | �Ώ� | ���W���� | �Ǘᐔ | �t���� | mPFS | MST | ���� |
| 1999 | NEC | CDDP + VP-16 | 41 | 42% | 9 ���� | 15 ���� | 9 | 2006 | NEC | CBDCA + VP-16 + PTX | 78 | 53% | 7.5 ���� | 14.5 ���� | 12 |
CDDP�F�V�X�v���`�� CBDCA�F�J���{�v���`�� VP-16�F�G�g�|�V�h�A
PTX�F�p�N���^�L�Z��
�y�� ���z
1�j Mitty E, Baudlin E, Ducreux M, Sabourin JC, Rufie P, Aparicio T, Lasse P, Elias D, Duvillard P, Schlumberger M, Rougier P. Treatment of poorly differentiated neuroendocrine tumours with etoposide and cisplatin. Br J Cancer. 1999�G81�i8�j�F1351-1355�i.�i���x��Ⅴ�j
2�j Noda K, Nishiwaki Y, Kawahara M, Negoro S, Sugiura T, Yokoyama A, Fukuoka M, Mori K, Watanabe K, Tamura T, Yamamoto S, Saijo N�GJapan Clinical Oncology Group. Irinotecan plus cisplatin compared with etoposide plus cisplatin for extensive small-cell lung cancer. N Engl J Med. 2002�G346�i2�j�F85-91.�i���x��Ⅱ�j
3�j Yamaguchi T, Machida N, Morizane C, Kasuga A, Takahashi H, Sudo K, Nishina T, Tobimatsu K, Ishido K, Furuse J, Boku N, Okusaka T. Multicenter retrospective analysis of systemic chemotherapy for advanced neuroendocrine carcinoma of the digestive system. Cancer Sci. 2014�G105�i9�j�F1176-1181.�i���x��Ⅴ�j
4�j Hainsworth JD, Spigel DR, Litchy S, Greco FA. Phase Ⅱ trial of paclitaxel, carboplatin, and etoposide in advanced poorly differentiated neuroendocrine carcinoma�Fa Minnie Pearl Cancer Research Network Study. J Clin Oncol. 2006�G24�i22�j�F3548-3554�i.�i���x��Ⅴ�j
CQ4-5�@�X�E������NET �̐؏��s�\�̓]�ڂɑ��Đ��������Ǐ��Ö@�͉����H
����
TAE �����TACE ���A����ᇗʂ̊̓]�ڂ̋Ǐ����ÂƂ��Đ���������i�O���[�hC1�j�B�܂��A�؏��s�\�̊̓]�ڑ���L���邪�A���������Ă���ꍇ�ɂ́A��ᇏĎp������������i�O���[�hC1�j�B
�y�� ���z
NET �̊̓]�ڂ��u�ɂ��ᇐZ���ɂ��Ǐ�A�������͓�����ǏF�߂���܂ŋC�t����Ȃ����Ƃ������A�̓]�ڂ����Ǘ��80-90���͐f�f���A���Ɏ����؏�������ł���B�X�E������NET ��QOL ��5 �N�������̌���ɂ͊̓]�ڑ��̐��䂪�d�v�ł���A������Ǐ�̃R���g���[���ɂ���^����1, 2)�B
NET �̊̓]�ڂ͌������L�x�ł���A��ᇂւ̌�����90%�ȏ�̓������狟������Ă���A�̍זE���Ɠ��l��TAE ��TACE ��NET �̊̓]�ځi���ɍ���ᇗʁj�̋Ǐ����ÂƂ��ėL�p�ł���3, 4�j�B�喬��ᇍǐ��╠���̑��݂͓����Â̐ϋɓI�ȓK���Ƃ��Ȃ��B���p���̍R���������^�͏��Ȃ��Ƃ�3���Ԃ͊̔^ᇂ̌`���\�h�ړI�ɍs�����Ƃ����������5)�BTAE �̏Ǐ�ɘa���ʂɂ��ẮA�����I�ɉ��P�����Ǘ���܂߂��90����response ������A���ʂ�6-27 �����������ATACE �ł͏Ǐ�ɘa���ʂ�50-90���̏Ǘ�ŔF�߂��A6-53 ������������ƕ���Ă���3)�BTAE�ATACE ���TTP �͏����nj������܂�NET ��12-24 �J���A�XNET ��10-19 �J���BTAE ��̐������Ɋւ���͗l�X��5 �N��������0-71���i�����l50%�j�A�������Ԓ����l��20-80 �J���ƕ�������B����ANEC ��TAE ��̐������Ԃ�15 �J���Ƃ̕�����BTACE ���5 ������40-80%�A�������Ԓ����l��32-50 �J���ƕ���Ă���3, 6, 7)�B�J���`�m�C�h�nj�Q��������NET �ł͍ǐ��p����p����ɃJ���`�m�C�h�N���[�[���������Ⴊ����A�p�O�̃\�}�g�X�^�`���A�i���O�̓��^���d�v�ł���B
�؏��s�\�̊̓]�ڑ���L���邪�A���������Ă���Ǘ�ł́A��ᇏĎ܂��L�p�Ȃ��Ƃ�����1, 2, 8)�B���ۂɂ́A�Ďܖ@�ɂ̓��W�I�g�Ďp�iRFA�j���p�����邱�Ƃ������A�o��I�������͊J����/���o�����Ɏ{�s�����8)�BRFA �ɓK������ᇃT�C�Y�ɂ��Ă�3 cm ���\����K�肷��d�v�Ȉ��q�Ƃ���Ă���8-10)�B�܂��A��ᇃT�C�Y����3 cm, 3-5 cm, ��5 cm �̊e�Q�ɂ�����RFA ��̋Ǐ��Ĕ����r����Ɓ�3 cm �Q���L�ӂɒႩ����11)�BNET �̓]�ڑ��ɑ��镠�o����RFA�́A��ᇂ����t�ɂ킽��14 �ȉ��̌��Ŏ�ᇑ��{�����[�����S�̂�20%�ȉ��ɂƂǂ܂��Ă��銳�҂��ǂ��K���Ƃ��������10)�B
NET �̓]�ڑ��ւ̒P�Ǝ��ÂƂ��Ă̊̓������w�Ö@�͋̕H�ŁANCCN12)�����ENETS13�j�K �C�h���C���ł��R���܂̊̓����Ö@�ɂ��Ă̋L�ڂ͂Ȃ��B�ŋ߁A5-FU �̊̓����Ö@���s���A���̌�TACE ��g�ݍ��킹�������14)�B
�y�� ���z
1�j Madoff DC, Gupta S, Ahrar K, Murthy R, Yao JC. Update on the management of neuroendocrine hepatic metastases. J Vasc Interv Radiol. 2006; 17(8): 1235-1249.�i���x��Ⅳb�j
2�j Ramage JK, Davies AH, Ardill J, Bax N, Caplin M, Grossman A, Hawkins R, McNicol AM, Reed N, Sutton R, Thakker R, Aylwin S, Breen D, Britton K, Buchanan K, Corrie P, Gillams A, Lewington V, McCance D, Meeran K, Watkinson A; UKNETwork for Neuroendocrine Tumours. Guidelines for the management of gastroenteropancreatic neuroendocrine (including carcinoid) tumours. Gut. 2005; 54 Suppl 4: iv1-16.�i���x��Ⅵ�j
3�j Vogl TJ, Naguib NN, Zangos S, Eichler K, Hedayati A, Nour-Eldin NE. Liver metastases of neuroendocrine carcinomas: interventional treatment via transarterial embolization, chemoembolization and thermal ablation. Eur J Radiol. 2009; 72(3): 517-528.�i���x��Ⅳb�j
4�j Abood GJ, Go A, Malhotra D, Shoup M. The surgical and systemic management of neuroendocrine tumors of the pancreas. Surg Clin North Am. 2009; 89(1): 249-266.�i���x��Ⅵ�j
5�j Kvols LK, Turaga KK, Strosberg J, Choi J. Role of interventional radiology in the treatment of patients with neuroendocrine metastases in the liver. J Natl Compr Canc Netw. 2009; 7(7): 765-772.�i���x��Ⅵ�j
6�j Knigge U, Hansen CP, Stadil F. Interventional treatment of neuroendocrine liver metastases. Surgeon. 2008; 6(4): 232-239.�i���x��Ⅵ�j
7�j Gupta S, Johnson MM, Murthy R, Ahrar K, Wallace MJ, Madoff DC, McRae SE, Hicks ME, Rao S, Vauthey JN, Ajani JA, Yao JC. Hepatic arterial embolization and chemoembolization for the treatment of patients with metastatic neuroendocrine tumors: variables affecting response rates and survival. Cancer. 2005; 104(8): 1590-1602.�i���x��Ⅳa�j
8�j Lewis MA, Hubbard J. Multimodal Liver-directed management of neuroendocrine hepatic metastases. Int J Hepatol. 2011; 452343.�i���x��Ⅵ�j
9�j Mazzaglia PJ, Berber E, Milas M, Siperstein AE. Laparoscopic radiofrequency ablation of neuroendocrine liver metastases: a 10-year experience evaluating predictors of survival. Surgery. 2007; 142(1): 10-19.�i���x��Ⅴ�j
10�j Karabulut K, Akyildiz HY, Lance C, Aucejo F, McLennan G, Agcaoglu O, Siperstein A, Berber E. Multimodality treatment of neuroendocrine liver metastases. Surgery. 2011; 150(2): 316-325.�i���x��Ⅳb�j
11�j Mulier S, Jamart J, Ruers T, Marchal G, Michel L. Local recurrence after hepatic radiofrequency coagulation: multivariate meta-analysis and review of contribute factors. Ann Surg. 2005; 242(2): 158-171.�i���x��Ⅳb�j
12�j NCCN clinical practice guidelines in Oncology (NCCN guidelinesTM). Neuroendocrine tumors, Version I. 2011. NCCN.org. National Comprehensive Cancer Network, Inc. 2011.�i���x��Ⅵ�j
13�j Steinmuller T, Kianmanesh R, Falconi M, Scarpa A, Taal B, Kwekkeboom DJ, Lopes JM, Perren A, Nikou G, Yao JC, Fave D, O�fToole D, and all other Frascati Consensus Conference participants. Consensus Guidelines for the Management of Patients with Liver Metastases from Digestive (Neuro)endocrine Tumors: Foregut, Midgut, Hindgut, and Unknown Primary. Neuroendocrinology. 2008; 87(1): 47-62.�i���x��Ⅵ�j
14�j Christante D, Pommier S, Givi B, Pommier R. Hepatic artery chemoinfusion with chemoembolization for neuroendocrine cancer with progressive hepatic metastases despite octreotide therapy. Surgery. 2008; 144(6): 885-93.�i���x��Ⅳb�j
CQ4-6�@�X�E������NET �i�����s�����܂ށj�ɑ���W�w�I���Â͉���?
����
��ᇌ��ʎ�p�ɂ��Ǐ��\��̉��P�������߂�ꍇ�A���邢�͏����ǁE�_���ʉߏ�Q�ɑ���o�C�p�X�p�̓K��������ꍇ�ɂ́A�O�Ȉ�Ƃ̘A�g�ɂ��W�w�I���Â�����������i�O���[�hC1�j�B
�y�� ���z
�X�E������NET �̊̓]�ڂ͐����\��ɉe�����y�ڂ����q�ł���1)�A���̑������؏��s�\�����̓]�ڂŔ��������B�������̉�͂ł͂��邪�A���S�؏��s�\�̓]�ڂɑ��錸�ʎ�p���܂ޏW�w�I���Â̗L����������Ă���2-8)�B���̍ہA90���ȏ�̎�ᇌ��ʂ��]�߂�ꍇ�Ɋ̐؏��p��RFA �ɂ�錸�ʎ�p�̓K��������Əq�ׂĂ�����̂�����4-6)�iCQ3-5�ACQ3-6���Q�Ɓj�B�؏��s�\�Ǐ��i�sNET ���邢�͔d��a�ςɂ������ǒʉߏ�Q��ǐ����t������ꍇ�ɂ́A�����ǐ؏��p��o�C�p�X�p�A�_���o�C�p�X�p�A�l�H��呢�݂Ȃǂ��l������9, 10)�B
�؏��s�\�]�ڑ�������\�Ǝv�����X�E������NET �ł́A��������؏��������������\�����������Ƃ̕����邪7, 8)�A�X�؏��Ȃǂ͐N�P���傫�������Ǘ����������߁A�������؏��p�Ɋւ��Ă͌������̕��ʂ⊳�҂̑S�g��ԁA���҂����\��Ȃǂ��l��������ŁA�T�d�ɓK�������肷��K�v������B
�]�ڐ��]��ᇂɑ��ČƑ��I�؏��p����ː����Â��K���ƂȂ�ꍇ������8, 11, 12)�iCQ4-8���Q�Ɓj�B�]�ڐ�����ᇂ���p�K���ƂȂ邱�Ƃ͂قƂ�ǂȂ����A���J���V�E�����ǂɑ���r�X�t�H�X�t�H�l�[�g�̓��^�A�u�ɃR���g���[����a�I���ܗ\�h��ړI�Ƃ������ː����ÂȂǂ��l������12)�iCQ4-8���Q�Ɓj�B
�y�� ���z
1�j Madeiral I, Terris B, Voss M, Denys A, SauvaNET A, Flejou JF, Vilgrain V, Belghiti J, Bernades P, Ruszniewski P. Prognostic factors in patients with endocrine tumours of theduodenopancreatic area. Gut. 1998; 43(3): 422-427.�i���x��Ⅳb�j
2�j Touzios JG, Kiely JM, Pitt SC, Rilling WS, Quebbeman EJ, Wilson SD, Pitt HA. Neuroendocrine hepatic metastasis: does aggressive management improve survival? Ann Surg. 2005; 241(5): 776-785.�i���x��Ⅳb�j
3�j Hodul P, Malafa M, Choi J, Kvols L. The role of cytoreductive hepatic surgery as an adjunct to the management of metastatic neuroendocrine carcinomas. Cancer Control. 2006; 13(1): 61-71.�i���x��Ⅳb�j
4�j Boudreaux JP, Klimstra DS, Hassan MM, Woltering EA, Jensen RT, Goldsmith SJ, Nutting C, Bushnell DL, Caplin ME, Yao JC. The NANETS consensus guideline for the diagnosis and the management of neuroendocrine tumors. Well-differentiated neuroendocrine tumors of the jejunum, ileum, appendix and cecum. Pancreas. 2010; 39(6): 753-766.�i���x��Ⅵ�j
5�j Metz DC, Jensen RT. Gastrointestinal neuroendocrine tumos: Pancreatic endocrine tumors. Gastroenterology. 2008; 135(5): 1469-1492.�i���x��Ⅵ�j
6�j Steinmuller T, Kianmanesh R, Falconi M, Scarpa A, Taal B, Kwekkeboom DJ, Lopes JM, Perren A, Nikou G, Yao J, Delle Fave GF, O'Toole D, all other Frascati Consensus Conference participants. Consensus guidelines for the management of patients with liver metastases from digestive (neuro)endocrine tumors: forgut, midgut, hindgut, and unknown primary. Neuroendocrinology. 2008; 87(1): 47-62.�i���x��Ⅵ�j
7�j Givi B, Pommier SJ, Thompson AK, Diggs BS, Pommier RF. Operative resection of primary carcinoid neoplasms in patients with liver metastases yields significantly better survival. Surgery 2006; 140(6): 891-897.�i���x��Ⅴ�j
8�j Yao KA, Talamonti MS, Nemcek A, Angelos P, Chrisman H, Skarda J, Benson AB, Rao S, Joehl RJ. Indications and results of liver resection and hepatic chemoemblization for metastatic gastrointestinal neuroendocrine tumors. Surgery. 2001; 130(4): 677-682.�i���x��Ⅳb�j
9�j Kianmanesh R, Ruszniewski P, Rindi G, Kwekkeboom D, Pape UF, Kulke M, Sevilla Garcia I, Scoazec JY, Nilsson O, Fazio N, Lesurtel M, Chen YJ, Eriksson B, Cioppi F, O�fToole D, Palma de Mallorca Consensus Conference Participants. ENETS consensus guidelines for the management of peritoneal carcinomatosis from neuroendocrine tumors. Neuroendocrinology. 2010; 91(4): 333-340.�i���x��Ⅵ�j
10�j Elias D, Sideris L, Liberale G, Ducreux M, Malka D, Lasser P, Duvillard P, Baudin E. Surgical treatment of peritoneal carcinomatosis from well-differentiated digestive endocrine carcinomas. Surgery. 2005; 137(4): 411-416.�i���x��Ⅳb�j
11�j Kos-Kudla B, O'Toole D, Falconi M, Gross D, Klöppel G, Sundin A, Ramage J, Oberg K, Wiedenmann B, Komminoth P, Van Custem E, Mallath M, Papotti M, Caplin M, Palma de Mallorca Consensus Conference Participants. ENETS consensus guidelines for the management of bone and lung metastases from neuroendocrine tumors. Neuroendocrinology. 2010; 91(4): 341-350.�i���x��Ⅵ�j
12�j Pavel M, Grossman A, Arnold R, Perren A, Kaltsas G, Steinmüller T, de Herder W, Nikou G, Plöckinger U, Lopes JM, Sasano H, Buscombe J, Lind P, O'Toole D, Oberg K; Palma de Mallorca Consensus Conference Participants. ENETS consensus guidelines for the management of brain, cardiac and ovarian metastases from neuroendocrine tumors. Neuroendcocrinology. 2010; 91(4): 326-332.�i���x��Ⅵ�j
CQ4-7�@�X�E������NET �ɑ���R0 ��p��̖E���ː��Ö@�͐�������邩?
����
�X�E������NET�iG1/G2�j�ɑ���R0 ��p���s��ꂽ�ꍇ�̗\��͗ǍD�ł���A�p��Ö@�͐�������Ȃ��i�O���[�hC2�j�B
�X�E������NEC�iG3�j�ɑ��ẮA���זE�x���̃��W�����ɏ������p��Ö@����ː����Â��s�����Ƃ�����������i�O���[�hC1�j�B
�y�� ���z
NET �ɑ���R0 ��p���s��ꂽ�ꍇ�̗\��͗ǍD�ł���A�p��Ö@�͈�ʓI�ɂ͍s���Ă��Ȃ��B�p��Ö@�Ɋւ���Տ��������Ȃ��A���ẴK�C�h���C���ł��p��Ö@�͐�������Ă��Ȃ�1-4)�B
����ANEC �͈����x���ɂ߂č����AR0 ��p���s���Ă������ɍĔ����邽�߁A���זE�x���ɏ����ăV�X�v���`�����x�[�X�Ƃ������p���w�Ö@����������Ă��邪�A����̃��W�����͌��܂��Ă��Ȃ�2-8)�B���̑��Ƀt���I���E���V����Q���V�^�r���A�\�}�g�X�^�`���A�i���O���p��Ö@�Ƃ��ėp�����Ǘ���U�������B�܂��A���ẴK�C�h���C���ł́A�Ǐ��Ĕ�������������NEC �ɑ��ďp�㉻�w�Ö@�ƂƂ��ɕ��ː����Â𐄏����Ă��邪2-4)�A�G�r�f���X�͂Ȃ��A�����������ʂ����߂��Ă��Ȃ��B
�p�O���w�Ö@��̓]�ڑ�R0 �؏���̊̓����ǐ��E���w�Ö@�̌��ʂ����҂���ӌ������邪�A�G�r�f���X�͂Ȃ�3)�B
�y�� ���z
1�j Boudreaux JP, Klimstra DS, Hassan MM, Woltering EA, Jensen RT, Goldsmith SJ, Nutting C, Bushnell DL, Caplin ME, Yao JC. The NANETS consensus guideline for the diagnosis and the management of neuroendocrine tumors. Well-differentiated neuroendocrine tumors of the jejunum, ileum, appendix and cecum. Pancreas. 2010; 39(6): 753-766.�i���x��Ⅵ�j
2�j Strosberg JR, Coppola D, Klimstra DS, Phan AT, Kulke MH, Wiseman GA, Kvols LK. The NANETS consensus guidelines for the diagnosis and the management of poorly differentiated (high-grade) extrapulmonary neuroendocrine carcinomas. Pancreas. 2010; 39(6):799-800.�i���x��Ⅵ�j
3�j Bajetta E, Procopio G, Ferrari L, Catena L, Vecchio MD, Bombardieri E. Update on the treatment of neuroendocrine tumors. Expert Rev Anticancer Ther. 2003; 3(5): 631-642.�i���x��Ⅵ�j
4�j NCCN clinical practice guidelines in Oncology (NCCN guidelinesTM). Neuroendocrine tumors, Version I. 2011. NCCN.org. National Comprehensive Cancer NET work, Inc. 2011.�i���x��Ⅵ�j
5�j Moertel CG, Kvols LK, O�fConnell MJ, Rubin J. Treatment of neuroendocrine carcinomas with combined etoposide and cisplatin. Evidence of major therapeutic activity in the anaplastic variants of these neoplasms. Cancer. 1991; 68(2): 227-232.�i���x��Ⅴ�j
6�j Mitty E, Baudlin E, Ducreux M, Sabourin JC, Rufie P, Aparicio T, Lasse P, Elias D, Duvillard P, Schlumberger M, Rougier P. Treatment of poorly differentiated neuroendocrine tumours with etoposide and cisplatin. Br J Cancer. 1999; 81(8): 1351-1355.�i���x��Ⅴ�j
7�j Fjallskog MLH, Granberg DPK, Welin SLV, Eriksson C, Oberg KE, Janson ET, Eriksson BK. Treatment with cisplatin and etoposide in patients with neuroendocrine tumors. Cancer. 2001; 92(5): 1101-1107.�i���x��Ⅴ�j
8�j Kulke MH, Wu B, Ryan DP, Enzinger PC, Zhu AX, Clark JW, Earle CC, Michelini A, Fuchs CS. A phase Ⅱ trial of irinotecan and cisplatin in patients with metastatic neuroendocrine tumors. Dig Dis Sci.2006; 51(6): 1033-1038.�i���x��Ⅳa�j
CQ4-8�@�X�E������NET �ɑ��ĕ��ː����Â͐�������邩�H
����
�������ɑ���O�Ǝˎ��Âɂ��ẮA�����ł��邾���̏\���ȃG�r�f���X���Ȃ��i�O���[�hC2�j�B
���]�ڂɑ����u�Ɋɘa�ړI�̊O�Ǝ˂�����������i�O���[�hA�j�B���V���`�z���̑������]�ڂɑ�89Sr �ɂ���u�Ɋɘa�ړI�̓��Ǝ˂�����������i�O���[�hB�j�B
�y�� ���z
- 1�j�O�Ǝ�
�������ɑ���O�Ǝˎ��Âɂ��ẮA�L�p�����x�����鏭���̕�1)�͂��邪�A���ꂪ�\������P�����邩�ۂ��ɂ��ẲȊw�I�����͕s�\���ł���A�����ł��閾�m�ȍ������Ȃ��B
- 2�j���]�ڂɑ���O�ƎˁA89Sr �ɂ����Ǝ�
�X�E������NET ����̍��]�ڂ݂̂ɑ����u�Ɋɘa�ɂ��Ă̂܂Ƃ܂����͂Ȃ����A���]�ڂɑ����u�Ɋɘa�ړI�̕��ː����ẤA�����̌Ō`���ɂėL������������Ă���B���ː����Â��u�Ɋɘa�Ɋւ��Ă̗L������75-90%�ƍ����A8Gy/1 ��ƎˁA20Gy/5 �����A30Gy/10 �����A35Gy/14 �����Ƃ����������̐��ʕ������L���ł���2-6)�B�������A1 ��Ǝ˂ƕ����Ǝ˂ł́A���𗦂⊮�S���𗦂ɍ��������Ȃ����A1 ��Ǝ˂ɂ����ē��ꕔ�ʂւ̍ďƎ˗����������Ƃ������̃��^�A�i���V�X�ň�v���Ă��邽��6-8)�A�\��\���Ɋ�Â������ʁA���ʕ����̑I�����K�v�ł���B
���ː����ʌ��f��89Sr �͑��������]�ڕa���݂̂Ȃ炸�A�����^���邢�͗n�������]�ڕa���̎��͂ɑ��݂��鍜�`�����ʂɂ��W�ς��A���o�������������ӂ̍זE���Ǝ˂���B�u�Ɋɘa��40������95%�ƍ����A�O�Ǝ˂ł͑Ή�������ȑ������]�ڂ��u�Ɋɘa��A�Ґ����ʂ̐������Ȃ����ߊO�Ǝˌ�̍��]�ڂȂǂɓ��ɗL�p�ł���9)�B
- 3�jPeptide receptor radionuclide therapy�iPRRT�j
�X�E�����ǗR����NET��SSTR�������ɔ������Ă��邱�Ƃ���A�\�}�g�X�^�`���A�i���O�ɕ��ː����ʌ��f��W��������܂�p����PRRT ���J������Ă����B�C�O�ɂ����ẮA[90Y-DOTA0, Tyr3] -Octreotide10-14)��[177Lu-DOTA0, Tyr3]-Octreotate15),16)�Ȃǂ�p���������̑�Ⅰ�������A��Ⅱ�������ɂėǍD�ȍR��ᇌ��ʁi�\1�j�A�����QOL�̉��P������Ă��邪�A�����Ƀ����_������r�����͂Ȃ��B�킪���ɂ����ẮA���ː����ʌ��f�ɑ���@�I�K���̖�������A�����_�ł͗Տ��������܂߂Ďg�p����Ă��Ȃ��B
�\1 �� �g�p�j�� �Ǘᐔ CR PR SD CR + PR�i���j Valkema 10) [90Y-DOTA0, Tyr3]-Octreotide 58 0 5
(9%)36
(62%)9 Imhof 11) [90Y-DOTA0, Tyr3]-Octreotide 1109 7
(0.6%)371
(33.5%)34.1 Forrer 12) [90Y-DOTA0, Tyr3]-Octreotide 116 5
(4%)26
(23%)72
(62%)27 Waldherr 13) [90Y-DOTA0, Tyr3]-Octreotide 39 2
(5%)7
(18%)27
(69%)23 Swärd 15) [177Lu-DOTA0, Tyr3]-Octreotate 16 0 6
(38%)8
(50%�j38 Kwekkeboom 16) [177Lu-DOTA0, Tyr3]-Octreotate 310 5
(2%)86
(28%)158
(51%)30
�y�� ���z
1�j Contessa JN, Griffith KA, Wolff E, Ensminger W, Zalupski M, Lawrence TS, Ben-Josef E. Radiotherapy for pancreatic neuroendocrine tumors. Int J Radiat Oncol Biol Phys. 2009; 75(4): 1196-1200. �i���x��Ⅳb�j
2�j Anderson PR, Coia LR. Fractionation and outcomes with palliative radiation therapy. Semin Radiat Oncol. 2000(3); 10: 191-199.�i���x��Ⅵ�j
3�j Ratanatharathorn V, Powers WE, Moss WT, Perez CA. Bone metastasis: review and critical analysis of random allocation trials of local field treatment. Int J Radiat Oncol Biol Phys. 1999; 44(1): 1-18.�i���x��Ⅰ�j
4�j Rose CM, Kagan AR. The final report of the expert panel for the radiation oncology bone metastasis work group of the American College of Radiology. Int J Radiat Oncol Biol Phys. 1998; 40(5): 1117-1124.�i���x��Ⅵ�j
5�j McQuay HJ, Collins SL, Carroll D, Moore RA. Radiotherapy for the palliation of painful bone metastases. Cochrane Database Syst Rev. 2000;(2): CD001793.�i���x��Ⅵ�j
6�j Sze WM, Shelley MD, Held I, Wilt TJ, Mason MD. Palliation of metastatic bone pain: single fraction versus multifraction radiotherapy-a systematic review of randomised trials. Clin Oncol (R Coll Radiol). 2003; 15(6): 345-352.�i���x��Ⅰ�j
7�j Wu JS, Wong R, Johnston M, Bezjak A, Whelan T; Cancer Care Ontario Practice Guidelines Initiative Supportive Care Group. Meta-analysis of dose-fractionation radiotherapy trials for the palliation of painful bone metastases. Int J Radiat Oncol Biol Phys. 2003; 55(3): 594-605.�i���x��Ⅰ�j
8�j Chow E, Harris K, Fan G, Tsao M, Sze WM. Palliative radiotherapy trials for bone metastases: a systematic review. J Clin Oncol. 2007; 25(11): 1423-1436.�i���x��Ⅰ�j
9�j Finlay IG, Mason MD, Shelley M. Radioisotopes for the palliation of metastatic bone cancer: a systematic review. Lancet Oncol. 2005; 6(6): 392-400.�i���x��Ⅰ�j
10�j Valkema R, Pauwels S, Kvols LK, Barone R, Jamar F, Bakker WH, Kwekkeboom DJ, Bouterfa H, Krenning EP. Survival and response after peptide receptor radionuclide therapy with [90Y-DOTA0,Tyr3]octreotide in patients with advanced gastroenteropancreatic neuroendocrine tumors. Semin Nucl Med. 2006; 36(2): 147-156.�i���x��Ⅳa�j
11�j Imhof A, Brunner P, Marincek N, Briel M, Schindler C, Rasch H, Mäcke HR, Rochlitz C, Müller-Brand J, Walter MA. Response, survival, and long-term toxicity after therapy with the radiolabeled somatostatin analogue [90Y-DOTA]-TOC in metastasized neuroendocrine cancers. J Clin Oncol. 2011; 29(17): 2416-2423.�i���x��Ⅳa�j
12�j Forrer F, Waldherr C, Maecke HR, Mueller-Brand J. Targeted radionuclide therapy with 90Y-DOTATOC in patients with neuroendocrine tumors. Anticancer Res. 2006; 26(1B): 703-707.�i���x��Ⅳa�j
13�j Waldherr C, Pless M, Maecke HR, Schumacher T, Crazzolara A, Nitzsche EU, Haldemann A, Mueller-Brand J. Tumor response and clinical benefit in neuroendocrine tumors after 7.4 GBq 90Y-DOTATOC. J Nucl Med. 2002; 43(5): 610-616.�i���x��Ⅳb�j
14�j Kwekkeboom DJ, Kam BL, van Essen M, Teunissen JJ, van Eijck CH, Valkema R, de Jong M, de Herder WW, Krenning EP. Somatostatin-receptor-based imaging and therapy of gastroenteropancreatic neuroendocrine tumors. Endocr Relat Cancer. 2010; 17(1): R53-73.�i���x��Ⅳa�j
15�j Swärd C, Bernhardt P, Ahlman H, Wängberg B, Forssell-Aronsson E, Larsson M, Svensson J, Rossi-Norrlund R, Kölby L. [177Lu-DOTA0-Tyr3]-Octreotate Treatment in Patients with Disseminated Gastroenteropancreatic Neuroendocrine Tumors: The Value of Measuring Absorbed Dose to the Kidney. World J Surg. 2010; 34(6) 1368-1372.�i���x��Ⅴ�j
16�j Kwekkeboom DJ, de Herder WW, Kam BL, van Eijck CH, van Essen M, Kooij PP, Feelders RA, van Aken MO, Krenning EP. Treatment with the radiolabeled somatostatin analog [177Lu-DOTA0-Tyr3]octreotate: toxicity, efficacy, and survival. J Clin Oncol. 2008; 26(13): 2124-2130.�i���x��Ⅳb�j
MEN1 �ɔ����X�E������NET
�܂�����
�������������ᇏ�1 �^�iMEN1�j���҂̖�60���ɂ��X�E������NET ���������A����S�XNET ���҂�10���ł͔w�i��MEN1 �����݂���B�X�E������NET ���҂̒�����MEN1 ���҂�f�f����d�v���Ƃ��āA1�jMEN1 �ł͎U����Ƃ͈قȂ�f�f�@��قȂ鎡�Õ��j�����߂���A2�jMEN1 �Ɛf�f�����ꍇ�ɂ́A���b��B�≺���̂ȂǁA���̕����a�ς̑����f�f�E�������Â�ړI�Ƃ����T�[�x�C�����X���s���K�v������A3�jMEN1 �͏���F�̗D����`�������ł���A�ЂƂ�̊��҂�MEN1 �Ɛf�f���邱�ƂŁA�܂��f�f����Ă��Ȃ��A���邢�͂܂����ǂ��Ă��Ȃ������҂ɑ��Ċ֘A�a�ς̑��������E�������Â��\�ɂ���A���Ƃ���������B�������Ȃ���A���ׂĂ��X�E������NET ���҂ɑ���MEN1 ��O���ɂ������������s�����Ƃ͌����I�ł͂Ȃ��A�\���̍������҂�K�ɒ��o����K�v������B
CQ5-1�@MEN1 ���^���X�E������NET �͉����H
����
�������X�E������NET �i�O���[�hB�j�A�Ĕ����X�E������NET �i�O���[�hB�j�A�K�X�g���m�[�}�i�O���[�hB�j�A��N�̃C���X���m�[�}�i�O���[�hB�j�A���J���V�E�����ǂ̕����i�O���[�hA�j�AMEN1 �֘A��ᇂ̑����i�O���[�hA�j�AMEN1 �֘A��ᇂ̉Ƒ����i�O���[�hA�j����������B
�y�� ���z
MEN1 �ɔ����X�E������NET �͌�������Ղ��̂ŁA��L�̂悤�ȓ�����L����NET ���҂ł͐ϋɓI��MEN1 ���^�����Ƃ����������B
�X�E������NET �̂���MEN1 �ɔ������͖̂�10�����߂�1-3)�B�X�E������NET �̖�80���͒P����NET �ł��邪1)�AMEN1 �ɔ���NET �ł͒P������26���ɉ߂��Ȃ�4)�B�������āA����NET ��MEN1 �������^�����Ƃ����������B���u�]�ڂ�Ȃ��X���Ĕ��ƈَ����V�K���ǂ̏ꍇ�ɂ�MEN1 �����邱�Ƃ����������B
�K�X�g���m�[�}��25����MEN1 �ɔ������̂ł���1-3)�A�K�X�g���m�[�}�͒P�Ƃ�MEN1 ���^�������ƂȂ蓾��B����MEN1 �̃K�X�g���m�[�}�͑S��\��w���ɔ������Ă���A�\��w�������̃K�X�g���m�[�}�ł͓���MEN1 �������^���Č�����i�߂�K�v������B�������A�\��w���K�X�g���m�[�}���X�K�X�g���m�[�}����������ꍇ������̂Œ��ӂ�v����B�܂��AMEN1 �ɂ������X�E������NET �̜�a���͖�60���ł��邪�ANIH �̕ł͂���40���̓K�X�g���m�[�}�֘A�Ǐ�ŏ������Ă���A45���ł͂��ꂪ���b��B�@�\���i�ǂ�����ɏo�����Ă���5)�B
�C���X���m�[�}�͑����X�E������NET �ɔ�r���Ď�N�ɔ��ǂ���X��������6)�B���ׂĂ��X�E������NET �̂���20 �Ζ����ł̔��ǂ�1�����x���߂�ɉ߂��Ȃ��̂ɑ�1)�A�{�M�ōŋߏW�v���ꂽMEN1 �̃C���X���m�[�}�ł͐f�f���N��̋L�ڂ̂���54 �ᒆ13 �Ⴊ20 �Ζ����Őf�f����Ă���7)�A��N���ǂ̃C���X���m�[�}�ł�MEN1 ���������������̂Ő��������������B���̋@�\���E��@�\��NET �ł́AMEN1 �̍����̗L���ɂ�����炸�A20 �ΈȑO�̔��ǂ͋ɂ߂ċH�ł���B
�Տ��I�ɂ�MEN1 �Ƒ������m�F���ꂽ�ꍇ�A��a�ς̊m��݂̂�MEN1 �Ɛf�f���邱�Ƃ���������Ă���8)�B�܂��AMEN1 �̂�����75���͉Ƒ���������Ō����҂ɜ늳�҂����݂���4, 9)�B
�y�� ���z
1�j Ito T, Sasano H, Tanaka M, Osamura RY, Sasaki I, Kimura W, Takano K, Obara T, Ishibashi M, Nakao K, Doi R, Shimatsu A, Nishida T, Komoto I, Hirata Y, Nakamura K, Igarashi H, Jensen RT, Wiedenmann B, Imamura M. Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan. J Gastroenterol. 2010; 45(2): 234-243.�i���x��Ⅳb�j
2�j Oberg K, Eriksson B. Endocrine tumours of the pancreas. Best Pract Res Clin Gastroenterol. 2005; 19(5): 753-781.�i���x��Ⅴ�j
3�j Plöckinger U, Rindi G, Arnold R, Eriksson B, Krenning EP, de Herder WW, Goede A, Caplin M, Oberg K, Reubi JC, Nilsson O, Delle Fave G, Ruszniewski P, Ahlman H, Wiedenmann B; European Neuroendocrine Tumour Society. Guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. A consensus statement on behalf of the European Neuroendocrine Tumour Society (ENETS). Neuroendocrinology. 2004; 80(6): 394-424.�i���x��Ⅵ�j
4�j Sakurai A, Suzuki S, Kosugi S, Okamoto T, Uchino S, Miya A, Imai T, Kaji H, Komoto I, Miura D, Yamada M, Uruno T, Horiuchi K, Miyauchi A, Imamura M; MEN Consortium of Japan. Multiple endocrine neoplasia type 1 in Japan: Establishment and analysis of a multicentre database. Clin Endocrinol (Oxf). 2012; 76(4): 533-539.�i���x��Ⅳb�j
5�j Gibril F, Schumann M, Pace A, Jensen RT. Multiple endocrine neoplasia type 1 and Zollinger-Ellison syndrome: a prospective study of 107 cases and comparison with 1009 cases from the literature. Medicine (Baltimore). 2004; 83(1): 43-83.�i���x��Ⅳa�j
6�j Trump D, Farren B, Wooding C, Pang JT, Besser GM, Buchanan KD, Edwards CR, Heath DA, Jackson CE, Jansen S, Lips K, Monson JP, O'Halloran D, Sampson J, Shalet SM, Wheeler MH, Zink A, Thakker RV. Clinical studies of multiple endocrine neoplasia type 1 (MEN1). QJM. 1996; 89(9): 653-669.�i���x��Ⅳb�j
7�j Sakurai A, Yamazaki M, Suzuki S, Fukushima T, Imai T, Kikumori T, Okamoto T, Horiuchi K, Uchino S, Kosugi S, Yamada M, Komoto I, Hanazaki K, Itoh M, Kondo T, Mihara M, Imamura M. Clinical Features of Insulinoma in Patients with Multiple Endocrine Neoplasia Type 1: Analysis of the Database of the MEN Consortium of Japan. Endocr J. 2012; 59(10): 859-866.�i���x��Ⅳb�j
8�j Brandi ML, Gagel RF, Angeli A, Bilezikian JP, Beck-Peccoz P, Bordi C, Conte-Devolx B, Falchetti A, Gheri RG, Libroia A, Lips CJ, Lombardi G, Mannelli M, Pacini F, Ponder BA, Raue F, Skogseid B, Tamburrano G, Thakker RV, Thompson NW, Tomassetti P, Tonelli F, Wells SA Jr, Marx SJ. Guidelines for diagnosis and therapy of MEN type 1 and type 2. J Clin Endocrinol Metab. 2001; 86(12): 5658-5671.�i���x��Ⅵ�j
9�j Goudet P, Murat A, Binquet C, Cardot-Bauters C, Costa A, Ruszniewski P, Niccoli P, Ménégaux F, Chabrier G, Borson-Chazot F, Tabarin A, Bouchard P, Delemer B, Beckers A, Bonithon-Kopp C. Risk factors and causes of death in MEN1 disease. A GTE (Groupe d'Etude des Tumeurs Endocrines) cohort study among 758 patients. World J Surg. 2010; 34(2): 249-255.�i���x��Ⅳb�j
CQ5-2�@MEN1 ���^���ꍇ�ɐ�������錟���͉����H
����
MEN1 �֘A�a�ς̉Ƒ����i�O���[�hA�j�ƕ��b��B�@�\���i�ǂ̌����i�A���u�~��������J���V�E���A�����A�C���^�N�gPTH �j�i�O���[�hA�j�����������B���b��B�@�\���i�ǂ킸�C�����̕a�ς݂̂����������͏��Ȃ��i�O���[�hC1�j�B
��`�w�I�����͏����ɂ��IC�������ōs�����Ƃ�����������i�O���[�hA�j�B
�y�� ���z
MEN1 ��3 ��a�ςł��镛�b��B�ߌ`���A�X�E������NET�A�����̑B��̖{�M�ł̜늳���͂��ꂼ�ꂨ���悻95���A60���A50���ł���1, 2�j�B����������MEN1 ���^����ꍇ��MEN1 �֘A��3 ��a�ςł��镛�b��B�ߌ`���A�X�E������NET �A�����̑B��̗L���ɂ��Ă̌������K�{�ƂȂ�B�菇�Ƃ��Ĕ��[�҂̖�f����щƑ�����s���A�Տ��Ǐ�[�҂ƌ����҂ɕ����Đ�������B����ɂ����MEN1 �̕a�ς��^��ꂽ�ꍇ�͑�����ɂ킽�錟�����K�v�ƂȂ�1-3�j�B
���b��B�ߌ`����MEN1 �ōł��p�x�̍������S�����ł���D���t�����Ƃ��ăA���u�~��������J���V�E���A��������ѕ��b��B�z�������i�C���^�N�gPTH�j������s���B�摜�f�f�ł�US ��Tc-MIBI �V���`���L�p�ŁA������CT�AMRI ���s��3, 4)�B�X�E������NET �́A�܂�CT�AMRI �����EUS ���s���A�@�\���XNET �����Ƃ��Č����̃C���X�����E�K�X�g�����E�O���J�S�������܂߂��X�z�������������s���B�X�z���������㏸���Ă��Ȃ��ꍇ���@�\�I�XNET ����ɔO���ɂ����K�v������5-8)�B�����̑B��^��ꂽ�ꍇ�A�@�\����ᇂł̓v�����N�`�m�[�}�AGH �Y����ᇂ��唼���߂邽�߁A�܂������v�����N�`���A�����z�������AIGF-1 �𑪒肷��B����ɁA��@�\����ᇂ��O���ɂ����Ď��쌟���A������MRI �Ȃǂ��{�s����3, 4)�B
�X�E������NET �̊��҂ŕ��b��B�ߌ`���͂Ȃ��������̕a�ς����������ꍇ�A�����̋�����iincidentaloma�j���l������ׂ��ł���BMRI ��1 cm ������microincidentalomas �Ɛf�f����銄����10�`38���ƍ����B
�O�q����3��a�ψȊO��MEN1 �ɜ늳���̍����a�ςƂ��ĕ��t�玿��ᇁi20���j�Ƌ��B�E�C�ǎx��ᇁi7���j����������1, 3)�B�����̕a�ς̌����̂��߂ɂ͋�����CT�AMRI �����US ���s���B�܂�EUS �͕��t��ᇕa�ς̐f�f������Ɋ�^����Ƃ̕�����9)�B�ŏI�I�ɂ�MEN1 ��`�q�̕ψى�͂��s���A�m��f�f������K�v�����邪�A���o���͉Ƒ����̂����Ŗ�90���A�Ƒ����̂Ȃ���ł͖�50���ł���1, 2)�B��`�w�I�����ɂ��Ă�CQ5-6���Q�ƁB
�y�� ���z
1�j Sakurai A, Suzuki S, Kosugi S, Okamoto T, Uchino S, Miya A, Imai T, Kaji H, Komoto I, Miura D, Yamada M, Uruno T, Horiuchi K, Miyauchi A, Imamura M. MEN Consortium of Japan. Multiple endocrine neoplasia type 1 in Japan: Establishment and analysis of a multicentre database. Clin Endocrinol (Oxf). 2012; 76(4): 533-539.�i���x��Ⅳb�j
2�j �N��W�m. ���{�l�ɂ����鑽�����������ᇏǂ̎��Ԓ����D���{������w��G��. 2011; 87 Suppl: 73-76.�i���x��Ⅳb�j
3�j �������. Multiple endocrine neoplasia type1(MEN1): �f�f�E���Â����`�q�J�E ���Z�����O�܂ŁD������O��.�@2008; 25: 81-88�D�i���x��Ⅴ�j
4�j Glascock MJ, Carty SE. Multiple endocrine neoplasia type 1: fresh perspective on clinical features and penetrance. Surg Oncol. 2002; 11(3): 143-150.�i���x��Ⅳb�j
5�j Ito T, Sasano H, Tanaka M, Osamura RY, Sasaki I, Kimura W, Takano K, Obara T, Ishibashi M, Nakao K, Doi R, Shimatsu A, Nishida T, Komoto I, Hirata Y, Nakamura K, Igarashi H, Jensen RT, Wiedenmann B, Imamura M. Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan. J Gastroenterol. 2010; 45(2): 234-243.�i���x��Ⅳb�j
6�j Öberg K, Eriksson B. Endocrine tumours of the pancreas. Best Pract Res Clin Gastroenterol. 2005; 19(5): 753-781.�i���x��Ⅴ�j
7�j Plöckinger U, Rindi G, Arnold R, Eriksson B, Krenning EP, de Herder WW, Goede A, Caplin M, Oberg K, Reubi JC, Nilsson O, Delle Fave G, Ruszniewski P, Ahlman H, Wiedenmann B; European Neuroendocrine Tumour Society. Guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. A consensus statement on behalf of the European Neuroendocrine Tumour Society (ENETS). Neuroendocrinology. 2004; 80(6): 394-424.�i���x��Ⅵ�j
8�j �y�䗲��Y. �X�����E�_�o�������ᇁD������O��. 2011; 34: 1239-1246.�i���x��Ⅴ�j
9�j Schaefer S, Shipotko M, Meyer S, Ivan D, Klose KJ, Waldmann J, Langer P, Kann PH. Natural course of small adrenal lesions in multiple endocrine neoplasia type 1: an endoscopic ultrasound imaging study. Eur J Endocrinol. 2008; 158(5): 699-704.�i���x��Ⅳb�j
CQ5-3�@MEN1 ���X�E������NET �ł͎U�����̏ꍇ�Ɛf�f�@���قȂ邩�H
����
�������̏��XNET �������ACT ��MRI �Ō��o�ł��Ȃ����Ƃ���ᇑ��݂̔ے�Ƃ͂Ȃ炸�AEUS ���s���悤����������i�O���[�hB�j�B�@�\���X�E������NET �̋Ǎݐf�f�ɂ�SASI �e�X�g������������i�O���[�hB�j�B
�y�� ���z
MEN1 ���X�E������NET �̓����́A1�j�������A2�j���a�ρA3�j�̓]�ڂ̕p�x���U�����ɔ�ׂč����_�ł���1, 2)�B�X�\��w���̈�ɔ�������NET �Ɋւ��ẮA�a���w�I���X�Ə\��w���̊Ԃɑ����̌������I�Ȕ���NET ���������Ă���3, 4)�BMEN1 ���X�E������NET �̖��̓K�X�g���m�[�}�ł���A�����͏\��w���S�����ɉ摜�ł͂Ƃ炦�ɂ�������ᇂƂ��Ĕ������A���̖������f���ɑ������Ă���3, 4)�BMEN1 �̃K�X�g���m�[�}�͏\��w����ᇂł��邱�Ƃ��������A�X���ɂ���ᇂ��U�����ɔ������邱�Ƃ�����B����ɎU����̃C���X���m�[�}��90�����P�����ł��邪�AMEN1 �ł͑����Ⴊ�����̂������ł���B���������ďp�O��CT�AMRI ���Ō��o�ł��Ȃ��������̏��a�ς�����A�����������a�ς̌��o�ɂ�EUS ���L�p�ł���B
MEN1 ���XNET �̎�ᇌa��3 cm ����Ɗ̓]�ڂ̕p�x��23���ƍ����Ȃ�A����5���͎��S�����Ƃ̕�����5)�B���������āA��ᇌa�̑傫���Ǘ�̌o�ߊώ@�͊̓]�ڂȂǂ̉��u�]�ڂ̊댯�����傷��B�܂��A�̓]�ڂ̋Ǎ݂ɂ͏p�O��CT�AMRI �����US �����łȂ��A�p��US ���L�p�ł���A�p�O�Ɍ��o�ł��Ȃ��������a�ς����o�����@������Ȃ��Ȃ��B
�@�\���X�E������NET �̋Ǎݐf�f�ɂ͊�����ѓ��ِ�������SASI �e�X�g���D��Ă���2-4, 6, 7)�B�������AMEN1 �ɜ늳�����������b��B�ߌ`���̑��ݎ��ɂ͍��J���V�E�����ǂɂ���ăK�X�g������C���X�����̕��傪���i���Ă���B���������āA���b��B�@�\���i�ǂ̑��ݎ��̂��K�X�g���m�[�}��C���X���m�[�}�̐f�f��������̂Œ��ӂ�v����1, 8�j�B
�y�� ���z
1�j �N��W�m. MEN1 �^�̐f�f�Ǝ��ÁD�̒_�X. 2011; 63(2): 285-291.�i���x��Ⅴ�j
2�j Imamura M, Komoto I, Ota S, Hiratuska T, Kosugi S, Doi R, Awane M, Inoue N; Biochemically curative surgery for gastrinoma in multiple endocrine neoplasia type 1 patient. World J Gastroenterol. 2011; 17(10); 1343-1353.�i���x��Ⅳb�j
3�j �������V. NET �Տ��̕ϑJ�F�Ǎݐf�f�@�̐i���ƕa�ԉ𖾁D��w�̂����. 2008; 224(10): 753-756.�i���x��Ⅴ�j
4�j Imamura M, Kanda M, Takahashi K, Shimada Y, Miyahara T, Wagata T, Hashimoto M, Tobe T, Soga J; Clinicopathological characteristics of duodenal microgastrinomas. World J Surg 16: 703-710, 1992. �i���x��Ⅳb�j
5�j Gibril F, Venzon DJ, Ojeaburu JV, Bashir S, Jensen RT. Prospective study of the natural history of gastrinoma in patients with MEN1: definition of an aggressive and a nonaggressive form. J Clin Endocrinol Metab. 2001; 86(11): 5282-593.�i���x��Ⅳa�j
6�j Imamura M, Takahashi K, Adachi H, Minematsu S, Shimada Y, Naito M, Suzuki T, Tobe T, Azuma T. Usefulness of selective arterial secretin injection test for localization of gastrinoma in the Zollinger-Ellison syndrome. Ann Surg. 1987; 205(3): 230-239.�i���x��Ⅴ�j
7�j Imamura M, Takahashi K, Isobe Y, Hattori Y, Satomura K, Tobe T. Curative resection of multiple gastrinoma aided by selective arterial injection test and intraoperative secretin test. Ann Surg. 1989; 210(6): 710-718.�i���x��Ⅳb�j
8�j Jensen RT. Management of the Zollinger-Ellison syndrome in patients with multiple endocrine neoplasia type 1. J Intern Med. 1998; 243(6): 477-488.�i���x��Ⅳb�j
CQ5-4�@MEN1 ���X�E������NET �ł͎U�����̏ꍇ�Ǝ��Ö@���قȂ邩�H
����
�������̏��XNET �������A�̓]�ڗ����������߁A�p���̌���ɂ͎�ᇂ̐��ƋǍ݂��l�����邱�Ƃ�����������i�O���[�hA�j�B
�K�X�g���m�[�}�͐ϋɓI�ȊO�ȓI���Â̂ق����̓]�ڔ��������Ⴍ�C��N�P�̊O�ȓI���Â�����������i�O���[�hB�j�B������ᇂ�F�߂�ꍇ���C��������@�\����ᇂ̑����͌o�߂��ǍD�ł���C�X�S�E�p�͂ł��邾��������邱�Ƃ�����������i�O���[�hB�j�B�@�\����ᇂ̑������̓]�ڗ�ł͍Ĕ��\�h�⌸�ʖړI���X�S�E�p���l��������i�O���[�hC1�j�B
�y�� ���z
MEN1 �̎��Â͊O�Ȏ��Â����I���ł���DMEN1 ���X�E������NET �̓����́A1�j�������A2�j���a�ρA3�j�̓]�ڂ̕p�x���U�����X�E������NET �ɔ�ׂč����_�ł���A���̓������l�����������I�ȊO�Ȏ��Â����߂���1, 2)�B��ᇌa1 cm �����̔�@�\��NET �͌o�ߊώ@����������Ă��邪�A��ᇌa��1 cm ����ꍇ�͎�p���l������3)�B����MEN1 �̔�@�\���XNET �̎�ᇌa��2 cm ����3 cm �̏ꍇ��8 �N�Ԃ̌o�ߊώ@��23�����̓]�ڂ����������Ƃ̕�����4)�B�܂��AMEN1 �̃K�X�g���m�[�}�Ǘ�ɂ����ĐϋɓI�ȊO�Ȏ��Â��s�����Q�̊̓]�ڔ������� 3-5���ł���̂ɑ��A�ۑ��I���Â��s�����Q�ł�23-29���ɒB�����ƕ���Ă���5-7�j�B�ŋ�Imamura ��2)�͗ǍD�ȊO�Ȏ�p���т���A�C�O�ł����l�̐��т�������Ă���AMEN1 �̃K�X�g���m�[�}�̎��Â͖ɂ��z�������}�����Â�����ϋɓI�ȊO�Ȏ��ÂւƃV�t�g������1)�BMEN1 ���҂ɔ�������@�\���X�E������NET �̑����͏\��w���ɔ�������K�X�g���m�[�}�ł���A���̎�ȍ����p�Ƃ��ď]�����X���\��w���؏����s���Ă������A�ߔN���X���\��w���؏�����N�P�œ����̒����\�オ���҂ł����X�����\��w���S�E�p�̗L�p��������Ă���2)�B
�XNET �̎�ᇑ�����ł͏p��̏d�Ă��X�����A�a���l�������X�S�E�p���ɗ͉�����邱�Ƃ���������A��a1 cm �����̔�@�\����ᇂ͌o�ߊώ@�����������B����A�ߔN�X�S�E�p�̊O�Ȏ��Ð��т͈��肵�Ă��Ă���A�X���������X�̔����ɎU�݂��鑽���a�ςɑ��Ă͒����\������ڎw���A�K����I�������X�S�E�p���s���{�݂��������Ă��Ă���8, 9)�B�̓]�ڏǗ�ɑ��ẮA�������̊��S�؏���������Ϗp�\�Ǘ�ł͐ϋɓI�Ȋ̐؏�����������Ă���A�����I�̐؏������łȂ��A���ʖړI�̊̐؏��ɂ�钷���\���������҂����10)�B
�؏��s�\�ȓ]�ڂ����������Ǘ�ɑ��Ă͍R��ᇖ�A�Ǐ��Ö@�A�x���Ö@���l�������B���̓K���͊�{�I�ɎU����Ɠ��l�ł���i���Ȏ��ÁE�W�w�I�����̍����Q�Ɓj�B
�y�� ���z
1�j �N��W�m. MEN1 �^�̐f�f�Ǝ��ÁD�̒_�X. 2011; 63(2): 285-291.�i���x��Ⅴ�j
2�j Imamura M, Komoto I, Ota S, Hiratuska T, Kosugi S, Doi R, Awane M, Inoue N; Biochemically curative surgery for gastrinoma in multiple endocrine neoplasia type 1 patient. World J Gastroenterol. 2011; 17(10); 1343-1353.�i���x��Ⅳb�j
3�j �������V. NET �Տ��̕ϑJ�F�Ǎݐf�f�@�̐i���ƕa�ԉ𖾁D��w�̂����. 2008; 224(10): 753-756.�i���x��Ⅴ�j
4�j Gibril F, Venzon DJ, Ojeaburu JV, Bashir S, Jensen RT. Prospective study of the natural history of gastrinoma in patients with MEN1: definition of an aggressive and a nonaggressive form. J Clin Endocrinol Metab. 2001; 86(11): 5282-593.�i���x��Ⅳa�j
5�j Fraker DL, Norton JA, Alexander HR, Venzon DJ, Jensen RT; Surgery in Zollinger-Ellison syndrome alters the natural history of gastrinoma. Ann Surg. 1994; 220(3): discussion 320-330.�i���x��Ⅳa�j
6�j Norton JA, Fraker DL, Alexander HR, Gibril F, Liewehr DJ, Venzon DJ, Jensen RT. Surgery increases survival in patients with gastrinoma. Ann Surg. 2006; 244(3): 410-419.�i���x��Ⅲ�j
7�j Bartsch DK, Fendrich V, Langer P, Celik I, Kann PH, Rothmund M. Outcome of duodenopancreatic resections in patients with multiple endocrine neoplasia type 1. Ann Surg. 2005; 242(6): 757-764.�i���x��Ⅳb�j
8�j Maeda H, Hanazaki K. Pancreatogenic diabetes after pancreatic resection. Pancreatology. 2011; 11(2): 268-276.�i���x��Ⅴ�j
9�j Jethwa P, Sodergren M, Lala A, Webber J, Buckels JA, Bramhall SR, Mirza DF. Diabetic control after total pancreatectomy. Dig Liver Dis. 2006; 38(6): 415-419.�i���x��Ⅳb�j
10�j Steinmüller T, Kianmanesh R, Falconi M, Scarpa A, Taal B, Kwekkeboom DJ, Lopes JM, Perren A, Nikou G, Yao J, Delle Fave GF, O'Toole D; Frascati Consensus Conference participants. Consensus guidelines for the management of patients with liver metastases from digestive (neuro)endocrine tumors: foregut, midgut, hindgut, and unknown primary. Neuroendocrinology. 2008; 87(1): 47-62.�i���x��Ⅵ�j
CQ5-5�@MEN1 ���X�E������NET �̐��������o�ߊώ@�@�́H
����
����T�[�x�C�����X�͐f�Âɂ��Ǐ�̊ώ@�Ɖ摜�����A�z���������肪����������i�O���[�hC1�j�B
�y�� ���z
MEN1 �ł��X�����؏����j�o�p��ɂ��c���X����V�K�a�ς��o������\�������邽�߁A��p�������I�Ȍo�ߊώ@���K�v�ƂȂ�B�X�����؏��p��j�o�p�������҂ł�16-20���Ŏ�ᇂ̍Ĕ���F�߂�1, 2)�B�قȂ�@�\��NET ���V�K�ɔ�������\��������̂ŁA�o�ߊώ@�ł͏�����ᇂ̋@�\�̗L���ɂ�����炸�A��ᇂ̑��݂��m�F����摜�f�f����ы@�\��NET �����o���镡���̃z����������̗��҂��K�v�ł���B
�X�N���[�j���O�ړI�̉摜�����Ƃ��Ă�CT ��������MRI �����������3, 4)�B�z����������E�����w�����Ƃ��Ă̓K�X�g�����A���C���X��������ь����͕K�{�ł���B�C�O�ł͔�@�\��NET �̌����}�[�J�[�Ƃ��ăN�����O���j��A ���X�|���y�v�`�h���肪��������Ă��邪�A�킪���ł͕ی����ڂ���Ă��Ȃ��B�\�}�g�X�^�`���AVIP �ɂ��Ă͕p�x���Ⴍ5, 6)�A���m�ȗՏ��Ǐ��悷�邽�ߒ�������ő��肷��Ӌ`�͒Ⴂ�B
�����̕p�x�ɂ��ẮA�p��3�]6 �������1 ��A�����I�ɂ͎�p���s������ᇂ��@�\���ł������ꍇ�͊֘A�z�������Ɛ����w�������p��3 �N�܂ł͔��N���ƁA4 �N�ڈȍ~�͔N1 �肷�邱�Ƃ����߂���7)�B�摜�����́A��@�\��NET �̌o�ߊώ@���s���Ă���ꍇ�͔N1 ��̌������p������̂��Ó��ƍl������B
��������̏I�������Ɋւ���R���Z���T�X�͂Ȃ����A�XNET �̗ݐϔ��Ǘ��͍���Ɏ���܂ő������Ă���8)�A���U�ɂ킽��T�[�x�C�����X�̌p�����Ó��ł���B�������Ȃ���60 �Έȍ~�ł͐V�K���ǂ͌������邽��9)�A���҂̊�]���l���̏�Ō����Ԋu���������Ƃ�����������B
�y�� ���z
1�j Gauger PG, Doherty GM, Broome JT, Miller BS, Thompson NW. Completion pancreatectomy and duodenectomy for recurrent MEN-1 pancreaticoduodenal endocrine neoplasms. Surgery. 2009; 146(4): 801-806.�i���x��Ⅳb�j
2�j Kouvaraki MA, Shapiro SE, Cote GJ, Lee JE, Yao JC, Waguespack SG, Gagel RF, Evans DB, Perrier ND. Management of pancreatic endocrine tumors in multiple endocrine neoplasia type 1. World J Surg. 2006; 30(5): 643-653.�i���x��Ⅳb�j
3�j Akerström G, Hessman O, Skogseid B. Timing and extent of surgery in symptomatic and asymptomatic neuroendocrine tumors of the pancreas in MEN 1. Langenbecks Arch Surg. 2002; 386(6): 558-569.�i���x��Ⅵ�j
4�j Brandi ML, Gagel RF, Angeli A, Bilezikian JP, Beck-Peccoz P, Bordi C, Conte-Devolx B, Falchetti A, Gheri RG, Libroia A, Lips CJ, Lombardi G, Mannelli M, Pacini F, Ponder BA, Raue F, Skogseid B, Tamburrano G, Thakker RV, Thompson NW, Tomassetti P, Tonelli F, Wells SA Jr, Marx SJ. Guidelines for diagnosis and therapy of MEN type 1 and type 2. J Clin Endocrinol Metab. 2001; 86(12): 5658-5671.�i���x��Ⅵ�j
5�j Lévy-Bohbot N, Merle C, Goudet P, Delemer B, Calender A, Jolly D, Thiéfin G, Cadiot G; Groupe des Tumeurs Endocrines. Prevalence, characteristics and prognosis of MEN 1-associated glucagonomas, VIPomas, and somatostatinomas: study from the GTE (Groupe des Tumeurs Endocrines) registry. Gastroenterol Clin Biol. 2004; 28(11): 1075-1081.�i���x��Ⅳb�j
6�j Sakurai A, Suzuki S, Kosugi S, Okamoto T, Uchino S, Miya A, Imai T, Kaji H, Komoto I, Miura D, Yamada M, Uruno T, Horiuchi K, Miyauchi A, Imamura M; MEN Consortium of Japan. Multiple Endocrine Neoplasia Type 1 in Japan: Establishment and Analysis of a Multicentre Database. Clin Endocrinol (Oxf). 2012; 76(4): 533-539.�i���x��Ⅳb�j
7�j NCCN Clinical Practice Guidelines in Oncology: Multiple endocrine neoplasia type 1.�i���x��Ⅵ�j
8�j Triponez F, Dosseh D, Goudet P, Cougard P, Bauters C, Murat A, Cadiot G, Niccoli-Sire P, Chayvialle JA, Calender A, Proye CA. Epidemiology data on 108 MEN 1 patients from the GTE with isolated nonfunctioning tumors of the pancreas. Ann Surg. 2006; 243(2): 265-272.�i���x��Ⅳb�j
9�j Marx S, Spiegel AM, Skarulis MC, Doppman JL, Collins FS, Liotta LA. Multiple endocrine neoplasia type 1: clinical and genetic topics. Ann Intern Med. 1998; 129(6): 484-494.�i���x��Ⅵ�j
CQ5-6�@MEN1 �̈�`�w�I�����͐�������邩�H
����
�ȉ��Ɏ����Տ����������͉Ƒ�����L���銳�҂ɑ��ẮA�{�l��IC �������ōs�����Ƃ�����������i�O���[�hB�j�B
- ���b��B�@�\���i�ǂ������͉����̎�ᇂ̍���
- �X�E������NET �̑���
- �K�X�g���m�[�}�C���ɏ\��w���S���̈�ɔ��������ꍇ
- 20 �Ζ����Ŕ��ǂ����C���X���m�[�}
- MEN1 ��������MEN1 �֘A�a�ς̉Ƒ���
�y�� ���z
�Ƒ�����L����T�^�I��MEN1 �Ǘ�̏ꍇ�́A���ǎҖ{�l�̊m��f�f�̂��߂�MEN1 ��`�w�I�����͕K�������s���Ƃ͂����Ȃ��B�������A�ƌn���̔ǎ҂ǑO�ɐf�f���邽�߂̏��Ƃ��āA��`�q�f�f���K�v�ł���1)�B����A�Տ��I��MEN1 �̐f�f��i�����́E���b��B�E�X�����呟��̂�����2 ����ȏ�̕a�ς��邢��1 ����a�� + MEN1 �Ƒ����j�����Ȃ��ꍇ�ł��A���̏ꍇ�͊m��f�f�̂��߂�MEN1 ��`�w�I�������L���ł���B�K�X�g���m�[�}�A�������X�E������NET�A���B�����b��B�a�ρA�Ƒ������b��B�@�\���i�ǁA�Ĕ����X�E������NET�A��N���i30 �Έȉ��j�̌��������b��B�@�\���i�ǁA��N���i20 �Έȉ��j�C���X���m�[�}�Ȃǂ�MEN1 ���^�������Ƃ��ďd�v�ł���2-4)�B
�����҂̃L�����A�f�f�́A�T�[�x�C�����X�����ʓI�Ɏ��{����i���邢�͂��Ȃ��j���Ƃ��ł���̂ŋ������������B���̏��邽�߂̉ƌn���늳�҂�MEN1 ��`�w�I�������������������B�����҂̔��ǑO�f�f�������{����ꍇ�A���[�҂̕ψُ����m�F���Ă��猌���҂̈�`�q�f�f���s���i�ǂ̌����҂����ł̈�`�q�f�f�͂ł��Ȃ��j�B����ɂ��MEN1 �ƌn�\�����̕ψٕۗL��Ԃ����炩�ƂȂ�B�ψق�L����ꍇ�́A�֘A�a�ς̑����������ÂɌ��т��T�[�x�C�����X�����{����B�ψق�L���Ȃ��ꍇ�́A�T�[�x�C�����X�͕s�v�ƂȂ�5, 6)�B
MEN1 ��`�w�I�����́A�ʏ�610 �A�~�m�_����Ȃ�`��menin ���R�[�h������}����`�qMEN1 ��coding exon 2-10 �����̓C���g�����ƂƂ���PCR ���ڃV�[�N�G���X�@�Œ��ׂ�̂���ʓI�ł���B�ψٌ��o���͉Ƒ����̂����Ŗ�90���A�Ƒ����̂Ȃ���ł͖�50���ł���5)�B
���̈�`�q�f�f�ł����l�����A�A�~�m�_�̕ω�����~�X�Z���X�ψق����������ꂽ�ꍇ�́A�a�I�Ӌ`�����邩�T�d�ɕ]������K�v������B����ł��邩�A���̎�ł��ۑ�����Ă��邩�A�@�\�h���C���̕ω����A3 �����\���ɑ傫���e�����邩�A�@�\��͂ł̋@�\�͂ǂ����Ȃǂɂ���Ĕ��f�����̂ŁA��`�w�I�����������Ă������Ɋm�F���Ă������Ƃ��]�܂����B��L�̕��@�ŕψق����肳��Ȃ��ꍇ�AMEN1 ��`�q�̑傫�ȍ\���ω�7)��v�����[�^���ʓ��̕ω��A���̈�`�qCDKN1B/p27�A p16�A p18�A p21 �ȂǂɋH�ɕψق����肳���ꍇ������i�e�XMEN1 ��`�q�ψىA�����0.5-1�����x�j8, 9)�B���������āA�Տ��I�ɋ����^��ꂽ�ꍇ�ȊO�͂����̌����͒ʏ�s���Ȃ��B�ނ���A�Տ��I��MEN1 �ł��邱�Ƃ��ے�ł��Ȃ��ꍇ�AMEN1 �ψق����肳��Ȃ����MEN1 phenocopy �ł���ƍl������2, 10)�B
�y�� ���z
1�j Brandi ML, Gagel RF, Angeli A, Bilezikian JP, Beck-Peccoz P, Bordi C, Conte-Devolx B, Falchetti A, Gheri RG, Libroia A, Lips CJ, Lombardi G, Mannelli M, Pacini F, Ponder BA, Raue F, Skogseid B, Tamburrano G, Thakker RV, Thompson NW, Tomassetti P, Tonelli F, Wells SA Jr, Marx SJ. Guidelines for diagnosis and therapy of MEN type 1 and type 2. J Clin Endocrinol Metab. 2001; 86(12): 5658-5671.�i���x��Ⅵ�j
2�j Tham E, Grandell U, Lindgren E, Toss G, Skogseid B, Nordenskjold M. Clinical testing for mutations in the MEN1 gene in Sweden: a report on 200 unrelated cases. J Clin Endocrinol Metab. 2007; 92(9): 3389-3395.�i���x��Ⅳb�j
3�j Cardinal JW, Bergman L, Hayward N, Sweet A, Warner J, Marks L, Learoyd D, Dwight T, Robinson B, Epstein M, Smith M, Teh BT, Cameron DP, Prins JB. A report of a national mutation testing service for the MEN1 gene: clinical presentations and implications for mutation testing. J Med Genet, 2005; 42(1): 69-74.�i���x��Ⅳb�j
4�j Kihara M, Miyauchi A, Ito Y, Yoshida H, Miya A, Kobayashi K, Takamura Y, Fukushima M, Inoue H, Higashiyama T, Tomoda C. MEN1 gene analysis in patients with primary hyperparathyroidism: 10-year experience of a single institution for thyroid and parathyroid care in Japan. Endocr J. 2009; 56(5): 649-656.�i���x��Ⅳb�j
5�j Sakurai A, Suzuki S, Kosugi S, Okamoto T, Uchino S, Miya A, Imai T, Kaji H, Komoto I, Miura D, Yamada M, Uruno T, Horiuchi K, Miyauchi A, Imamura M; MEN Consortium of Japan. Multiple endocrine neoplasia type 1 in Japan: Establishment and analysis of a multicentre database. Clin Endocrinol (Oxf). 2012; 76(4): 533-539.�i���x��Ⅳb�j
6�j Goudet P, Murat A, Binquet C, Cardot-Bauters C, Costa A, Ruszniewski P, Niccoli P, Ménégaux F, Chabrier G, Borson-Chazot F, Tabarin A, Bouchard P, Delemer B, Beckers A, Bonithon-Kopp C. Risk factors and causes of death in MEN1 disease. A GTE (Groupe d'Etude des Tumeurs Endocrines) cohort study among 758 patients. World J Surg. 2010; 34(2): 249-255.�i���x��Ⅳb�j
7�j Owens M, Ellard S, Vaidya B. Analysis of gross deletions in the MEN1 gene in patients with multiple endocrine neoplasia type 1. Clin Endocrinol (Oxf). 2008; 68(3): 350-354.�i���x��Ⅳb�j
8�j Georgitsi M, Raitila A, Karhu A, van der Luijt RB, Aalfs CM, Sane T, Vierimaa O, Makinen MJ, Tuppurainen K, Paschke R, Gimm O, Koch CA, Gundogdu S, Lucassen A, Tischkowitz M, Izatt L, Aylwin S, Bano G, Hodgson S, De Menis E, Launonen V, Vahteristo P, Aaltonen LA. Germline CDKN1B/p27Kip1 mutation in multiple endocrine neoplasia. J Clin Endocrinol Metab. 2007; 92(8): 3321-3325.�i���x��Ⅳb�j
9�j Sunita K, Agarwal SK, Mateo CM, Marx SJ. Rare germline mutations in cyclin-dependent kinase inhibitor genes in multiple endocrine neoplasia type 1 and related states. J Clin Endocrinol Metab. 2009; 94(5): 1826-1834.�i���x��Ⅳb�j
10�j Hai N, Aoki N, Shimatsu A, Mori T, Kosugi S. Clinical features of multiple endocrine neoplasia type 1 (MEN1) phenocopy without germline MEN1 gene mutations: analysis of 20 Japanese sporadic cases with MEN1. Clin Endocrinol (Oxf). 2000; 52(4): 509-518.�i���x��Ⅳb�j
�R����
- 1�jMEN1 �̑��a�ς��������Ă���ꍇ�ɐ�������鎡�Ï��ʂ́H
������MEN1 �֘A��ᇂ�L���銳�҂ɂ�����X�̕a�ς̎��×D�揇�ʂ́A���ꂼ��̊��҂̏ɉ����Ĕ��f����K�v������A�@�B�I�ȗD�揇�ʂÂ��͂ł��Ȃ��B�X�E������NET �̊O�Ȏ��Â��l������ꍇ�ɂ́A���b��B�@�\���i�ǁA�����̎�ᇁA���B��ᇂ̑��݂Ƃ����ɑ��鎡�Â̏��������ƂȂ�B�����Ƃ��ĕ��b��B�̎��Â���ɍs���B���J���V�E�����ǂ̐������S�g�Ǘ��ɂ����ďd�v�ƍl�����邩��ł���B�������A���b��B�@�\���i�ǂ��y�x�ŁA�X�E������NET �̎��Â��}�����ꍇ�i�K�X�g���m�[�}��C���X���m�[�}�ɂ��Տ��Ǐ��x�̏ꍇ�A������Ȃǁj���X�̎��Â��D�悳�ꂤ��B�����̎�ᇂ͒ʏ�ً}��v���邱�Ƃ͏��Ȃ����A�X�E������NET �Ɉ������^�킹�鏊�����Ȃ��A����ʼn����̎�ᇂ̑���ɂ�鎋���Q��퉺���̋@�\�̏�Q���F�߂���ꍇ�iACTH ����s�S�ɂ�镛�t�s�S������ꍇ�Ȃǁj�ɂ͉����̂̎��Â�D�悷��K�v������B���B��ᇂ͈����x���������߁A���������Ύ��Â̗D�揇�ʂ͍����B���t�玿��ᇂ͒ʏ��@�\���ŁA��ᇌa���o�ߊώ@�����e���郌�x���ɂƂǂ܂邱�Ƃ������B�܂��A�a�ς⊳�҂̐g�̏�]��������ŕ����a�ς̓�����p���l���ł���B
- 2�j�X�E������NET �����ǂ�MEN1 ���҂̃T�[�x�C�����X�͂ǂ����ׂ����H
MEN1 �ł͔��[�҂̈�`�q�ψق����肳���Ό����҂̔��ǑO�f�f���\�ƂȂ�A�X�E������NET �̔��LjȑO����X�N���[�j���O���J�n���āA��ᇂ̑��������A�������ÂɂȂ��邱�Ƃ��\�ƂȂ�B�X�N���[�j���O�̊J�n�����ƌ������ڂɂ��ẴR���Z���T�X�͂Ȃ����A2001 �N�ɔ��\���ꂽMEN �f�ÃK�C�h���C���ł́A�C���X���m�[�}�ɂ��Ă�5 ����A�����X�E������NET �ɂ��Ă�20 ����̃X�N���[�j���O�𐄏����Ă���B���t�����Ɋւ��Ă͑O�҂ł͋��C���X�����ƌ����l�A��҂ɂ��Ă̓K�X�g�����A�N�����O���j��A�A�O���J�S���Ȃǂ̔N1 ��̑���𐄏����Ă���B�������A�킪���ł̓N�����O���j��A ����͕ی����ڂ���Ă��Ȃ��B�܂��A�C���X���m�[�}�ɂ��Ă͗Տ��Ǐ���₷���̂ŁA�����Ē���������s��Ȃ��Ƃ��悢�Ƃ����l����������B���̏ꍇ�͗��e�ɒጌ���Ǐ�ɂ��Ă悭�������Ă����A�^�킵���ǏF�߂�ꂽ�ꍇ�ɂ͑��}�Ɏq�ǂ�����f������悤�w�����Ă����K�v������B
�N�����O���j��A ���X�|���y�v�`�h�̑��肪�ی����ڂ���Ă��Ȃ��킪���ł́A��@�\����ᇂ̌��o�͉摜�������B��̕��@�ł���B�����@��CT ��������MRI �����������B��`�q�ψق��m�F���ꂽ�����ǎ҂ɑ��ẮA20 �Έȍ~3 �N���Ƃ̌��������������B