�u�ɊǗ��@�`���ÃK�C�h���C��
�K�C�h���C�������̕����ԍ�����C�Y������Q�l�����ꗗ���Q�Ƃ��邱�Ƃ��ł��܂�
�������̊T�v�`OVERVIEW�`
���}�������Q�����N���b�N����Ɖ���ֈړ����܂��B
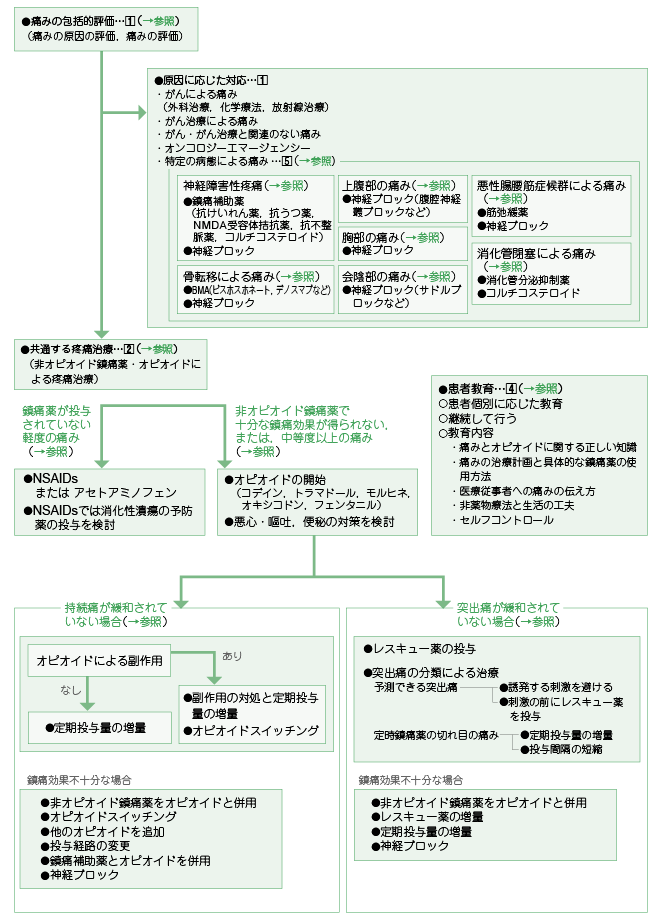
�P�D�ɂ݂̕]���ƌ����ɉ������Ή�
�ɂ݂̕�I�]�����s���B��I�]���ɂ́C�ɂ݂̌����̕]���ƒɂ݂̕]�����܂܂��B
1 �j�ɂ݂̌����̕]��
�ɂ݂̌����̕]���ł́C����ɂ��ɂ݁C���Âɂ��ɂ݁C����E���ƒ��ڊ֘A�̂Ȃ��ɂ݁C�I���R���W�[�G�}�[�W�F���V�[�C����̕a�Ԃɂ��ɂ݂�]������B
����ɂ��ɂ݂ł͒��ɖ�̓��^�Ȃǂ̒ɂ݂ɑ��鎡�ÂƂƂ��ɁC�O�Ȏ��ÁC���w�Ö@�C���ː����ÂȂǂ̎�ᇂ��̂��̂ɑ��鎡�Â���������B
���Âɂ��ɂ݁i�p��ɏnj�Q�C���w�Ö@��_�o��Q���u�ɂȂǁj�₪��E���ƒ��ڊ֘A�̂Ȃ��ɂ݁i�Ғ��Nj���ǁC�я��v�]�Ȃǁj�ł͌����ɉ��������Â��s���B
�ɂ݂��I���R���W�[�G�}�[�W�F���V�[�i�Ґ������nj�Q�C���܁E�ؔ����܁C�����ǁC�����ǂ̕ǁE���E�E�o���Ȃǁj�̏Ǐ�ł��邱�Ƃ�����̂ŁC�ɂ݂ւ̑Ή��݂̂łȂ��C�ɂ݂��Ă���a�Ԃ̔c���ƌ����ւ̑Ή����s���B
����̕a�Ԃɂ��ɂ݂Ƃ��ẮC�_�o��Q���u����1�C���]�ڂɂ��ɂ݁C�㕠���̒ɂ݁C�����̒ɂ݁C��A���̒ɂ݁C���������؏nj�Q��2 �ɂ��ɂ݁C�����Ǖǂɂ��ɂ݂�����B���ꂼ��C���ɕ⏕����3�C�_�o�u���b�N�ȂLjقȂ���Ɏ�i������̂ŋ��ʂ����u�Ɏ��Â��s���ƂƂ��Ɍ�������B
2 �j�ɂ݂̕]��
�ɂ݂̕]���ł́C�ɂ݂̓��퐶���ւ̉e���C�ɂ݂̃p�^�[���i�����ɂ��ˏo����4 ���j�C�ɂ݂̋����C�ɂ݂̕��ʁC�ɂ݂̌o�߁C�ɂ݂̐���C�ɂ݂̑������q�ƌy�����q�C���ݍs���Ă��鎡�Â̔����C����сC���X�L���[��̌��ʂƕ���p�ɂ��ĕ]������B
��1�F�_�o��Q���u��
�Ɋo��`����_�o�̒��ړI�ȑ����₱���̐_�o�̎����ɋN������ɂ݁B�ܔM�ɁC�d���ɁC�Ɋo�ߕq�C���o�ߕq�C�A���f�B�j�A�Ȃǂ����Ƃ�����B����Œ��ɕ⏕��̕��p��K�v�Ƃ��邱�Ƃ������B�Q���B
��2�F���������؏nj�Q
�����ؓ��̈��������̑��݂ɂ��N����l�a���E��ځE�G�̒ɂ݁B�g�̏����Ƃ��āC�����̑�1�`4 ���Ő_�o�̈�̐_�o��Q�C�����̝��k����������Ҋߋ��ȌŒ肪�݂���B�Q���B
��3�F���ɕ⏕��
�傽���p�ɂ͒��ɍ�p��L���Ȃ����C���ɖ�ƕ��p���邱�Ƃɂ����Ɍ��ʂ����߁C����̏��Œ��Ɍ��ʂ������i�R����C�R��������CNMDA ��e�̝h�R��Ȃǁj�B��I�s�I�C�h���ɖ��I�s�I�C�h�����ł͒ɂ݂��y���ł��Ȃ��ꍇ�ɑI�������B�Q���B
��4�F�ˏo�Ɂibreakthrough pain�j
�����ɂ̗L������x�C���ɖÂ̗L���ɂ�����炸���������ߐ��̒ɂ݂̑����B�Q���B
�Q�D��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Ái�u���ʂ����u�Ɏ��Áv�j
1 �j���ɖ��^����Ă��Ȃ��y�x�̒ɂ�
���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̊��҂ɑ��ẮC��I�s�I�C�h���ɖ�iNSAIDs �܂��̓A�Z�g�A�~�m�t�F���j���J�n����B�t�@�\��Q�E��������ᇁE�o���X�������銳�҂ɂ́C�A�Z�g�A�~�m�t�F�����g�p����BNSAIDs �𓊗^����ꍇ�ɂ́C��������ᇂ̗\�h����������B���Ɍ��ʂ��s�\���ȏꍇ�ɂ́C�I�s�I�C�h���J�n���邱�Ƃ������Ƃ���B
2 �j��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��͒����x�ȏ�̒ɂ�
��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̒ɂ݂̊��҂ɑ��Ă̓I�s�I�C�h���J�n����B�I�s�I�C�h�́C�\�ȓ��^�o�H�C�����ǁC�����Ǐ�C�ɂ݂̋����ȂNJ��҂̏�Ԃɉ����āC�R�f�C���C�g���}�h�[���C�����q�l�C�I�L�V�R�h���C�t�F���^�j���̂����ꂩ���g�p����B�I�s�I�C�h�̊J�n�ɔ����Đ�����\���̂��鈫�S�E�q�f����ѕ֔�̑����������B
3 �j�I�s�I�C�h�����^����Ă��\���Ȓ��Ɍ��ʂ������Ȃ��ɂ�
�I�s�I�C�h�����^����Ă��銳�҂ɒɂ݂����鎞�ɂ́C�܂������ɂ��ˏo�ɂ�����ʂ���B
�i1�j�����ɂ��ɘa����Ă��Ȃ��ꍇ�����I�Ȓɂ݂��ɘa����Ă��Ȃ��ꍇ�́C�I�s�I�C�h�ɂ�镛��p�i���S�E�q�f�C���C�Ȃǁj���Ȃ���C�I�s�I�C�h�̒�����^�ʂ̑��ʂ��s���B�I�s�I�C�h�ɂ�镛��p������ꍇ�́C����p����s���Ȃ���I�s�I�C�h�̒�����^�ʂʂ��邩�C�܂��́C�I�s�I�C�h�X�C�b�`���O����������B
���Ɍ��ʂ��s�\���ȏꍇ�́C��I�s�I�C�h���ɖ���I�s�I�C�h�ƕ��p�C�I�s�I�C�h�X�C�b�`���O�C���̃I�s�I�C�h��lj��C���^�o�H�̕ύX�C���ɕ⏕����I�s�I�C�h�ƕ��p�C�܂��͐_�o�u���b�N�Ȃǂ���������B
�i2�j�ˏo�ɂ��ɘa����Ă��Ȃ��ꍇ�ˏo�ɂ��ɘa����Ă��Ȃ��ꍇ�́C�\���ł���ˏo�ɁC�\���ł��Ȃ��ˏo�ɁC����ђ莞���ɖ�̐�ڂ̒ɂ݁iend-of-dose failure�j�ɕ��ނ���B�\���ł���ˏo�ɂł́C�U������h��������C�ɂ݂�U������h���̑O�Ƀ��X�L���[��̓��^���s���B�莞���ɖ�̐�ڂ̒ɂ݂ɑ��ẮC������^�ʂ̑��ʁE���^�Ԋu�̒Z�k���s���B��������C�ˏo�ɂɑ��ẮC�I�s�I�C�h�̃��X�L���[��𓊗^����B
���Ɍ��ʂ��s�\���ȏꍇ�́C��I�s�I�C�h���ɖ���I�s�I�C�h�ƕ��p�C���X�L���[��̑��ʁC������^�ʂ̑��ʁC�_�o�u���b�N�Ȃǂ���������B
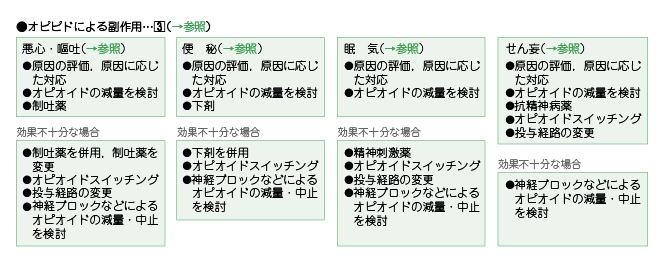
�R�D�I�s�I�C�h�ɂ�镛��p
�I�s�I�C�h�����^���ꂽ���҂ɂ����Ĕ����������ȕ���p�́C���S�E�q�f�C�֔�C���C�C����ςł���B
�I�s�I�C�h�����^������Ă��銳�҂Ɉ��S�E�q�f�C�֔�C���C�C����ς����������́C�Ǐ�̌�����]�����C���Â���������B�I�s�I�C�h�ȊO�ɂ����̏Ǐ���鍇���ǂ������Ƃ��Ȃ����Ƃ��d�v�ł���B�I�s�I�C�h�ɂ��Ǐ�̏ꍇ�́C���^�ʂ����҂ɓK�ł��邩���܂��������C���ʂ���������B
1 �j���S�E�q�f
�I�s�I�C�h�ɂ�鈫�S�E�q�f�ɂ́C�z�肳��鈫�S�E�q�f�̋@���ɍ��킹�Đ��f��i�h�p�~����e�̝h�R��C������従����i��C�܂��͍R�q�X�^�~����j�𓊗^����B���ʕs�\���ȏꍇ�́C���f��p�C���f���ύX�C�I�s�I�C�h�X�C�b�`���O�C���^�o�H�̕ύX�C�_�o�u���b�N�Ȃǂɂ��I�s�I�C�h�̌��ʁE���~�Ȃǂ���������B
2 �j�ց@��
�I�s�I�C�h�ɂ��֔�ɂ́C���܁i�Z���������܁C�܂��͑咰�h�������܁j�𓊗^����B���ʕs�\���ȏꍇ�́C���܂̕��p�C�I�s�I�C�h�X�C�b�`���O�C�_�o�u���b�N�Ȃǂɂ��I�s�I�C�h�̌��ʁE���~����������B
3 �j���@�C
�I�s�I�C�h�ɂ�閰�C�ɂ́C���C�̋��x�Ƌ�ɂ̒��x��]������B���_�h����C�I�s�I�C�h�X�C�b�`���O�C���^�o�H�̕ύX�C�_�o�u���b�N�Ȃǂɂ��I�s�I�C�h�̌��ʁE���~����������B
4 �j�����
�I�s�I�C�h�ɂ�邹��ςɑ��ẮC�R���_�a��̓��^�C�I�s�I�C�h�X�C�b�`���O�C�I�s�I�C�h�̓��^�o�H�̕ύX�̂����ꂩ���s���B���ʕs�\���ȏꍇ�́C�_�o�u���b�N�Ȃǂɂ��I�s�I�C�h�̌��ʁE���~����������B
�S�D�����u�Ƀ}�l�W�����g�ɂ����銳�ҋ���
�u�Ɏ��Â��銳�҂ɑ��ẮC���ҋ�����s���B���ҋ���́C���Ҍʂɉ����āC�p�����čs�����Ƃ��d�v�ł���B������e�Ƃ��ẮC�ɂ݂ƃI�s�I�C�h�Ɋւ��鐳�����m���C�ɂ݂̎��Ìv��ƒ��ɖ�̋�̓I�Ȏg�p���@�C��Ï]���҂ւ̒ɂ݂̓`�����C��Ö@�Ɛ����̍H�v�C�Z���t�R���g���[�����܂߂�B
�T�D����̕a�Ԃɂ��ɂ�
����̕a�Ԃɂ��ɂ݂ɑ��ẮC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Ái�u���ʂ����u�Ɏ��Áv�j�ɉ����āC���ꂼ��̕a�Ԃɂ��������Â���������B
����ɂ��_�o��Q���u�ɂɂ́C���ɕ⏕��i�R��������C�R����CNMDA ��e�̝h�R��C�R�s������C�R���`�R�X�e���C�h�j�̓��^���s���B���ɕ⏕��́C��܂ɐ����₷������p�ƒɂ݂��Ă���a�Ԃ���I������B���ʕs�\���ȏꍇ�ɂ́C���ɕ⏕��̕��p�E�ύX�C�_�o�u���b�N����������B���]�ڂɂ��ɂ݂ɂ́C�\������鐶���\����������������Ńr�X�z�X�z�l�[�g�C�f�m�X�}�u�Ȃǂ�bonemodifying agents�iBMA�j�̓��^�̌�����C�_�o�u���b�N�̓K������Ƃɑ��k����B�㕠���̒ɂ݂ɂ́C���o�_�o�p�u���b�N�Ȃǂ̐_�o�u���b�N�̓K���ɂ��ĂȂ�ׂ����������ɐ��Ƃɑ��k����B�����̒ɂ݂ɂ́C�d���O�u���b�N�C�]�Ԑ_�o�u���b�N�C�_�o���u���b�N�C�N�������t�F�m�[���u���b�N�Ȃǂ̐_�o�u���b�N�̓K������Ƃɑ��k����B��A���̒ɂ݂ɂ́C�T�h���u���b�N�Ȃǐ_�o�u���b�N�̓K������Ƃɑ��k����B���������؏nj�Q�Œ����̝��k���݂���ꍇ�ɂ͋ؒo�ɖ�̓��^���������C�܂��_�o�u���b�N�̓K���ɂ��Đ��Ƃɑ��k����B�����Ǖǂɂ��ɂ݂ɂ́C�����Ǖ���}����i�I�N�g���I�`�h�|�_���C�u�`���X�R�|���~���L�����j�ƃR���`�R�X�e���C�h�̓��^����������B
�i�]�{���̂݁j
�P
���ʂ����u�Ɏ���
�P
���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪��
�� ���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�L���Ȏ��Â͉����H
�֘A����Տ��^��
- ►1���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�s���ׂ��]���͉����H
- ►2���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�A�Z�g�A�~�m�t�F���́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►3���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āCNSAIDs�́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►4���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�����I�s�I�C�h���ɖ�iNSAIDs�E�A�Z�g�A�~�m�t�F���j�́C���̔�I�s�I�C�h���ɖ�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►5�ɂ݂�NSAIDs �����^����Ă��邪�҂ɂ����āC�v���X�^�O�����W�����܁C�v���g���|���v�j�Q��CH2��e�̝h�R��́C�v���Z�{�ɔ�r���Ĉݒ�ᇂ̔�����\�h���邩�H
����
- ►1�ɂ݂̌����̕]���ƒɂ݂̕]�����s���B
- ►2 ���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�A�Z�g�A�~�m�t�F�����g�p����B
1A�i���������C�����G�r�f���X���x���j - ►3���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āCNSAIDs ���g�p����B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►4���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�X�̊��҂ɂ����ėL�����F�e���̂����I�s�I�C�h���ɖ���g�p����B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►5�ɂ݂�NSAIDs �����^����Ă��邪�҂ɂ����āC�v���X�^�O�����W�����܁C�v���g���|���v�j�Q��C���p�ʂ�H2��e�̝h�R��̂����ꂩ���g�p����B
1A�i���������C�����G�r�f���X���x���j
►�Տ��^��P
���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�s���ׂ��]���͉����H
����
�ɂ݂̌����̕]���ƒɂ݂̕]�����s���iⅡ-2 �ɂ݂̕�I�]���̍��Q�Ɓj�B
���
1 �j�ɂ݂̌�����g�̏�����摜��������]������
����ɂ��ɂ݂ł͒��ɖ�̓��^�Ȃǂ̒ɂ݂ɑ��鎡�ÂƂƂ��ɁC�O�Ȏ��ÁC���w�Ö@�C���ː����ÂȂǂ̎�ᇂ��̂��̂ɑ��鎡�Â���������B���Âɂ��ɂ݁i�p��ɏnj�Q�C���w�Ö@��_�o��Q���u�ɂȂǁj�₪��E���ƒ��ڊ֘A�̂Ȃ��ɂ݁i�Ғ��Nj���ǁC�я��v�]�Ȃǁj�ł͌����ɉ��������Â��s���B�ɂ݂��I���R���W�[�G�}�[�W�F���V�[�i�Ґ������nj�Q�C���܁E�ؔ����܁C�����ǁC�����ǂ̕ǁE���E�E�o���Ȃǁj�̏Ǐ�ł��邱�Ƃ�����̂ŁC�ɂ݂̑Ή��݂̂łȂ��C�ɂ݂��Ă���a�Ԃ̔c���ƌ����ւ̑Ή����s���B������u�ɏnj�Q�i�_�o��Q���u�ɁC���]�ڒɁC�㕠���̓����ɁC�����ɁC��A���̒ɂ݁C�����ǕǂȂǁj�̏ꍇ�ɂ͂��ꂼ��̑Ή������������iⅢ-4 �e�����Q�Ɓj�B
2 �j�ɂ݂̕]�����s��
�ɂ݂̓��퐶���ւ̉e���C�ɂ݂̃p�^�[���i�����ɂ��ˏo�ɂ��j�C�ɂ݂̋����C�ɂ݂̕��ʁC�ɂ݂̌o�߁C�ɂ݂̐���C�ɂ݂̑������q�ƌy�����q�ɂ��ĕ]������B
►�Տ��^��Q
���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�A�Z�g�A�~�m�t�F���́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�A�Z�g�A�~�m�t�F���́C�ɂ݂��ɘa����B
���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�A�Z�g�A�~�m�t�F�����g�p����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�n���I���r���[1 ��������B
McNicol ��1�j�ɂ��n���I���r���[�ł́C�A�Z�g�A�~�m�t�F���͂��҂̒ɂ݂ɑ��ăv���Z�{�ɔ�r�����Ɍ��ʂ�������ƌ��_�Â����Ă���B
Stambaugh ��2�j�ɂ��C�]�ڐ���ᇂɂ��ɂ݁i0�`4 ��VRS �Ŗ�2.4�j�̂��邪��29 ���ΏۂɁC�o���A�Z�g�A�~�m�t�F��650 mg/��ƃv���Z�{���r�����������r�����ł́C����6 ���Ԍ�̎��ÑO�Ƃ̒ɂ݂̍��́C�v���Z�{�Q��2.0 �ł��������C�A�Z�g�A�~�m�t�F���Q�ł�2.3 �ƁC�����Ɍ��ʂ��݂�ꂽ�B29 �ᒆ�C����p�i���ÁC���S�C���]�C�߂܂��j���݂�ꂽ�̂́C�v���Z�{�Q��17���C�A�Z�g�A�~�m�t�F���Q��14���ł���C�Q�ԍ��͔F�߂��Ȃ������B
����
�ȏ���C���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�A�Z�g�A�~�m�t�F���́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa����ƍl������B
���������āC�{�K�C�h���C���ł́C���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�A�Z�g�A�~�m�t�F�����g�p���邱�Ƃ𐄏������i�p�ʂɂ��Ă�Ⅱ-4-2-2 �A�Z�g�A�~�m�t�F���̍��Q�Ɓj�B
�����̃K�C�h���C���Ƃ̐�����
NCCN �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�����^����Ă��Ȃ��y�x�̒ɂ݂̂��銳�҂ɑ��ẮC�A�Z�g�A�~�m�t�F���i650 mg ��4 ���Ԗ��C�܂���1,000 mg ��6 ���Ԗ��j�̓��^���������邱�Ƃ���������Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�����^����Ă��Ȃ��y�x�̒ɂ݂̂��銳�҂ɑ��ẮC�A�Z�g�A�~�m�t�F���̓��^���������邱�Ƃ���������Ă���B
►�Տ��^��R
���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āCNSAIDs �́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āCNSAIDs �́C�ɂ݂��ɘa����B
���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āCNSAIDs ���g�p����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�n���I���r���[1 ��������BMcNicol ��3�j�̌n���I���r���[�ł́C�P�^�����̖������r����7 �����܂܂�Ă���CNSAIDs �̓v���Z�{�ɔ�ׂėL���ł���ƌ��_�Â����Ă���B
�Ⴆ�CMoertel ��i1971�j4�j�ɂ�閳�����r�����ł́C�X������ё咰����34 ���ΏۂɁC�A�X�s����650 mg/��C�R�f�C��60 mg/��C�v���Z�{���r�����Ƃ���C���ÑO���u�ɋ��x��6 ���Ԍ��50���ȏ�ቺ�������҂̊����́C�v���Z�{�Q21���ɑ��C�A�X�s�����Q�ł�59���ł������B
Moertel ��i1974�j5�j�ɂ�閳�����r�����ł́C�ɂ݂̂��邪��100 ���ΏۂɁC�A�X�s����650 mg/��ƃv���Z�{���r���C6 ���Ԉȓ����u�ɋ��x���ŏ��ɂȂ������̌������́C�v���Z�{�Q��33���ɑ��āC�A�X�s�����Q�ł�51���ł���C�L�ӂȒ��Ɍ��ʂ��݂�ꂽ�B
Stambaugh ��6�j�ɂ�閳�����r�����ł́C�����u�ɂ̂��銳��160 ���ΏۂɁC�P�g�v���t�F��100 mg/��C�P�g�v���t�F��300 mg/��C�A�X�s�����{�R�f�C���C�v���Z�{���r�����Ƃ���C���^�O���u�ɋ��x�ɑ��铊�^�O����u�ɋ��x�̍��̊����k�i���^�O���u�ɋ��x-���^���u�ɋ��x�j�����^�O���u�ɋ��x�l�́C�v���Z�{�Q��36���ɑ��āC�P�g�v���t�F��100 mg �Q��62���C�P�g�v���t�F��300 mg �Q��54���C�A�X�s�����{�R�f�C���Q��53���ł���C�L�ӂȒ��Ɍ��ʂ��݂�ꂽ�B
����
�ȏ���C���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āCNSAIDs �͒ɂ݂��ɘa����ƍl������B�{�M�ɂ����Ďg�p�\��NSAIDs �ɂ��Ă̌����͌����Ă��邪�C�{�M�ň�ʂɎg�p����Ă���NSAIDs �ɂ��Ă����l�ɗL���ł���ƍl������B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āCNSAIDs ���g�p���邱�Ƃ𐄏�����B
�������C��L�̂�����̌������P�^�̌����ł��邱�Ƃ���C�������^�Ɋւ���L�����ƕ���p�ɂ��Ă͏\�����炩�ɂȂ��Ă��Ȃ����߁C����p�ɂ͒��ӂ���B
�����̃K�C�h���C���Ƃ̐�����
NCCN �̃K�C�h���C���i2012�j�����ESMO �̃K�C�h���C���i2012�j�ł́C�y�x�̂����u�ɂ̑��i�K�Ƃ���NSAIDs �̓��^����������Ƃ���Ă���B
►�Տ��^��S
���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�����I�s�I�C�h���ɖ�iNSAIDs�E�A�Z�g�A�~�m�t�F���j�́C���̔�I�s�I�C�h���ɖ�ɔ�r���Ēɂ݂��ɘa���邩�H
����
���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�����I�s�I�C�h���ɖ��̔�I�s�I�C�h���ɖ�ɔ�r���āC���ɂ݂��ɘa����Ƃ̍����͂Ȃ��B
���ɖ��^����Ă��Ȃ��y�x�̒ɂ݂̂��邪�҂ɑ��āC�X�̊��҂ɂ����ėL�����F�e���̂����I�s�I�C�h���ɖ���g�p����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�������r����11 �����܂ތn���I���r���[1 ��������C����NSAIDs ������NSAIDs �ɔ�r���ėD��Ă��邱�Ƃ��������鍪���͂Ȃ��ƌ��_�Â��Ă���iMcNicol ��7�j�j�B
�Ⴆ�CSaxena ��8�j�ɂ�閳�����r�����ł́C�ɂ݂̂��铪����50 ���ΏۂɁC�o���s���L�V�J���i20 mg ��12 ���Ԗ��j�ƌo���A�X�s�����i500 mg ��6 ���Ԗ��j���r�����Ƃ���C4 ����̒ɂ݂�NRS��1�ɗ��҂̍��͂Ȃ������i7.1��5.2 vs 5.8��3.3�Cp��0.05�j�B����p�Ƃ��āC�A�X�s�����Q�ł�31���Ɍy�x�̏㕔�����Ǐ�Q���݂�ꂽ�̂ɑ��s���L�V�J���Q�ł͔F�߂��Ȃ������ip��0.05�j���C���̑��̕���p�ɍ��͂Ȃ������B
Turnbull ��9�j�ɂ�閳�����r�����ł́C�i�s����28 ���ΏۂɁC�o���i�v���L�Z���i500 mg ��12 ���Ԗ��j�ƌo���A�X�s�����i600 mg ��4 ���Ԗ��j���r�����Ƃ���C���ÑO���VAS��2�̔�i���Ì�7 ���ڂ�VAS�����ÑO��VAS�j�ɗL�Ӎ��͔F�߂��Ȃ������i14�� vs 14���Cp��0.05�j�B����p�͂Ȃ������B
Ventafridda ��i1990a�j10�j�ɂ�閳�����r�����ł́C�i�s����100 ���ΏۂɁC�o���i�v���L�Z���i550 mg ��12 ���Ԗ��j�ƌo���W�N���t�F�i�N�i100 mg ��12 ���Ԗ��j���r�����Ƃ���C14 �����integrated score�i0�`240�C�u�ɋ��x�i5 �i�K�G0�C2.5�C5�C7.5�C10�j�ƒɂ݂̎������ԁi0�`24�j���|�����킹���l�j�̕��ϒl�ɂ����āC���Q�Ԃɍ��͂Ȃ������i44��16 vs 41��17�Cp �l�L�ڂȂ��j�B����p�͑S�̂ňݒ�40���C����31���C�W�X�y�v�V�A�idyspepsia�j26���C���S20���ł���C���҂ŗL�ӂȍ��͂Ȃ������B
Ventafridda ��i1990b�j11�j�ɂ�閳�����r�����ł́C����65 ���ΏۂɁC�i�v���L�Z��250 mg/��i1 ��3 ��j�C�W�N���t�F�i�N100 mg/��i1 ��2 ��j�C�C���h���^�V��50 mg/��i1 ��3 ��j�C�C�u�v���t�F��600 mg/��i1 ��3 ��j�C�A�X�s����600 mg/��i1 ��3 ��j�C�X�����_�N300 mg/��i1 ��2 ��j�C�A�Z�g�A�~�m�t�F��500 mg/��i1 ��3 ��j���r�����Ƃ���C1 �T�Ԃ̒ɂ݂�VAS �̌������́C�i�v���L�Z���Q71���C�W�N���t�F�i�N�Q67���C�C���h���^�V���Q63���C�C�u�v���t�F���Q59���C�A�X�s�����Q40���C�X�����_�N�Q38���C�A�Z�g�A�~�m�t�F���Q27���ł������B����p�́C����39���C���Ă�15���C���S10���ŁC���Ò��~��37���ł������B�i�v���L�Z���C�W�N���t�F�i�N�C�C���h���^�V���͔�r�I�L�����������悤�Ɏv��ꂽ���C�����ꂩ��NSAIDs �����̂��̂ɔ�r���ėD��Ă��邱�Ƃ����_�ł��Ȃ������B
����
�ȏ���C�����Ŏg�p�\��NSAIDs ���܂ގ��̍�����r�����͂قƂ�ǂȂ����ߌ��_�邱�Ƃ͂ł��Ȃ����̂́C�����I�s�I�C�h���ɖ��̔�I�s�I�C�h���ɖ�ɔ�r���āC���Ɍ��ʂƕ���p�ɂ��āC�D��Ă��邱�Ƃ����������͂Ȃ��B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C�X�̊��҂ɂ����āC�L�����F�e���̂����I�s�I�C�h���ɖ���g�p���邱�Ƃ𐄏�����B
����NSAIDs �Œ��Ɍ��ʂ������Ȃ��ꍇ�ɂ́C�I�s�I�C�h�̊J�n���������邱�Ƃ������Ƃ��邪�C�ɂ݂��y�x�ł���ꍇ�ɂ́C����NSAIDs �ւ̕ύX�iNSAIDs �̕ύX��2 ��ނ܂łɂƂǂ߂�j�C���邢�́CNSAIDs �ƃA�Z�g�A�~�m�t�F���Ƃ̕��p���������Ă��悢�B
��1�FNRS�inumerical rating scale�j
�ɂ݂�0 ����10 ��11 �i�K�ɕ����C�ɂ݂��S���Ȃ��̂�0�C�l������Ȃ��ōň��̒ɂ݂�10 �Ƃ��āC�ɂ݂̓_����₤���́B�Q���B
��2�FVAS�ivisual analogue scale�j
100 mm �̐��̍��[���u�ɂ݂Ȃ��v�C�E�[���u�ň��̒ɂ݁v�Ƃ����ꍇ�C���҂̒ɂ݂̒��x��\���Ƃ���Ɉ��t���Ă��炤���́B�Q���B
�m�I��ICOX-2 �j�Q��n
�I��ICOX-2���j�Q��ɂ��ẮC�҂ɂ����ď]����NSAIDs �ɔ�r���Ē��Ɍ��ʂ͓����ł��邱�Ƃ���������Ă��邪�C���҂�ΏۂƂ��Ē��Ɍ��ʂ����������������r�������Ȃ��B���������āC�{�K�C�h���C���ł́C�I��ICOX-2 �j�Q��̒��Ɍ��ʂɂ��Ă͌����̑ΏۂƂ��Ȃ������B
���FCOX-2
�v���X�^�O�����W�������Ɋւ��y�f�B1 �^��2 �^������COX-2 �͉��ǂȂǂ̎h���Ŕ�������B�I��ICOX-2 �j�Q��́C�R���ǁE���ɍ�p������B
�����̃K�C�h���C���Ƃ̐�����
NCCN �̃K�C�h���C���i2012�j�ł́C�X�̊��҂ɂ����ĉߋ��ɗL�����\���F�e�ł��邱�Ƃ��킩���Ă���NSAIDs �ł���C�ǂ�NSAIDs ���g�p���Ă��悢�Ɛ�������Ă���B����ɁC2 ��ނ�NSAIDs �������ȏꍇ�́CNSAIDs �ȊO�̒��ɖ@���Ƃ邱�Ƃ���������Ă���B�܂��CNSAIDs ���L���ł͂��邪�C�d�x�ł͂Ȃ�����p������ꍇ�ɂ́C����NSAIDs �ւ̕ύX���������邱�Ƃ���������Ă���B
►�Տ��^��T
�ɂ݂�NSAIDs �����^����Ă��邪�҂ɂ����āC�v���X�^�O�����W�����܁C�v���g���|���v�j�Q��CH2��e�̝h�R��́C�v���Z�{�ɔ�r���Ĉݒ�ᇂ̔�����\�h���邩�H
����
�ɂ݂�NSAIDs �����^����Ă��邪�҂ɂ����āC�v���X�^�O�����W�����܁C�v���g���|���v�j�Q��C����сC���p�ʂ�H2��e�̝h�R��́C�v���Z�{�ɔ�r���Ĉݒ�ᇂ̔�����\�h����B
�ɂ݂�NSAIDs �����^����Ă��邪�҂ɂ����āC�v���X�^�O�����W�����܁C�v���g���|���v�j�Q��C���p�ʂ�H2��e�̝h�R��̂����ꂩ���g�p����B
���
�{�Տ��^��ɑ��ẮC��������ᇐf�ÃK�C�h���C���i2009�j12�j��p���Č��������B
�v���X�^�O�����W�����܂ɂ��Ă͖��������12 ������ьn���I���r���[13�j����C�v���g���|���v�j�Q��ɂ��Ă͖��������3 ���ƌn���I���r���[����C�v���Z�{�ɔ�r��NSAIDs ��ᇂ�\�h����ƌ��_�Â����Ă���B�܂�H2��e�̝h�R��ɂ��ẮC��p�ʂŗL���ł���Ƃ��������͂Ȃ����Ƃ�6 ���̖���������C�n���I���r���[����x������Ă���C���p�ʂ�H2��e�̝h�R��͈ݒ�ᇂ̗\�h�ɗL���ł��邱�Ƃ��C1 ���̖����������1 ���̌n���I���r���[����x������Ă���B���p�ʂ�H2��e�̝h�R��Ƃ́C��������ᇂ̗p�ʂ�2 �{�ʂ��w���B
����
�ȏ���C�v���X�^�O�����W�����܁C�v���g���|���v�j�Q��C���p�ʂ�H2��e�̝h�R��́CNSAIDs �ɂ���������ᇂ�\�h����ƍl������B�����̍����ƂȂ����Տ������̑Ώۂ͕ό`���ߏǂ�߃��E�}�`�ł���C���҂ɓK���ł���Ƃ͌���Ȃ����C�����u�ɂ�NSAIDs �𓊗^����ꍇ�ɂ����Ă��K�p������ƍl������B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C�����u�ɂ�NSAIDs �𓊗^����ꍇ�ɂ����ẮC�v���X�^�O�����W�����܁C�v���g���|���v�j�Q��C����сC���p�ʂ�H2��e�̝h�R��̂����ꂩ���g�p���邱�Ƃ𐄏�����B
�܂��C�Ö@�݂̂Ȃ炸�CNSAIDs �ɋN�������������ᇂ𑁊��ɔ������邽�߂ɁC�㕠���ɂ̐g�̏����C�w���O���r���l�Ȃǂ����I�Ƀ`�F�b�N���C���Ɍ��ʂ����肵�Ă���CNSAIDs �̌p�����^���K�v�������I�Ɍ������邱�Ƃ��]�܂����B��̓I�ɂ́C���Ɍ��ʂ������Ă���ꍇ�ɂ�NSAIDs ���������ʂ��C���Ɍ��ʂ��ς�炸�����Ă���Ό��ʁE���~����������B�ɂ݂���������ꍇ�ɂ͌p�����^����B
�m�I��ICOX-2 �j�Q��n
�I��ICOX-2 �j�Q��ɂ��ẮC�҂ɂ����āC�]����NSAIDs �ɔ�r���āC�ݏ\��w����ᇂ̔����������Ȃ����Ƃ���������Ă��邪�C���҂Ɋւ���Տ������͂Ȃ��B���������āC�{�K�C�h���C���ł́C�I��ICOX-2 �j�Q��̈ݒ�ᇗ\�h�ɂ��Ă͌����̑ΏۂƂ��Ȃ������B���݂̂Ƃ���C���҂̃��X�N�i�ݒ�ᇂ̊����C�R���`�R�X�e���C�h�̕��p�C����҂Ȃǁj���ʂɕ]�����C���X�N������ꍇ�ɂ͑���NSAIDs �Ɠ����悤�Ɉݒ�ᇂ̗\�h����Ƃ邱�Ƃ��Ó��ł���ƍl������B
�����̃K�C�h���C���Ƃ̐�����
ESMO �̃K�C�h���C���i2012�j�ł́CNSAIDs �́C��������ᇂȂǂ̏d�Ăȕ���p���N��������̂ŁC����I�ȕ���p�Ȃǂ̃`�F�b�N�ƒ������^���T���邱�Ƃ��K�v���Ƃ��Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́CNSAIDs ���^���͏�ɏ�������ᇂɂ��Ċώ@���C�Ǐo������悤�Ȃ�NSAIDs ���p�����ׂ����ǂ������������C�\�Ȃ璆�~���邱�Ƃ���������Ă���B
�i�_�J�_���C�]�{���̂݁j
�y�� ���z
�Տ��^��2
1�j McNicol E, Strassels SA, Goudas L, et al. NSAIDS or paracetamol, alone or combined with opioids, for cancer pain. Cochrane Database Syst Rev 2005�i1�j�FCD005180
2�j Stambaugh JE Jr. Additive analgesia of oral butorphanol/acetaminophen in patients with pain due to metastatic carcinoma. Curr Ther Res 1982�G31�F386-92
�Տ��^��3
3�j McNicol E, Strassels SA, Goudas L, et al. NSAIDS or paracetamol, alone or combined with opioids, for cancer pain. Cochrane Database Syst Rev 2005�i1�j�FCD005180
4�j Moertel CG, Ahmann DL, Taylor WF, Schwartau N. Aspirin and pancreatic cancer pain. Gastroenterology 1971�G60�F552-3
5�j Moertel CG, Ahmann DL, Taylor WF, Schwartau N. Relief of pain by oral medications. A controlled evaluation of analgesic combinations. JAMA 1974�G229�F55-9
6�j Stambaugh JE Jr, Drew J. A double-blind pararell evaluation of the efficacy and safety of a single dose of ketoprofen in cancer pain. J Clin Pharmacol 1988�G28�i12 Suppl�j�FS34-9
�Տ��^��4
7�j McNicol E, Strassels SA, Goudas L, et al. NSAIDS or paracetamol, alone or combined with opioids, for cancer pain. Cochrane Database Syst Rev 2005�i1�j�FCD005180
8�j Saxena A, Andley M, Gnanasekaran N. Comparison of piroxicam and acetylsalicylic acid for pain in head and neck cancers�Fa double-blind study. Palliat Med 1994�G8�F223-9
9�j Turnbull R, Hills LJ. Naproxen versus aspirin as analgesics in advanced malignant disease. J Palliat Care 1986�G1�i2�j�F25-8
10�j Ventafridda V, Toscani F, Tamburini M, et al. Sodium naproxen versus sodium diclofenac in cancer pain control. Arzneimittelforschung 1990a�G40�F1132-4
11�j Ventafridda V, de Conno F, Panerai AE, et al. Non-steroidal antiinflammatory drugs as the first step in cancer pain therapy�Fdouble-blind, within-patient study comparing nine drugs. J Int Med Res 1990b�G18�F21-9
�Տ��^��5
12�j NSAIDs ��ᇁD���{������a�w��ҁD��������ᇐf�ÃK�C�h���C���C�����C��]���C2009
���{�Տ��^��́C��������ᇐf�ÃK�C�h���C���i2009�j���猟���������߁C��������ᇐf�ÃK�C�h���C�����X�V���ꂽ�ꍇ�͍X�V���ꂽ�K�C�h���C�����Q�Ƃ��ꂽ���D
�y�Q�l�����z
�Տ��^��5
13�j Rostom A, Dube C, Wells G, et al. Prevention of NSAID-induced gastroduodenal ulcers. Cochrane Database Syst Rev 2002�i4�j�FCD002296
�Q
��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̒ɂ݂̂��邪��
�� ��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̒ɂ݂̂��邪�҂ɑ��āC�L���Ȏ��Â͉����H
�֘A����Տ��^��
- ►6��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̒ɂ݂̂��邪�҂ɑ��āC�s���ׂ��]���͉����H
- ►7��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̒ɂ݂̂��邪�҂ɑ��āC�I�s�I�C�h�́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►8��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̒ɂ݂̂��邪�҂ɑ��āC����I�s�I�C�h�́C���̃I�s�I�C�h�ɔ�r���Ēɂ݂��ɘa���邩�C����p�����Ȃ����H
- ►9�I�s�I�C�h�̐��܂Ⓤ�^���@�ɂ��C���Ɍ��ʂ╛��p�ɍ������邩�H
- ►9-1�����q�l�̑��������܂́C���������܂ɔ�r���āC�ɂ݂��ɘa���邩�C����p�����Ȃ����H
- ►9-2�����q�l�̂��鏙�������܂́C���̏��������܂ɔ�r���āC�ɂ݂��ɘa���邩�C����p�����Ȃ����H
- ►9-3�����q�l��24 ���ԏ��������܂̒�1 �^�́C��1 �^�ɔ�r���āC�ɂ݂��ɘa���邩�C����p�����Ȃ����H
- ►10�I�s�I�C�h���J�n���鎞�ɁC���f���\�h���^���邱�Ƃ́C���^���Ȃ����Ƃɔ�r���Ĉ��S�E�q�f�����������邩�H
- ►11�I�s�I�C�h���J�n���鎞�ɁC���܂𓊗^���邱�Ƃ́C���^���Ȃ����Ƃɔ�r���ĕ֔�����������邩�H
- ►12��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ����҂ɑ��āC��I�s�I�C�h���ɖ�𒆎~�����ɃI�s�I�C�h���J�n���邱�Ƃ́C��I�s�I�C�h���ɖ�𒆎~���ăI�s�I�C�h���J�n���邱�Ƃɔ�r���Ēɂ݂��ɘa���邩�H
����
- ►6�ɂ݂̌����̕]���ƒɂ݂̕]�����s���B
- ►7 ��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̒ɂ݂̂��邪�҂ɑ��āC�I�s�I�C�h���g�p����B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►8���҂̏�ԁi�\�ȓ��^�o�H�C�����ǁC�����Ǐ�C�ɂ݂̋����Ȃǁj����C�X�̊��҂ɂ��킹���I�s�I�C�h��I������B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►9-1�����x�ȉ������肵�Ă���ɂ݂ł́C�����q�l�̏��������܂Ƒ��������܂̂�������g�p���Ă��悢�B�������C�ɂ݂����x�܂��͕s����ȏꍇ�ɂ͑��������܂⎝�����˂�p����B
2B�i�ア�����C�Ⴂ�G�r�f���X���x���j - ►9-2�����q�l���������܂͂�����̂��̂��g�p���Ă��悢�B
1A�i���������C�����G�r�f���X���x���j - ►9-3�����q�l��24 ���ԏ��������܂͒��C��̂�����ɓ��^���Ă��悢�B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►10�I�s�I�C�h���J�n���鎞�́C���S�E�q�f�ɂ��ď\���Ȋώ@���s���C���S���Ƃ��Đ��f������ł��g�p�ł���ɂ��Ă����C���S�E�q�f���p������ꍇ�͐����Ԓ���I�ɓ��^����B���҂̏�Ԃɂ���ẮC�I�s�I�C�h�̊J�n�Ɠ����ɐ��f������I�ɓ��^���Ă��悢�B
1C�i���������C�ƂĂ��Ⴂ�G�r�f���X���x���j - ►11�I�s�I�C�h���J�n���鎞�́C���҂̔r�֏�Ԃɂ��ď\���Ȋώ@���s���C�����ێ�E�H���w���≺�܂̓��^�ȂǕ֔���Ȃ��悤�ȑΉ����s���B
1C�i���������C�ƂĂ��Ⴂ�G�r�f���X���x���j - ►12��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ����҂̒ɂ݂ɑ��ăI�s�I�C�h���J�n���鎞�ɂ́C��I�s�I�C�h���ɖ�ƕ��p����B
2B�i�ア�����C�Ⴂ�G�r�f���X���x���j
►�Տ��^��U
��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̒ɂ݂̂��邪�҂ɑ��āC�s���ׂ��]���͉����H
����
�ɂ݂̌����̕]���ƒɂ݂̕]�����s���iⅡ-2 �ɂ݂̕�I�]���̍��Q�Ɓj�B
���
1 �j�ɂ݂̌�����g�̏�����摜��������]������
����ɂ��ɂ݂ł͒��ɖ�̓��^�Ȃǂ̒ɂ݂ɑ��鎡�ÂƂƂ��ɁC�O�Ȏ��ÁC���w�Ö@�C���ː����ÂȂǂ̎�ᇂ��̂��̂ɑ��鎡�Â���������B���Âɂ��ɂ݁i�p��ɏnj�Q�C���w�Ö@��_�o��Q���u�ɂȂǁj�₪��E���ƒ��ڊ֘A�̂Ȃ��ɂ݁i�Ғ��Nj���ǁC�я��v�]�Ȃǁj�ł͌����ɉ��������Â��s���B�ɂ݂��I���R���W�[�G�}�[�W�F���V�[�i�Ґ������nj�Q�C���܁E�ؔ����܁C�����ǁC�����ǂ̕ǁE���E�E�o���Ȃǁj�̏Ǐ�ł��邱�Ƃ�����̂ŁC�ɂ݂̑Ή��݂̂łȂ��C�ɂ݂��Ă���a�Ԃ̔c���ƌ����ւ̑Ή����s���B������u�ɏnj�Q�i�_�o��Q���u�ɁC���]�ڒɁC�㕠���̓����ɁC�����ɁC��A���̒ɂ݁C�����ǕǂȂǁj�̏ꍇ�ɂ͂��ꂼ��̑Ή������������iⅢ-4 �e�����Q�Ɓj�B
2 �j�ɂ݂̕]�����s��
�ɂ݂̓��퐶���ւ̉e���C�ɂ݂̃p�^�[���i�����ɂ��ˏo�ɂ��j�C�ɂ݂̋����C�ɂ݂̕��ʁC�ɂ݂̌o�߁C�ɂ݂̐���C�ɂ݂̑������q�ƌy�����q�C���ݍs���Ă��鎡�Â̔����C����сC���X�L���[��̒��Ɍ��ʂƕ���p�ɂ��ĕ]������B
���̑��ɁC���ɁC�I�s�I�C�h�̑I���̂��߂ɁC���ɖ�̓��^���\�Ȍo�H�C�����ǁi���ɐt�@�\��Q�j�C�����Ǐ�i���ɕ֔�C�ċz����j�Ȃǂɂ��ĕ]������B
►�Տ��^��V
��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̒ɂ݂̂��邪�҂ɑ��āC�I�s�I�C�h�́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̒ɂ݂̂��邪�҂ɑ��āC�I�s�I�C�h�́C�ɂ݂��ɘa����B
��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̒ɂ݂̂��邪�҂ɑ��āC�I�s�I�C�h���g�p����B
���
1 �j��I�s�I�C�h���g�p�����ʂ��s�\���ł�����I�s�I�C�h�֕ύX������@
��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̂����u�ɂ����������҂ɑ��āCWHO ���������u�Ɏ��Ö@�ł́C��I�s�I�C�h���g�p���C���ʂ��s�\���ł�����I�s�I�C�h�֕ύX������@�𐄏����Ă���C�����̊ώ@�����ŗL��������������Ă����iⅡ-3 WHO ���������u�Ɏ��Ö@�̍��Q�Ɓj�B
���������āC��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̂����u�ɂ̂��銳�҂ɑ��āC��I�s�I�C�h���g�p�����Ɍ��ʂ��s�\���ł�����I�s�I�C�h�֕ύX������@�́C���S�ŗL���ł���ƍl������B
2 �j���I�s�I�C�h���ŏ����瓊�^������@
����C�����u�ɂ̊��҂ɑ��ċ��I�s�I�C�h���ŏ����瓊�^������@�̗L���������������Տ������Ƃ��āC2 �̖������r����������B
Marinangeli ��1�j�ɂ�閳�����r�����ł́CVAS�i0�`10�j��6 �܂ł̂����u�ɂ̂��銳��100 ���ΏۂɁC��I�s�I�C�h���ɖ�Ǝ�I�s�I�C�h���ŏ��ɓ��^�����ʂ��s�\���ł�����I�s�I�C�h�𓊗^���鎡�ÂƁC���I�s�I�C�h���ŏ����瓊�^���鎡�ÂƂ��r�����Ƃ���C���I�s�I�C�h���ŏ�����g�p�����Q��1 �T�Ԍ�̒ɂ݂�VAS �͂����P�����i���Ì�ω��l�F-2.6 vs -1.9�Cp��0.041�j�B���S�͋��I�s�I�C�h���ŏ�����g�p�����Q�ő����������i437 �� vs 315 ��Cp��0.0001�j�C�q�f�C�֔�C����ςɂ��ėL�Ӎ��͂Ȃ������B������̌Q�ł��d�Ăȕ���p�͐����Ȃ������B
Maltoni ��2�j�ɂ�閳�����r�����ł́C��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ������x�̒ɂ݂̂��邪��54 ���ΏۂɁC��I�s�I�C�h���ŏ��ɓ��^�����ʂ��s�\���ł�����I�s�I�C�h�𓊗^���鎡�ÂƁC���I�s�I�C�h���ŏ����瓊�^���鎡�Â��r�����Ƃ���C���I�s�I�C�h���ŏ�����g�p�����Q�ŁC�ώ@����42 ���ԂŒɂ݂�NRS �̍ő傪5 �_�ȏ�ɂȂ���̊����͗L�ӂɏ��Ȃ��i29�� vs 23���Cp��0.001�j�C7 �_�ȏ�ɂȂ銄�����L�ӂɏ��Ȃ������i11�� vs 8.6���Cp��0.023�j�B�������C�d�x�̐H�~�s�U�C�֔�̕p�x�͂���������I�s�I�C�h���ŏ����瓊�^�����Q�ɑ��������i7.0�� vs 13���C5.9�� vs 18���j�B
�ȏ���C��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ������u�ɂ̂��銳�҂ɑ��ċ��I�s�I�C�h���ŏ����瓊�^������@�́C��I�s�I�C�h���g�p�����Ɍ��ʂ��s�\���ł�����I�s�I�C�h�֕ύX������@�Ɠ��l�Ɉ��S�ŗL���ł��邱�Ƃ����������B
����
�ȏ���C��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̂����u�ɂ̂��銳�҂ɑ��āC��I�s�I�C�h���ŏ��ɓ��^�����Ɍ��ʂ��s�\���ł�����I�s�I�C�h�𓊗^������@�ƁC���I�s�I�C�h���ŏ����瓊�^������@�Ƃ́C��������C���S�ŗL���ł���ƍl������B
���������āC�{�K�C�h���C���ł́C��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̂����u�ɂ̂��銳�҂ɑ��āC�I�s�I�C�h���g�p���邱�Ƃ𐄏�����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��͌y�x�`�����x�̒ɂ݂�����ꍇ�ɃR�f�C���C�g���}�h�[���C��p�ʃ����q�l�i30 mg/���ȉ��j�C��p�ʃI�L�V�R�h���i20 mg/���ȉ��j���J�n���邱�Ƃ��ア�����Ƃ��Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�ɂ݂������x�̏ꍇ�͋��I�s�I�C�h���ŏ��ɓ��^���邱�Ƃ𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�����x�̒ɂ݂ɑ��āC�R�f�C���C�g���}�h�[���Ȃǂ̎�I�s�I�C�h�Ɣ�I�s�I�C�h���ɖ�p���邱�Ƃ𐄏����Ă���B�܂��C��I�s�I�C�h�̑���ɏ��ʂ̋��I�s�I�C�h�Ɣ�I�s�I�C�h���ɖ�p���邱�Ƃ��I���ł���Ƃ��Ă���B
►�Տ��^��W
��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̒ɂ݂̂��邪�҂ɑ��āC����I�s�I�C�h�́C���̃I�s�I�C�h�ɔ�r���Ēɂ݂��ɘa���邩�C����p�����Ȃ����H
����
��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̒ɂ݂̂��邪�҂ɑ��āC����I�s�I�C�h�����̃I�s�I�C�h�ɔ�r���Ă��ɂ݂��ɘa���鍪���͂Ȃ��B����p�Ɋւ��ẮC�I�L�V�R�h���ƃ����q�l�͂قړ����ł���C�t�F���^�j���̓����q�l�ɔ�ׂĕ֔邪���Ȃ��B
���҂̏�ԁi�\�ȓ��^�o�H�C�����ǁC�����Ǐ�C�ɂ݂̋����Ȃǁj����C�X�̊��҂ɂ��킹���I�s�I�C�h��I������B
���
1 �j�I�s�I�C�h�̑I��
�i1�j�R�f�C��
�R�f�C���́CWHO ���������u�Ɏ��Ö@�Ŏg�p�����I�s�I�C�h�̑�\�I�ȖƂ��ċ������Ă���BDhaliwal ��3�j�ɂ�閳����N���X�I�[�o�[��r�����ł́C����35 ���ΏۂɁC�R�f�C������������200�`400 mg/���ƃv���Z�{�Ƃ��r�����Ƃ���C�ɂ݂�VAS �̕��ϒl�̓R�f�C���Q�ŗL�ӂɒႩ�����i22 vs 36�Cp��0.0001�j�B����p�̓R�f�C�����^�Q�ł͕֔�31���C���S40���C���C14���C�q�f14���Ȃǂ�F�߂����C����p�ɂ�鎡�Ò��~�͂Ȃ������B
�ȏ���C�R�f�C���́C��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̂����u�ɂ̂��銳�҂ɑ��āC���S�ŗL���ł���ƍl������B�������C�R�f�C���͎�I�s�I�C�h�ł���C���Ɍ��ʂ������炷���^�ʂɏ�������邽�߁C���x�̒ɂ݂ł͋��I�s�I�C�h���g�p���邱�Ƃ��]�܂����ƍl������B
�i2�j�g���}�h�[��
�g���}�h�[���́CWHO ���������u�Ɏ��Ö@�Ŏg�p�����I�s�I�C�h�̑�\�I�Ȗł���R�f�C���̑�֖Ƃ��ċ������Ă���B�g���}�h�[���̂����u�ɂɑ�����Ɍ��ʂɂ��ẮCTassinari ��4�j���s����18 �̑O���������������͖������r�����i����3,262 ��j��ΏۂƂ����n���I���r���[������B���̂Ȃ������I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��y�x�`�����x�̂����u�ɂ̂��銳�҂ɑ��āC�g���}�h�[���ƃv���Z�{�������͑��̃I�s�I�C�h�̌��ʂƕ���p�ɂ���6 ���̑O����������8 ���̖������r�����i����2,974 ��j����������C�g���}�h�[���͒����x�̂����u�ɂɑ��Ĉ��S�ŗL���ł���ƍl�����邪�C���̃I�s�I�C�h��R�f�C��/�A�Z�g�A�~�m�t�F�����D��Ă���Ƃ������Ƃ������f�[�^�͂Ȃ��ƌ��_�Â��Ă���B
�ȏ���C�g���}�h�[���́C��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��y�x�`�����x�̂����u�ɂ̂��銳�҂ɑ��āC���S�ŗL���ł���ƍl������B�������C�g���}�h�[���͎�I�s�I�C�h�ł���C���Ɍ��ʂ������炷���^�ʂɏ�������邽�߁C���x�̒ɂ݂ł͋��I�s�I�C�h���g�p���邱�Ƃ��]�܂����ƍl������B
�i3�j�����q�l
�����q�l�̂����u�ɂɑ�����Ɍ��ʂɂ��ẮC2 �̌n���I���r���[������BCaraceni ��5�j���s����18 �̗Տ������i����2,053 ��j��ΏۂƂ��čs�����n���I���r���[�ł́C���ׂĂ̎����������q�l�Ƒ��̃I�s�I�C�h�̌��ʂɂ��Ă̌����ł���C�����q�l���v���Z�{�Ɣ�r���������͂Ȃ������B���̌����ł́CWiffen ��6�j���s����54 �̖������r�����i����3,749 ��j��ΏۂƂ��čs�����n���I���r���[�ɒlj�����V�����m���͂Ȃ��Ƃ��Ă���C��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����q�l���g�p���Ă������x�ȏ�̒ɂ݂̂��邪�҂ɑ��āC�o�������q�l�ƃI�L�V�R�h���͓����̌��ʂƕ���p������ƌ��_�Â��Ă���B
�Ⴆ�CWiffen ��6�j���s�����n���I���r���[�Ɋ܂܂�Ă���Mercadante ��7�j�ɂ��O���������ł́C��I�s�I�C�h���ɖ�Œ��Ɍ��ʂ��s�\���Ȓ����x�ȏ�̒ɂ݂̂��銳��110 ���ΏۂɁC����ʂƂ��ă����q�l���������܂�15 mg/���C���X�L���[���1 ���ʂ�1/6 �Ɛݒ肵���Ƃ���C�����q�l���^�ʂ�1 �T�Ԃ�30�i26�`52�jmg/���C4 �T�Ԃ�45�i22�`65�jmg/���܂ő��ʂ��ꂽ�B�ɂ݂̋����́C���ÑONRS6.1�C1 �T�Ԍ�3.2�ip��0.01�j�C4 �T�Ԍ�3.0�ip��0.01�j�ł������B
�ȏ���C��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̂����u�ɂ̂��銳�҂ɑ��āC�����q�l�́C���S�ŗL���ł���ƍl������B
�i4�j�I�L�V�R�h��
�I�L�V�R�h���̂����u�ɂɑ�����ʂɂ��ẮC2 �̌n���I���r���[������BKing ��8�j���s����29 �̃I�L�V�R�h���̂����u�ɂɊւ���Տ����������������n���I���r���[�ł́C1 �̌n���I���r���[�C14 �̖������r�������܂�ł��邪�CReid ��9�j���s�����I�L�V�R�h���̂����u�ɂɑ���n���I���r���[�ɒlj�����V�����m���͂Ȃ������ƌ��_�Â��Ă���B�I�L�V�R�h���Ƒ��̃I�s�I�C�h�̌��ʂ��r����4 �̖������r�����̊���276 ���ΏۂƂ��Č��������Ƃ���C�I�L�V�R�h���́C���Ɍ��ʂƕ���p�Ƃ������q�l�ƍ����Ȃ��ƌ��_�Â����B���̑��ɁCLauretti ��10�j�ɂ�閳�����r�����ł́C����26 ���ΏۂɁC�����q�l���������܂ƃI�L�V�R�h�����������܂��r�����Ƃ���C�����q�l�ƃI�L�V�R�h���̒��Ɍ��ʂ͂قړ����ł������B
�����́C�I�s�I�C�h�����łɓ��^���ꂽ���҂�ΏۂƂ��Ċ܂�ł���C�K�������I�s�I�C�h���^�̊��҂��r���������ł͂Ȃ��B�I�L�V�R�h�����^�̊��҂�ΏۂƂ��������Ƃ��ẮCSilvestri ��11�j�ɂ��O���r����������B�ɂ݂�NRS ��5 �ȏ�̂����u�ɂ̂���390 ���ΏۂɁC�I�L�V�R�h�����������܂�23mg/�����J�n���C�ǍD�Ȓ��Ɍ��ʁi���ONRS ��30���ȏ�̒ቺ�C�܂���7 ���O�̕���NRS ���3 �_�ȏ�ቺ�ƒ�`�j��������܂�24 ���Ԗ���25�`50�����ʂ��s�����Ƃ���C�ɂ݂�NRS �́C���^�O7.2 ����C1 ����4.5�C7 ����2.8�C21 ����2.1�ɉ��P�����B7 ���ڂ̕��ϓ��^�ʂ�32 mg/���ł������B�I�L�V�R�h���ɂ��L�Q���ۂ�4���ɔF�߂��C���S�E�q�f�C�֔邪���������B�d�Ăȕ���p�͔F�߂��Ȃ������B
�ȏ���C��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��C�܂��́C�����x�ȏ�̂����u�ɂ̂��銳�҂ɑ��āC�I�L�V�R�h���́C���S�ŗL���ł���ƍl������B
�i5�j�t�F���^�j��
�t�F���^�j���̒��Ɍ��ʂɊւ��錤���́C①���������܂ő��ʂ��s�������ƂɃt�F���^�j���ƃ����q�l�̌��ʂ��r�������̂ȂǁC����сC②�t�F���^�j���̏��^�̒��Ɍ��ʂ�]���������̂�����B
① ���������܂ő��ʂ��s�������ƂɃt�F���^�j���ƃ����q�l�̌��ʂ��r�������̂Ȃ�
Wong ��12�j�ɂ�閳�����r�����ł́C����47 ���ΏۂɁC�����q�l���������܂ƃt�F���^�j���\�t�܂̌��ʂ��r�����Ƃ���C5 �i�K���u�ɕ]���Œ��Ɍ��ʂɗ��Q�ɗL�Ӎ��͂Ȃ��C������̌Q�ł����Ɍ��ʂ邱�Ƃ��ł����i4.0��0.85 vs 3.9��0.9�j�B���^�ʂ́C�����q�l�Q��156 mg/������174 mg/���ɁC�t�F���^�j���Q��40��g/h ����61��g/h �ɑ������Ă����B���l�ɁCKress ��13�j�ɂ�閳�����r�����ł��C�����u�Ɋ���220 ���ΏۂɁC�}�g���b�N�X�^�t�F���^�j���\�t�܂Ə]���^�t�F���^�j���\�t��/�o�������q�l���܂̌��ʂ��r�����Ƃ���C�ǂ̐��܂��g�p���Ă����Ɍ��ʂƗL�Q���ۂ́C�Ƃ��ɗL�Ӎ��͔F�߂��Ȃ������B
Ahmedzai ��14�j�ɂ�閳�����r�����ł́C48 ���Ԉȏ���p�ʂ̃����q�l�����^����Ă���202 ���ΏۂɁC�����q�l���������܂ƃt�F���^�j���\�t�܂Ƃ̌��ʂ��r�����Ƃ���C���Ɍ��ʂ͓����ŁC�֔�Ɩ��C�̓t�F���^�j���Q�̂ق������Ȃ������i�֔�27�� vs 45���Cp��0.001�C���C34�� vs 44���Cp��0.015�j�B
�܂��C�t�F���^�j���̎������˂ɂ����Ɍ��ʂ�]�����������Ƃ��āCHunt ��15�j�ɂ�閳�����r����������B�z�X�s�X�ɓ��@���̋��I�s�I�C�h�����^����Ă���23 ���ΏۂɁC�����q�l10 mg/���ɑ��铙�͉��̃t�F���^�j����150��g/���Ɛݒ肵��3 ���Ԃ̓����q�l�C����3 ���Ԃ̓t�F���^�j���i�������͔��j�������牺���^�����B���Ɍ��ʁC���S�C����ςɂ��ėL�Ӎ��͔F�߂��Ȃ��������C��Ƀt�F���^�j���𓊗^����C���Ƀ����q�l�����^���ꂽ�Q�ł́C�L�ӂɃt�F���^�j�����^���ɔr�։����������i3 ���Ԃ̕��ϔr�։F�t�F���^�j��3 �� vs �����q�l0 ��Cp��0.015�j�B
�ȏ���C���������܂ő��ʂ��s�������ƂɃt�F���^�j���\�t�܂��g�p������@�́C�����q�l�Ɠ����̒��Ɍ��ʂ�����C�֔邪���Ȃ��\��������ƍl������B
②�t�F���^�j���̏��^�̌��ʂ�]����������
van Seventer ��16�j�ɂ�閳�����r�����ł́C�����x���狭�x�̒ɂ݂̂���I�s�I�C�h�̏��^���邪��131 ���ΏۂɃt�F���^�j���\�t�܂ƃ����q�l���������܂̏��^�̌��ʂ��r�����Ƃ���C���Ɍ��ʂ͓����ŁC�L�Q���ۂɂ�钆�~���܂ގ����̒��~�̓����q�l�Q�ŗL�ӂɑ��������i59�� vs 27���Cp��0.001�j�B�܂��C�����q�l�Q�͎��ÊJ�n��1 �T�Ԃł֔̕�̊��������������i57�� vs 27���Cp��0.003�j�B
Mystakidou ��17�j�ɂ��ώ@�����ł́C����589 ���ΏۂɁC�I�s�I�C�h�̏��^�Ƃ��ăt�F���^�j���\�z��25��g/h �𓊗^���ꂽ����268 �ᒆ�]���\�ł�����153 ���ΏۂɁC���҂����Ɍ��ʂ�4 �i�K�i�����C���ʁC�悢�C�ƂĂ��悢�j�ŕ]�������Ƃ���C�u�悢�v�Ɓu�ƂĂ��悢�v��89���ł������B���^�ł�32���ɗL�Q���ۂ�F�߂����CCTCAE �ɂ��]����Grade 3 �ȏ�̗L�Q���ۂ�F�߂Ȃ������B
Vielvoye-Kerkmeer ��18�j�ɂ��O���r�����ł́C�I�s�I�C�h�̏��^���銳��14 ���ΏۂɁC�t�F���^�j���\�t��25��g/h ���g�p�����B27 ����̓��^�ʂ̒����l��50��g/h �ł���C���Ɍ��ʂ́C���҂�4 �i�K�ŕ]���������ʁC�u�悢�v�Ɓu�ƂĂ��悢�v��71���ł������B��ȕ���p�͕֔�C���S�C�q�f�C���C�ł������B�ċz�}���ȂǏd�Ăȕ���p�݂͂��Ȃ������B
�ȏ���C�m�������m���ł͂Ȃ����C�t�F���^�j���\�t�܂����^�Ƃ��Ďg�p������@�́C���S�ł�����ɂɗL���ȉ\�������邱�Ƃ����������iTassinariD�C200919�j�j�B�������C�{�M�̕ی��K���́u���̃I�s�I�C�h���ɍ܂������ԓ��^����C�E�e�����m�F���ꂽ���҂ŁC���I�s�I�C�h���ɍ܂̌p���I�ȓ��^��K�v�Ƃ�������u�ɂ̊Ǘ��ɂ̂ݎg�p���邱�Ɓv�ƂȂ��Ă���C�����ē\�t�܂͊J�n����Ɗ��҂̏�Ԃɂ�����炸�o��I�ȋz�����������邽�߁C�t�F���^�j���\�t�܂̓I�s�I�C�h�̏��^�Ƃ��Ă͗p���Ȃ��B�o�����^����ŐÖ������^�C�牺���^�̂�������ł��Ȃ��ȂǁC�t�F���^�j���\�t�܂��I�s�I�C�h�̏��^�Ƃ��ėp������Ȃ��ꍇ�ɂ́C�\���Ȋώ@���s���ȂǐT�d�ɑΉ�����B
����
�ȏ���C�R�f�C���C�����q�l�C�I�L�V�R�h���C�t�F���^�j���̂Ȃ��ŁC����I�s�I�C�h�����̃I�s�I�C�h�ɔ�r���Ă��ɂ݂��ɘa���鍪���͂Ȃ��C����������Ɍ��ʂɂ��ē����ł���ƍl������B�܂��C����p�Ɋւ��ẮC�I�L�V�R�h���ƃ����q�l�͂قړ����ł��邪�C�t�F���^�j���̓����q�l�ɔ�ׂĕ֔邪���Ȃ��\��������iTassinari D�C200820�j�j�B
���Ăł́C�����q�l���I�s�I�C�h�̑��I���Ƃ��ċL�ڂ����ꍇ���������C���̎�ȗ��R�́C���Ɍ��ʂ��D��Ă���Ƃ�����������ł͂Ȃ��C�����ł���C�g������Ă��邱�ƂȂǂł���B�������C�{�M�ɂ����āC�����q�l���u�����ł���v�C�����̈�t�ɂƂ��āu�g������Ă���v�Ƃ͕K�����������Ȃ����߁C�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C�����q�l�Ƃ���ȊO�̃I�s�I�C�h�Ƃ̗D��͖��m�ł͂Ȃ��ƍl�����B
���������āC�{�K�C�h���C���ł́C���҂̏�ԁi�\�ȓ��^�o�H�C�����ǁC�����Ǐ�C�ɂ݂̋����Ȃǁj����C�X�̊��҂ɂ��킹���I�s�I�C�h��I�����邱�Ƃ𐄏�����B
2 �j�I�s�I�C�h�̑I���ɂ������Č������鎖��
�I�s�I�C�h�̑I���ɂ������ẮC�\�ȓ��^�o�H�C�����ǁC�����Ǐ�C�ɂ݂̋����Ȃǂ𑍍��I�Ɍ�������B
�i1�j�\�ȓ��^�o�H
���҂ɃI�s�I�C�h�����^�ł��铊�^�o�H�̂����C�ł��ȕւŊ��҂��D�ޓ��^�o�H���瓊�^�ł���I�s�I�C�h��I������B��ʓI�ɂ́C�o�����^��D�悷��B�o�����^���ł��Ȃ��ꍇ�́C�����Ò��E�����牺���C�o�瓊�^�C�܂��́C���������^�̉\�Ȗ�܂�I������B
�i2�j������
�t�@�\��Q�̂��銳�҂ł́C�����q�l�ƃR�f�C���͔����邱�Ƃ��]�܂����iⅡ-4-1-7-1 �t�@�\��Q�̍��Q�Ɓj�B
�i3�j��������Ǐ�
�����֔�⒰従���ቺ�����邱�Ƃ������K�v������a�Ԃł́C�t�F���^�j�����]�܂����B�܂��C�ċz������ɘa������ʂ����邱�Ƃ��m�F����Ă���I�s�I�C�h�͍��̂Ƃ��냂���q�l�ł��邽�߁iBen-Aharon ��j�C�ċz�������ꍇ�ɂ̓����q�l���]�܂����B
�i4�j�ɂ݂̋���
�t�F���^�j���\�t�܂̌��ʔ����͓\�t�J�n��12�`14���Ԍ�ł���C���^�ʂ̐v���ȕύX��������߁C�ɂ݂��s����ȏꍇ�ɂ͌����Ƃ��Ďg�p���Ȃ��B�R�f�C���͎�I�s�I�C�h�ł���L�����E�����邱�Ƃ���C���x�̒ɂ݂ł͋��I�s�I�C�h���g�p����B
�����̃K�C�h���C���Ƃ̐�����
�I�s�I�C�h�̑I��
EAPC �̃K�C�h���C���i2012�j�ł́C�R�f�C���������̓g���}�h�[���C����ɑ�֖�Ƃ��ă����q�l30 mg/���ȉ��C�������̓I�L�V�R�h��20 mg/���ȉ��𐄏����Ă���B�Ȃ��C�{�K�C�h���C���ł͓��^�ʂɂ��I�s�I�C�h�̕��ނ��s���Ă��Ȃ��B
NCCN �̃K�C�h���C���i2012�j�ł́C�����x�ȏ�̒ɂ݂ɑ��ă����q�l���������܂𐄏����C�����q�l�ȊO�ɗ��p�\�ȃI�s�I�C�h�Ƃ��ăR�f�C���C�I�L�V�R�h���C�t�F���^�j���\�t�܁i�ɂ݂����肵�Ă���ꍇ�j�Ȃǂ������Ă���B�g���}�h�[���͎�I�s�I�C�h�Ƃ��Ďg�p�ł��邪�C�ő�ʁi400 mg/���j���g�p���Ă������q�l�Ȃǂ̋��I�s�I�C�h�Ɠ����̌��ʂ͖]�߂Ȃ��Ƃ��Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�R�f�C����g���}�h�[���̂悤�Ȏ�I�s�I�C�h�Ɣ�I�s�I�C�h���ɖ�p�C�������̓����q�l�Ȃǂ̋��I�s�I�C�h���p�ʂ���g�p���邱�Ƃ𐄏����Ă���B
►�Տ��^��X
�I�s�I�C�h�̐��܂Ⓤ�^���@�ɂ��C���Ɍ��ʂ╛��p�ɍ������邩�H��
►9-1
�����q�l�̑��������܂́C���������܂ɔ�r���āC�ɂ݂��ɘa���邩�C����p�����Ȃ����H
����
���p�ʂ̃����q�l�̑��������܂Ə��������܂Ƃł́C���Ɍ��ʂƕ���p�ɗՏ��I�ɈӖ��̂��鍷�͂Ȃ��B��p�ʂ̃����q�l�̑��������܂Ə��������܂ƂŁC���Ɍ��ʂƕ���p�ɍ������邩�f�ł��邾���̏\���ȍ������Ȃ��B
�����x�ȉ������肵�Ă���ɂ݂ł́C�����q�l�̏��������܂Ƒ��������܂̂�������g�p���Ă��悢�B�������C�ɂ݂����x�܂��͕s����ȏꍇ�ɂ͑��������܂⎝�����˂�p����B
►9-2
�����q�l�̂��鏙�������܂́C���̏��������܂ɔ�r���āC�ɂ݂��ɘa���邩�C����p�����Ȃ����H
����
�����q�l���������܂ł͒��Ɍ��ʂƕ���p�ɗՏ��I�ɈӖ��̂��鍷�͂Ȃ��B
�����q�l���������܂͂�����̂��̂��g�p���Ă��悢�B
►9-3
�����q�l��24 ���ԏ��������܂̒�1 �^�́C��1 �^�ɔ�r���āC�ɂ݂��ɘa���邩�C����p�����Ȃ����H
����
�����q�l��24 ���ԏ��������܂̒�1 �^�Ɩ�1 �^�Ƃł́C���Ɍ��ʂƕ���p�ɗՏ��I�ɈӖ��̂��鍷�͂Ȃ��B
�����q�l��24 ���ԏ��������܂͒��C��̂�����ɓ��^���Ă��悢�B
���{�Տ��^��Ɋւ���Տ������Ƃ��Ă̓����q�l�ȊO��ΏۂƂ������̂͂Ȃ��������߃����q�l�ɂ��Č��������B
���
9-1�@�����q�l�̑��������܂Ə��������܂Ƃ̔�r
�{�Տ��^��Ɋ֘A�����Տ������Ƃ��ẮC2 �̌n���I���r���[������BWiffen ��21�j�̌n���I���r���[�ł́C�����q�l�̑��������܂Ə��������܂Ƃ̌��ʂ��r����15 �̖������r�����i����460 ��j���������C���������܂������^�Ƃ������ẤC���������܂������^�Ƃ������ÂƁC���Ɍ��ʂƕ���p�̓_�œ����ł���ƌ��_�Â����B
Klepstad ��i2011�j22�j�̌n���I���r���[�ł́C�����x�`���x�̂����u�ɂ̂��銳�҂ɑ��āC���I�s�I�C�h�̐��܂���ѓ��^���@�̌��ʂ��r����15�̖������r�����i����1,747 ��j���������C���̂Ȃ���Klepstad ��i2003�j�ɂ�閳�����r�������C�����q�l�̑��������܂Ə��������܂Ƃ̌��ʂ��r���Ă���Ƃ��Ă���B���̖������r�����ł́C��I�s�I�C�h�̓��^���Ă��邪��40 ���ΏۂƂ��āC�����q�l�̑��������܂Ə��������܂̒��Ɍ��ʂ��r�����B60 mg/�����J�n���C�ɂ݂����S�ɏ��������܂�90�C120�C180�C270�C360 mg/���Ƒ��ʂ���v��Ƃ����Ƃ���C�ɂ݂����������܂ŗv�������ԂƓ��^�ʂ́C���������܁i2.1 ���C94 mg�j�Ə��������܁i1.7 ���C82 mg�j�ŗL�Ӎ����Ȃ������B�ɂ݂�VAS �͂�����̌Q�ł��ቺ�����i62��26 vs 55��22�Cp �l�L�ڂȂ��j�B���S�C�֔�C�����ɂ��Ă��L�Ӎ��͂Ȃ������B
�������C�����̌����Ŏg�p���ꂽ���������܂̊J�n�ʂ�60 mg/���ȏ�̂��̂������C��p�ʂ̏��������܂��g�p�����ꍇ�f�ł��邾���̌������Ȃ��B
����
�ȏ���C60 mg/���ȏ�̏ꍇ�C�����q�l�̑��������܂Ə��������܂Ƃł́C���Ɍ��ʂƕ���p�ɗՏ��I�ɖ��炩�ȍ��͂Ȃ����C����ȉ��̏ꍇ�ł͑��������܂Ə��������܂ƂŁC���Ɍ��ʂƕ���p�ɍ������邩�f�ł��邾���̏\���ȍ������Ȃ��ƍl������B
���Ăł́C�I�s�I�C�h���J�n���鎞�́C�����q�l���������܂���Ɍ�������ׂ��ł���Ƃ�����̂��������C���̍����G�r�f���X�Ɏx�����ꂽ���̂ł͂Ȃ��B�o�����^�̉�������Ɗ��҂̃A�h�q�A�����X�����ቺ���邱�Ƃ��\������C����ɖ{�M�ł́C�����q�l���������܂����̃I�s�I�C�h�ɔ�r���đ����̈�t�ɂƂ��āu�ł��g������Ă���v�Ƃ͕K�����������Ȃ��B�܂��C�����x�ȉ������肵�Ă���ɂ݂̊��҂ɂ����ẮC������^��Ƃ��ď��������܂�p���Ă��C���X�L���[��Ƃ��đ��������܂�p���邱�Ƃɂ��C�\���Ȓ��Ɍ��ʂ�������ƍl������B���������āC�I�s�I�C�h�̊J�n�̏ꍇ�Ƀ����q�l���������܂��g�p���邱�Ƃ������Ƃ��闘�_�͑傫���Ȃ��ƍl������B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂƂ��āC�����x�ȉ������肵�Ă���ɂ݂ł́C���������܂Ƒ��������܂̂�������g�p���Ă��悢�ƍl�����B�������C���������܂�p���鎞�ɂ́C���X�L���[��Ƃ��đ��������܂�K���g�p����B����C�ɂ݂����x�܂��͕s����ȏꍇ�ɂ͑��₩�ɑ��ʂ��s���C���Ɍ��ʂɕK�v�ȃI�s�I�C�h���^�ʂf���邱�Ƃ̂ł��鑬�������܂⎝�����˂�p���邱�Ƃ𐄏�����B
���F�A�h�q�A�����X
���҂���̂ƂȂ��Ď��Õ��j�̌���ɎQ�����C���̌���ɏ]���Ď��Â��邱�ƁB�]���g���Ă����R���v���C�A���X�i����j������Â̎�̂����ґ��ɒu�����l�����B
9-2�@�����q�l���������܊Ԃ̔�r
��{�Տ��^��Ɋ֘A�����Տ������Ƃ��ẮC1 �̌n���I���r���[������BWiffen ��21�j�̌n���I���r���[�ł́C�����̃����q�l���������܂̌��ʂ��r����12 �̖������r�����i����1,010 ��j�������������ʁC���������܂̂����ꂪ���̂��̂ɗD��Ă���Ƃ̍����͂Ȃ��C������������ł���ƌ��_�Â����B�Ⴆ�CHagen ��ɂ�閳����N���X�I�[�o�[��r�����ł́C�ɂ݂̂��邪��29 ���ΏۂɁC�����q�l��24 ���ԏ��������܂�12 ���ԏ��������܂̌��ʂ��r�����Ƃ���C���Ì�̒ɂ݂�VAS �͗��Q�ō����Ȃ������i�ŏ��F13�}15 vs 9.6�}8.8�Cp��0.15�C�ő�F36�}23 vs 30�}17�Cp��0.14�j�B
����
�ȏ���C�����ŗ��p�ł��邷�ׂĂ̏��������܂ŏ\���Ȍ���������킯�ł͂Ȃ����̂́C�قȂ郂���q�l���������܂Œ��Ɍ��ʂƕ���p�ɗՏ��I�ɈӖ��̂��鍷�͂Ȃ��ƍl������B���������āC�{�K�C�h���C���ł́C�����q�l���������܂͂�����̂��̂��g�p���Ă��悢�Ɛ�������B
9-3�@�����q�l��24 ���ԏ��������܂̒�1 �^�Ɩ�1 �^�̔�r
�{�Տ��^��Ɋ֘A�����Տ������Ƃ��ẮC1 �̖������r����������B
Currow ��23�j�ɂ�閳�����r�����ł́C�����u�ɂł��łɃI�s�I�C�h����������Ă��銳��42 ���ΏۂɁC�����q�l��24 ���ԏ��������܂ƃv���Z�{���g�p���C���C��o�����^�ł̒��Ɍ��ʂ̈Ⴂ���r�����Ƃ���C1 �T�Ԍ�̒ɂ݂�VAS �͒��o�����^�Q��16 mm�C��o�����^�Q��14 mm �ƗL�Ӎ��͂Ȃ������ip��0.34�j�B
����
�ȏ���C����ꂽ�m���ł��邪�C�����q�l��24 ���ԏ��������܂̒�1 �^�Ɩ�1 �^�Ƃł́C���Ɍ��ʂƕ���p�ɍ��͂Ȃ����Ƃ����������B�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C�����q�l��24 ���ԏ��������܂͒��C��̂�����ɓ��^���Ă��悢�Ɛ�������B�������C�X�̊��҂ɂ����āC�\������錌���Z�x���Q�l�ɂ��āC�Տ��Ǐ���m���߂Ȃ��瓊�^���Ԃ�ύX���邱�Ƃ�W������̂ł͂Ȃ��B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�����q�l��I�L�V�R�h���̑��������܂Ə��������܂́C������^���J�n����ꍇ�̖�܂Ƃ��Ă�����������Ƃ���Ă���B�܂��C�^�C�g���[�V�����̂��߂ɁC�K�v�ɉ����Ċe���܂̑��������܂��g����悤�ɂ���ׂ��ł���Ƃ��Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�J�n���ɂ͑��������܂̎g�p�𐄏����Ă���B
EAPC �̃K�C�h���C���i2012�j�ł́C�����̃����q�l�̏��������܂̔�r�ɂ��Č��y���Ă��Ȃ��B
24 ���ԏ��������܂̒��铊�^�ɂ��Č��y���Ă���K�C�h���C���͂Ȃ��B
►�Տ��^��10
�I�s�I�C�h���J�n���鎞�ɁC���f���\�h���^���邱�Ƃ́C���^���Ȃ����Ƃɔ�r���Ĉ��S�E�q�f�����������邩�H
����
�I�s�I�C�h���J�n���鎞�ɁC���f���\�h���^���邱�Ƃ��C���^���Ȃ����Ƃɔ�r���Ĉ��S�E�q�f�����������邱�Ƃ����������͂Ȃ��B
�I�s�I�C�h���J�n���鎞�́C���S�E�q�f�ɂ��ď\���Ȋώ@���s���C���S���̓ڗp�Ƃ��Đ��f������ł��g�p�ł���ɂ��Ă����B���S�E�q�f���p������ꍇ�͐����Ԓ���I�ɓ��^����B���҂̏�Ԃɂ���ẮC�I�s�I�C�h�̊J�n�Ɠ����ɐ��f������I�ɓ��^���Ă��悢�B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�������r�����C���̍����O���r�� ���̂�������Ȃ��B���Ȃ킿�C�I�s�I�C�h���J�n���鎞�ɁC���f���\�h���^���� ���Ƃ��C���^���Ȃ����Ƃɔ�r���Ĉ��S�E�q�f�����������邱�Ƃ��\�ł��邩�� �s���ł���B
�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C�I�s�I�C�h���J�n���鎞�́C���S�E�q�f�ɂ��ď\���Ȋώ@���s���C���S���̓ڗp�Ƃ��Đ��f������ł��g�p�ł���ɂ��Ă����C���S�E�q�f���p������ꍇ�͐����Ԓ���I�ɓ��^���邱�Ƃ𐄏�����B
�������C���f��ɂ�萶�����镛��p�i���C�C�ӂ���C�p�[�L���\���nj�Q�C�A�J�V�W�A�Ȃǁj�̉\�������C���S�E�q�f��\�h���闘�v������ƍl�����銳�҂ł́C�I�s�I�C�h�̊J�n�Ɠ����ɐ��f��̒���I�ȓ��^���������Ă��悢�B���̗��R�́C①���S�E�q�f�̓I�s�I�C�h�̃A�h�q�A�����X������������̂ŁC�ϋɓI�ɗ\�h����ق����悢�C②���f��̒Z���Ԃ̓��^�ɂ�萶������Q��舫�S�E�q�f��\�h�ł���L�v���������ꍇ������ƍl�����邽�߂ł���B���̂悤�ȏꍇ�Ƃ��āC�����킪��≻�w�Ö@���Ă���ȂǁC���S�E�q�f���₷�����҂���������B�I�s�I�C�h�J�n���ɐ��f������I�Ɏg�p�����ꍇ�ɂ́C�I�s�I�C�h�̈��S�E�q�f�ɑ��Ă͑ϐ��������邽�߁C���^��1�`2 �T�ԂŌ��ʁE���~���邱�Ƃ��������C���R�ƒ������^�ɂȂ�Ȃ��悤�ɂ���B
�g�p���鐧�f��́C�h�p�~����e�̝h�R��i�n���y���h�[���C�v���N�����y���W���j�C������従����i��i���g�N���v���~�h�C�h���y���h���j�C�܂��́C�R�q�X�^�~����̂����ꂩ��I������B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�����ESMO �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�J�n���̐��f��̗\�h���^�ɂ��Ă͋L�ڂ���Ă��Ȃ����C���S���������ꍇ�ɂ́C�n���y���h�[���Ȃǂ̍R�h�p�~�����g�N���v���~�h�Ȃǂ̐��f��őΉ�����Ƃ��Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�J�n���ɐ��f���p�ł���悤�ɂ��Ă������Ƃ𐄏����Ă���B���Ȃ킿�C�I�s�I�C�h�̏����Ɠ����ɐ��f����������C���S���̓ڗp�C�܂��́C���S���p������ꍇ�͐����Ԓ�����^���邱�Ƃ𐄏����Ă���B
| �K�C�h���C�� | �I�s�I�C�h�J�n���� ���f��̗\�h |
���^�g�p���鐧�f�� |
|---|---|---|
| EAPC �̃K�C�h���C�� | �L�ڂ͂Ȃ� | ���g�N���v���~�h�C�n���y���h�[���Ȃǁi������̐��f�ł��L�p���Ƃ��������͎�����Ă��Ȃ��j |
| ESMO �̃K�C�h���C�� | �L�ڂ͂Ȃ� | ����̖�ܖ��̋L�ڂ͂Ȃ� |
| NCCN �̃K�C�h���C�� | �I�s�I�C�h�J�n���ɐ��f���p�ł���悤�ɂ��Ă��� | �v���N�����y���W���C�n���y���h�[���C���g�N���v���~�h�i���ʂ��Ȃ��ꍇ�́C�Z���g�j���h�R��j |
►�Տ��^��11
�I�s�I�C�h���J�n���鎞�ɁC���܂𓊗^���邱�Ƃ́C���^���Ȃ����Ƃɔ�r���ĕ֔�����������邩�H
����
�I�s�I�C�h���J�n���鎞�ɁC���܂𓊗^���邱�Ƃ́C���^���Ȃ����Ƃɔ�r���ĕ֔�����������鍪���͂Ȃ��B
�I�s�I�C�h���J�n���鎞�́C���҂̔r�֏�Ԃɂ��ď\���Ȋώ@���s���C�����ێ�E�H���w���≺�܂̓��^�ȂǕ֔������Ȃ��悤�ȑΉ����s���B
���F�֔�̒�`
�֔�Ƃ́u���Ǔ��e���̒ʉ߂��x���E����C�r�ւɍ������ԁv���w���B�r�ւ̏K���͌l�����傫�����߁C���Ƃ��Ƃ̔r�֏K���Ɣ�r���C�r�։̒ቺ�C�ւ̗ʂ̌�����d���C�c�֊��C�r�ւ̍���Ȃǂ��画�f����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�������r�����C���̍����O���r�����̂�������Ȃ��B���Ȃ킿�C�I�s�I�C�h���J�n���鎞�ɁC���܂𓊗^���邱�Ƃ́C���^���Ȃ����Ƃɔ�r���ĕ֔�����������邱�Ƃ��\�ł��邩�͕s���ł���B
�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C�I�s�I�C�h���J�n���鎞�ɂ́C���҂̔r�֏�Ԃ��ώ@���C�֔���Ȃ��悤�ɐ����ێ�E�H���w���≺�܂̓��^�ȂǑΉ����s�����Ƃ𐄏�����B���Ȃ킿�C�ւ���炩�������艺�������Ă��銳�҂ł́C�I�s�I�C�h�J�n���ɉ��܂̒���I�ȕ��p�͕K�������K�v�Ȃ����C���^��֔邪������\����O���ɒu���C���҂̔r�֏�Ԃ��ώ@����B���Ƃ��ƕ֔�X���̂��銳�҂�C�o�������q�l�܂��͌o���I�L�V�R�h���𓊗^���銳�҂ȂǕ֔����\���������ƍl������ꍇ�ɂ́C�I�s�I�C�h�̊J�n���ɉ��܂����I�ɓ��^���C���҂̔r�֏�Ԃ��ώ@���Ē��߂���B
�����̗��R�́C①�֔�͕p�x�̍����Ǐ�ł���C�I�s�I�C�h�̃A�h�q�A�����X������������̂ŁC�ϋɓI�ɗ\�h����ق����悢�C②���܂̓��^���܂ޕ֔�̗\�h�ɂ�萶������Q���L�v���������ꍇ�������ƍl�����邽�߂ł���B
���܂Ƃ��āC�ւ̍d���ɉ����āC�ւ��炩������Z���������܁i�_���}�O�l�V�E���C���N�c���[�X�j��C��従��^���𑣐i������咰�h�������܂́i�s�R�X���t�@�[�g�i�g���E���C�Z���m�V�h�j���g�p����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�ɂ���Đ������֔�̎��ÁC�܂��̓I�s�I�C�h�ɂ���Đ�����֔�̗\�h�Ƃ��āC���܂��������Ă������Ƃ𐄏����Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�֔��h�����߂ɁC�����E�H���@�ۂ̐ێ�≺�܂̓��^���܂ށu�\�h�I�ȑ�v�𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�֔邪�悭���镛��p�ł���Ƃ����F���̂��ƂɁC�K�X���܂��g�p����ƋL�ڂ���Ă���B
| �K�C�h���C�� | �I�s�I�C�h���J�n���� ���܂̒���I�ȕ��p |
�g�p���鉺�� |
|---|---|---|
| EAPC �̃K�C�h���C�� | �֔�̗\�h��Ƃ��ĉ��܂��������Ă������Ƃ𐄏� | ����̖�ܖ��̋L�ڂ͂Ȃ����C1 ��ނ̉��܂��g�p��������قȂ��ނ̉��܂p����ق��������ʂ��݂��₷�� |
| ESMO �̃K�C�h���C�� | ���m�ȋL�ڂ͂Ȃ� | ����̖�ܖ��̋L�ڂ͂Ȃ� |
| NCCN �̃K�C�h���C�� | �����E�H���@�ۂ̐ێ�C���܂̓��^���܂߂ė\�h�I����Ƃ� | �h�������܂Ɖ��މ��܂��g�p���� |
►�Տ��^��12
��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ����҂ɑ��āC��I�s�I�C�h���ɖ�𒆎~�����ɃI�s�I�C�h���J�n���邱�Ƃ́C��I�s�I�C�h���ɖ�𒆎~���ăI�s�I�C�h���J�n���邱�Ƃɔ�r���Ēɂ݂��ɘa���邩�H
����
��I�s�I�C�h���ɖ�ŏ\���Ȓ��ɂ������Ȃ����҂ɑ��āC��I�s�I�C�h���ɖ�𒆎~�����ɃI�s�I�C�h���J�n���邱�Ƃ́C���Ɍ��ʂ𒆓��x���P����B
��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ����҂̒ɂ݂ɑ��ăI�s�I�C�h���J�n���鎞�ɂ́C��I�s�I�C�h���ɖ�ƕ��p����B
���
�{�Տ��^��Ɋւ��閳�����r�����͂Ȃ��B�֘A����Տ������Ƃ���NSAIDs �̌��ʂ��r����1 ���̌n���I���r���[�ƁC�I�s�I�C�h���g�p���Ă��銳�҂ɑ��āC��I�s�I�C�h���ɖ����悹���ĕ��p���邱�Ƃɂ����Ɍ��ʂ��r����3 ���̖������r����������B
McNicol ��24�j�̌n���I���r���[�ł́C�����u�ɂ̂��銳�҂ɑ���NSAIDs �̌��ʂ��r����42 ���i����3,084 ��j�̌������������Ă���C���̂Ȃ��ŃI�s�I�C�h���g�p���Ă��銳�҂ɑ���NSAIDs �p����ꍇ�ƕ��p���Ȃ��ꍇ�̌��ʂ��r����6 ���̌�������������Ă���B�Ⴆ�CBjörkman ��25�j�ɂ��C�����q�l�������^���s���Ă���16 ���ΏۂɁC�W�N���t�F�i�N����50 mg/���ƃv���Z�{�̕��p���r�����������r�����ł́C2 ����̒ɂ݂�VAS �̉��P���̓W�N���t�F�i�N�Q�ł�荂���C�����q�l�g�p�ʂ���菭�Ȃ��Ȃ����i96 mg/����83 mg/�� vs 96 mg/����95 mg/���Cp��0.01�j�B
�܂��C�n���I���r���[�Ɋ܂܂�Ă��Ȃ�3 ���̖������r�����Ƃ��āCMercadante ��26�j�ɂ�閳�����r�����ł́C����156 ��i��͑Ώۂ�47 ��j��ΏۂɁC�I�s�I�C�h�P�܂�ketorolac 60 mg/���ƃI�s�I�C�h�Ƃ̕��p�Ƃ��r�����Ƃ���C3 �T�Ԍ�̒ɂ݂�NRS �͗��Q�ő����������Cketorolac ���p�Q�ł̓����q�l�̎g�p�ʂ���菭�Ȃ������B�ɂ݂ɑ傫�ȍ��͂Ȃ��C�֔�͌��������C�ݕ��s���igastric discomfort�j�̕p�x���㏸�����B
Stambaugh ��27�j�ɂ�閳�����r�����ł́C�I�L�V�R�h���ƃA�Z�g�A�~�m�t�F�����^���̍��]�ڒɂ�L���邪��30 ���ΏۂɁC�C�u�v���t�F��600 mg �̏�悹���ʂ��r�����Ƃ���C�����u�ɋ��x�̓C�u�v���t�F���Q�ŒႭ�i���l�̋L�ڂȂ��Cp��0.05�j�C�I�L�V�h�R���̎g�p�ʂ����Ȃ������B
Stockler ��28�j�ɂ�閳�����r�����ł́C���I�s�I�C�h���g�p���Ă��邪��30 ���ΏۂɁC�A�Z�g�A�~�m�t�F��5,000 mg/���ƃv���Z�{�̕��p���r�����Ƃ���C�A�Z�g�A�~�m�t�F���Q���ɂ݂������P�����k���^�J�n2 ���ڂ�4 ���ڂ̒ɂ݂�NRS �̕��ύ���0.4�i95���M����Ԃł�0.1�`0.8�j�Cp��0.03�l�B
����
�ȏ���C��I�s�I�C�h���ɖ�𓊗^����Ă��銳�҂ɃI�s�I�C�h���J�n����ꍇ�ɁC��I�s�I�C�h���ɖ�𒆎~�����ꍇ�ƒ��~�����ɕ��p�����ꍇ�̂ǂ��炪���Ɍ��ʂ��悢���͕s���ł���B�������CNSAIDs �ł͏����ǂւ̗L�Q��p�̕p�x����������\�������邪�C�I�s�I�C�h�ɂ���u�Ɏ��Â��s���Ă��銳�҂ɔ�I�s�I�C�h���ɖ����悹���邱�Ƃ́C�����x�̒��Ɍ��ʂ�����ƍl������B
���������āC�{�K�C�h���C���ł́C��L�̒m���Ɛ��Ƃ̍��ӂɂ��C��I�s�I�C�h���ɖ�ŏ\���Ȓ��Ɍ��ʂ������Ȃ����҂̒ɂ݂ɑ��ăI�s�I�C�h���J�n���鎞�ɂ́C��I�s�I�C�h���ɖ�𒆎~�����ɕ��p���邱�Ƃ𐄏�����B�������C���Ɍ��ʂ͒����x�ł���CNSAIDs �ł͏����ǂւ̗L�Q��p�Ȃǂ̕���p�̏o���p�x�������Ȃ�\�������邽�߁C�������^�͒��Ɍ��ʂƕ���p��]�����Ĕ��f����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�ɂ݂̉��P�܂��͕K�v�Ƃ���I�s�I�C�h�ʂ̌��ʂ̂��߂ɁC���I�s�I�C�h�ɔ�I�s�I�C�h���ɖ�p���邱�Ƃ��ア�����Ƃ��Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C��I�s�I�C�h�Ɣ�I�s�I�C�h���ɖ�p���邱�Ƃ������������C��I�s�I�C�h�̑���ɏ��ʂ̋��I�s�I�C�h�Ɣ�I�s�I�C�h���ɖ�p���邱�Ƃ��������Ă���B
�i�l��@�~�C�R�{�@���j
�y�� ���z
�Տ��^��7
1�j Marinangeli F, Ciccozzi A, Leonardis M, et al. Use of strong opioids in advanced cancer pain�Fa randomized trial. J Pain Symptom Manage 2004�G27�F409-16
2�j Maltoni M, Scarpi E, Modonesi C, et al. A validation study of the WHO analgesic ladder�Fa two-step vs three-step strategy. Support Care Cancer 2005�G13�F888-94
�Տ��^��8
3�j Dhaliwal HS, Sloan P, Arkinstall WW, et al. Randomized evaluation of controlled-release codeine and placebo in chronic cancer pain. J Pain Symptom Manage 1995�G10�F612-23
4�j Tassinari D, Drudi F, Rosati M, et al. The second step of the analgesic ladder and oral tramadol in the treatment of mild to moderate cancer pain�Fa systematic review. Palliat Med 2011�G25�F410-23
5�j Caraceni A, Pigni A, Brunelli C. Is oral morphine still the first choice opioid for moderate to severe cancer pain? A systematic review within the European Palliative Care Research Collaborative guidelines project. Palliat Med 2011�G25�F402-9
6�j Wiffen PJ, McQuay HJ. Oral morphine for cancer pain. Cochrane Database Syst Rev 2007�i4�j�FCD003868
7�j Mercadante S, Porzio G, Ferrera P, et al. Low morphine doses in opioid-naive cancer patients with pain. J Pain Symptom Manage 2006�G31�F242-7
8�j King SJ, Reid C, Forbes K, Hanks G. A systematic review of oxycodone in the management of cancer pain. Palliat Med 2011�G25�F454-70
9�j Reid CM, Martin RM, Sterne JA, et al. Oxycodone for cancer-related pain�Fmeta-analysis of randomized controlled trials. Arch Intern Med 2006�G166�F837-43
10�j Lauretti GR, Oliveira GM, Pereira NL. Comparison of sustained-release morphine with sustained-release oxycodone in advanced cancer patients. Br J Cancer 2003�G89�F2027-30
11�j Silvestri B, Bandieri E, Del Prete S, et al. Oxycodone controlled-release as first-choice therapy for moderate-to-severe cancer pain in Italian patients�Fresults of an open-label, multicentre, observational study. Clin Drug Investig 2008�G28�F399-407
12�j Wong JO, Chiu GL, Tsao CJ, Chang CL. Comparison of oral controlled-release morphine with transdermal fentanyl in terminal cancer pain. Acrta Anaesthesiol Sin 1997�G35�F25-32�i���j
13�j Kress HG, Von der Laage D, Hoerauf KH, et al. A randomized, open, parallel group, multicenter trial to investigate analgesic efficacy and safety of a new transdermal fentanyl patch compared to standard opioid treatment in cancer pain. J Pain Symptom Manage 2008�G36�F268-79
14�j Ahmedzai S, Brooks D. Transdermal fentanyl versus sustained-release oral morphine in cancer pain�Fpreference, efficacy, and quality of life. The TTS-Fentanyl Comparative Trial Group. J Pain Symptom Manage 1997�G13�F254-61�i���j
15�j Hunt R, Fazekas B, Thorne D, Brooksbank M. A comparison of subcutaneous morphine and fentanyl in hospice cancer patients. J Pain Symptom Manage 1999�G18�F111-9�i���j
16�j van Seventer R, Smit JM, Schipper RM, et al. Comparison of TTS-fentanyl with sustained-release oral morphine in the treatment of patients not using opioids for mild-to-moderate pain. Curr Med Res Opin 2003�G19�F457-69�i���j
17�j Mystakidou K, Tsilika E, Parpa E, et al. Long-term cancer pain management in morphine pre-treated and opioid naive patients with transdermal fentanyl. Int J Cancer 2003�G107�F486-92
18�j Vielvoye-Kerkmeer AP, Mattern C, Uitendaal MP. Transdermal fentanyl in opioid-naive cancer pain patients�Fan open trial using transdermal fentanyl for the treatment of chronic cancer pain in opioid-naive patients and a group using codeine. J Pain Symptom Manage. 2000�G 19�F185-92�i���j
19�j Tassinari D, Sartori S, Tamburini E, et al. Transdermal fentanyl as a front-line approach to moderate-severe pain�Fa meta-analysis of randomized clinical trials. J Palliat Care. 2009�G 25�F172-80
20�j Tassinari D, Sartori S, Tamburini E, et al. Adverse effects of transdermal opiates treating moderate-severe cancer pain in comparison to long-acting morphine�Fa meta-analysis and systematic review of the literature. J Palliat Med. 2008�G11�F492-501
���F�ȉ��̕�����Reid CM �̌n���I���r���[�̑ΏۂƂȂ��Ă��邽�ߌX�Ɍ������s��Ȃ������B
- Heiskanen T, Kalso E. Controlled-release oxycodone and morphine in cancer related pain. Pain 1997�G 73�F37-45
- Mucci-LoRusso P, Berman BS, Silberstein PT, et al. Controlled-release oxycodone compared with controlled-release morphine in the treatment of cancer pain�Fa randomized, double-blind, parallel-group study. Eur J Pain 1998�G2�F239-49
- Bruera E, Belzile M, Pituskin E, et al. Randomized, double-blind, cross-over trial comparing safety and efficacy of oral controlled-release oxycodone with controlled-release morphine in patients with cancer pain. J Clin Oncol 1998�G16�F3222-9
- Hagen NA, Babul N. Comparative clinical efficacy and safety of a novel controlled-release oxycodone formulation and controlled-release hydromorphone in the treatment of cancer pain. Cancer 1997�G79�F1428-37
- Kalso E, Vainio A. Morphine and oxycodone hydrochloride in the management of cancer pain. Clin Pharmacol Ther 1990�G47�F639-46
�Տ��^��9
21�j Wiffen PJ, McQuay HJ. Oral morphine for cancer pain. Cochrane Database Syst Rev 2007�i4�j�FCD003868
22�j Klepstad P, Kaasa S, Borchgrevink PC. Starting step Ⅲ opioids for moderate to severe pain in cancer patients�Fdose titration�Fa systematic review. Palliat Med 2011�G25�F424-30
23�j Currow DC, Plummer JL, Cooney NJ, et al. A randomized, double-blind, multi-site, crossover, placebo-controlled equivalence study of morning versus evening once-daily sustained-release morphine sulfate in people with pain from advanced cancer. J Pain Symptom Manage 2007�G34�F17-23
���F�ȉ��̕�����Wiffen PJ �̌n���I���r���[�Ɋ܂܂�Ă���_�����Ƃ��Ď������B
- Klepstad P, Kaasa S, Jystad A, et al. Immediate- or sustained-release morphine for dose finding during start of morphine to cancer patients�Fa randomized, double-blind trial. Pain 2003�G101�F193-8
- Hagen NA, Thirlwell M, Eisenhoffer J, et al. Efficacy, safety, and steady-state pharmacokinetics of once-a-day controlled-release morphine�iMS Contin XL�jin cancer pain. J Pain Symptom Manegement 2005�G 29�F80-90�i���j
�Տ��^��12
24�j McNicol E, Strassels SA, Goudas L, et al. NSAIDS or paracetamol, alone or combined with opioids, for cancer pain. Cochrane Database Syst Rev 2005�i1�j�FCD005180
25�j Björkman R, Ullman A, Hedner J. Morphine-sparing effect of diclofenac in cancer pain. Eur J Clin Pharmacol. 1993�G44�F1-5
26�j Mercadante S, Fulfaro F, Casuccio A. A randomised controlled study on the use of anti-inflammatory drugs in patients with cancer pain on morphine therapy�Feffects on dose-escalation and a pharmacoeconomic analysis. Eur J Cancer 2002�G38�F1358-63
27�j Stambaugh JE Jr, Drew J. The combination of ibuprofen and oxycodone/acetaminophen in the management of chronic cancer pain. Clin Pharmacol Ther 1988�G44�F665-9
28�j Stockler M, Vardy J, Pillai A, Warr D. Acetaminophen�iparacetamol�jimproves pain and well-being in people with advanced cancer already receiving a strong opioid regimen�Fa randomized, double-blind, placebo-controlled cross-over trial. J Clin Oncol 2004�G22�F3389-94
�y�Q�l�����z
�Տ��^��8
29�j Ben-Aharon I, Gafter-Gvili A, Paul M, et al. Interventions for alleviating cancer-related dyspnea�Fa systematic review. J Clin Oncol 2008�G26�F2396-404
���F�����Ђ���̎������čs��ꂽ�����������B
�R
�I�s�I�C�h�����^����Ă��銳��
�֘A����Տ��^��
- ►13�����ɂ̂��銳�҂ɂ����āC�s���ׂ��]���͉����H
- ►14�I�s�I�C�h�Œ��Ɍ��ʂ������Ȃ������ɂ̂��銳�҂ɂ����āC��I�s�I�C�h���ɖ���I�s�I�C�h�ƕ��p���邱�Ƃ́C���p���Ȃ��ꍇ�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►15�I�s�I�C�h�̒�����^�ɂ����Ɍ��ʂ������Ȃ������ɂ̂��銳�҂ɂ����āC������^�ʂ̑��ʂ͒ɂ݂��ɘa���邩�H
- ►16����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ������҂ɂ����āC���̃I�s�I�C�h�ւ̕ύX�i�I�s�I�C�h�X�C�b�`���O�j��C���̃I�s�I�C�h�̒lj��͒ɂ݂��ɘa���邩�H
- ►16-1����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���̃I�s�I�C�h�ɕύX���邱�Ƃ́C�ɂ݂��ɘa���邩�H
- ►16-2����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���̃I�s�I�C�h��lj����邱�Ƃ́C�ɂ݂��ɘa���邩�H
- ►17����I�s�I�C�h�̌o�����^�܂��͓\�t�܂œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC�I�s�I�C�h�������Ò��E�����牺���ɕύX���邱�Ƃ́C�ɂ݂��ɘa���邩�H
- ►18�I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC�I�s�I�C�h�ƃP�^�~���̕��p�́C�I�s�I�C�h�P�Ƃɔ�r���Ēɂ݂��ɘa���邩�H
- ►19�I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC�I�s�I�C�h�ƃR���`�R�X�e���C�h�̕��p�́C�I�s�I�C�h�P�Ƃɔ�r���Ēɂ݂��ɘa���邩�H
����
- ►13�ɂ݂̌����̕]���ƒɂ݂̕]�����s���B
- ►14 �I�s�I�C�h�Œ��Ɍ��ʂ������Ȃ������ɂ̂��銳�҂ɂ����āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�p����B
1A�i���������C�����G�r�f���X���x���j - ►15�I�s�I�C�h�̒�����^�ɂ����Ɍ��ʂ������Ȃ������ɂ̂��銳�҂ɂ����āC������^�ʂʂ���B
1B�i���������C�Ⴂ�G�r�f���X���x���j
- �������F
- �O���̃��X�L���[��̍��v�ʂ��Q�l�ɂ��Ȃ���C������^�ʂ�30�`50�����ʂ������Ƃ��C���҂̏ɉ����đ�������B
- ���ʊԊu�F
- ���������܁C�����Ò��E�����牺���ł�24 ���ԁC���������܂ł�48 ���ԁC�t�F���^�j���\�t�܂ł�72 ���Ԃ������Ƃ���B
- ���^�o�H�F
- ������^�Ɠ����o�H�������Ƃ���B�ɂ݂������v���Ȓ��Ɍ��ʂ��K�v�ȏꍇ�́C�����Ò��E�����牺���܂��͌o�����������܂ɂ���u�Ɏ��Â��s���B
- ►16-1����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���̃I�s�I�C�h�ɕύX����B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►16-2����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���Ƃɑ��k���������ŁC���̃I�s�I�C�h��lj�����B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j - ►17����I�s�I�C�h�̌o�����^�܂��͓\�t�܂œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC�I�s�I�C�h�������Ò��E�����牺���ɕύX����B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j - ►18�I�s�I�C�h�ʂ��Ă��K�Ȓ��Ɍ��ʂ������Ȃ��ꍇ�C���Ƃɑ��k���������ŁC�I�s�I�C�h�ɃP�^�~���p����B
2B�i�ア�����C�Ⴂ�G�r�f���X���x���j - ►19�I�s�I�C�h�����^����Ă��Ă����Ɍ��ʂ������Ȃ����҂ɂ����āC����̕a�����ɂ����ẮC����p�ɒ��ӂ��Ȃ���R���`�R�X�e���C�h�𓊗^����B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j
���F�u�K�Ȓ��Ɍ��ʂ������Ȃ��v���
�I�s�I�C�h���\���ɑ��ʂ��Ă����Ɍ��ʂ������Ȃ��C�܂��͒ɂ݂�����ɂ�������炸����p�̂��߂ɃI�s�I�C�h�ʂł��Ȃ����Ƃƒ�`�����B
���F�R���`�R�X�e���C�h�̌��ʂ����҂ł���a��
�Ґ������nj�Q�Ȃǐ_�o�ւ̈����ɂ��ɂ݁C���ǂɂ��ɂ݁C���W�������i�ɔ������ɁC����̔햌�L�W�ɁC���]�ڂɔ����ɂ݂Ȃǂ��w���B
►�Տ��^��13
���
1 �j�ɂ݂̌�����g�̏�����摜��������]������
����ɂ��ɂ݂ł͒��ɖ�̓��^�Ȃǂ̒ɂ݂ɑ��鎡�ÂƂƂ��ɁC�O�Ȏ��ÁC���w�Ö@�C���ː����ÂȂǂ̎�ᇂ��̂��̂ɑ��鎡�Â���������B���Âɂ��ɂ݁i�p��ɏnj�Q�C���w�Ö@��_�o��Q���u�ɂȂǁj�₪��E���ƒ��ڊ֘A�̂Ȃ��ɂ݁i�Ғ��Nj���ǁC�я��v�]�Ȃǁj�ł͌����ɉ��������Â��s���B�ɂ݂��I���R���W�[�G�}�[�W�F���V�[�i�Ґ������nj�Q�C���܁E�ؔ����܁C�����ǁC�����ǂ̕ǁE���E�E�o���Ȃǁj�̏Ǐ�ł��邱�Ƃ�����̂ŁC�ɂ݂̑Ή��݂̂łȂ��C�ɂ݂��Ă���a�Ԃ̔c���ƌ����ւ̑Ή����s���B������u�ɏnj�Q�i�_�o��Q���u�ɁC���]�ڒɁC�㕠���̓����ɁC�����ɁC��A�����u�ɁC�����ǕǂȂǁj�̏ꍇ�ɂ͂��ꂼ��̑Ή������������iⅢ-4 �e�����Q�Ɓj�B
2 �j�ɂ݂̕]�����s��
�ɂ݂̓��퐶���ւ̉e���C�ɂ݂̃p�^�[���i�����ɂ��ˏo�ɂ��j�C�ɂ݂̋����C�ɂ݂̕��ʁC�ɂ݂̌o�߁C�ɂ݂̐���C�ɂ݂̑������q�ƌy�����q�C���ݍs���Ă��鎡�Â̔����C����сC���X�L���[��̌��ʂƕ���p�ɂ��ĕ]������B
���ɒɂ݂������I�ɂ���C�����ɂ�Ȃ��ˏo�ɂł͂Ȃ����Ƃ��m�F����B���ɖm���Ɏg�p����Ă��邩�i����I�Ɍo�����^���Ă��邩�C�\�t�܂��͂���Ă��Ȃ����Ȃǁj���m�F����B�܂��C���X�L���[��̌��ʂ�m�邱�Ƃɂ��C�I�s�I�C�h�ɔ������ɂ����ɂ݂Ȃ̂��C�I�s�I�C�h�ɔ�������ɂ݂ł��邪���^�ʂ�����Ȃ��̂�����ʂ��邱�Ƃ��ł���B
►�Տ��^��14
�I�s�I�C�h�Œ��Ɍ��ʂ������Ȃ������ɂ̂��銳�҂ɂ����āC��I�s�I�C�h���ɖ���I�s�I�C�h�ƕ��p���邱�Ƃ́C���p���Ȃ��ꍇ�ɔ�r���Ēɂ݂��ɘa���邩�H
����
�I�s�I�C�h�Œ��Ɍ��ʂ������Ȃ������ɂ̂��銳�҂ɂ����āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�̕��p�́C�ɂ݂𒆓��x�ɘa����B
�I�s�I�C�h�Œ��Ɍ��ʂ������Ȃ������ɂ̂��銳�҂ɂ����āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�p����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��āC�I�s�I�C�h���g�p���Ă��銳�҂ɑ��āC��I�s�I�C�h���ɖ����悹���ĕ��p���邱�Ƃɂ����Ɍ��ʂ��r����12 ���̖������r�������܂�1 ���̌n���I���r���[�������i�Տ��^��12 �Q�Ɓj�BNabal ��1�j�̌n���I���r���[�ł́C�I�s�I�C�h��NSAIDs ����悹���邱�Ƃ͒����x�̒��Ɍ��ʂ����҂ł���B����C�A�Z�g�A�~�m�t�F���̏�悹�Ɋւ��Ă͍������s�\���ł���Ƃ��Ă���B
����
�ȏ���C�I�s�I�C�h�Œ��Ɍ��ʂ������Ȃ������ɂ̂��銳�҂ɂ����āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�̕��p�́C�����x�ɂ݂��ɘa����ƍl������B
���������āC�{�K�C�h���C���ł́C��L�̒m���Ɛ��Ƃ̍��ӂɂ��C�I�s�I�C�h�Œ��Ɍ��ʂ������Ȃ����҂ɂ����āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�p���邱�Ƃ𐄏�����B
�������C���Ɍ��ʂ͒����x�ł���CNSAIDs �ł͏����ǂւ̗L�Q��p�Ȃǂ̕���p�̔����p�x�������Ȃ�\�������邽�߁C�������^�͒��Ɍ��ʂƕ���p��]�����Ĕ��f����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́CNSAIDs �ƃI�s�I�C�h�̕��p�͒ɂ݂����P�������̓I�s�I�C�h�g�p�ʂ���������\��������C�ア�����Ƃ��Ă���B�������CNSAIDs �͏d�Ăȕ���p�ɒ��ӂ��K�v�ł���Ƃ��Ă���B�A�Z�g�A�~�m�t�F���Ɋւ��ẮC�I�s�I�C�h�Ƃ̕��p���ʂ�������Ă��Ȃ����C����p�����Ȃ����Ƃ���NSAIDs ���]�܂����C�ア�����Ƃ��Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C���]�ڂɂ��ɂ݂≊�ǂ��ɂ݂�NSAIDs �̕��p�𐄏����Ă��邪�C�t��Q���������ᇁC�S�Ő��Ƃ���������p�ɒ��ӂ���K�v������Ƃ��Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�֊����Ȃ����Ȃ��Ƃ��Z���Ԃ̎g�p�ł���C�A�Z�g�A�~�m�t�F����NSAIDs ���u�ɋ��x�ɂ�����炸���ʂ����҂ł���Ƃ��Ă���B
►�Տ��^��15
�I�s�I�C�h�̒�����^�ɂ����Ɍ��ʂ������Ȃ������ɂ̂��銳�҂ɂ����āC������^�ʂ̑��ʂ͒ɂ݂��ɘa���邩�H
����
�I�s�I�C�h�̒�����^�ɂ����Ɍ��ʂ������Ȃ������ɂ̂��銳�҂ɂ����āC������^�ʂ̑��ʂ͒ɂ݂��ɘa����B
�I�s�I�C�h�̒�����^�ɂ����Ɍ��ʂ������Ȃ������ɂ̂��銳�҂ɂ����āC������^�ʂʂ���B
- �������F
- �O���̃��X�L���[��̍��v�ʂ��Q�l�ɂ��Ȃ���C������^�ʂ�30�`50�����ʂ������Ƃ��C���҂̏ɉ����đ�������B
- ���ʊԊu�F
- ���������܁C�����Ò��E�����牺���ł�24 ���ԁC���������܂ł�48 ���ԁC�t�F���^�j���\�t�܂ł�72 ���Ԃ������Ƃ���B
- ���^�o�H�F
- ������^�Ɠ����o�H�������Ƃ���B�ɂ݂������v���Ȓ��Ɍ��ʂ��K�v�ȏꍇ�́C�����Ò��E�����牺���܂��͌o�����������܂ɂ���u�Ɏ��Â��s���B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��āC�I�s�I�C�h�̒�����^�ɂ����Ɍ��ʂ��\���ɓ����Ȃ������ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�̈قȂ鑝�ʕ���ʊԊu���r�����������r�����͂Ȃ��B�������CWHO ���������u�Ɏ��Ö@�Ɋ�Â��I�s�I�C�h�̑��ʂɂ��C���Ɍ��ʂ������邱�Ƃ������̊ώ@�����Ŏ�����Ă����iⅡ-3 WHO ���������u�Ɏ��Ö@�̍��Q�Ɓj�B
����
�ȏ���C�I�s�I�C�h�̒�����^�ɂ����Ɍ��ʂ��\���ɓ����Ȃ������ɂ̂��銳�҂ɂ����āC������^�ʂ̑��ʂ́C�ɂ݂��ɘa����ƍl������B
���������āC�{�K�C�h���C���ł́C�I�s�I�C�h�̒�����^�ɂ����Ɍ��ʂ������Ȃ������ɂ̂��銳�҂ɂ����āC������^�ʂʂ��邱�Ƃ𐄏�����B�I�s�I�C�h������^�ʂ̑��ʂ���������ꍇ�Ƃ��ẮC1 ��4 ��ȏ�̌o�����X�L���[����قړ��Ԋu�Ŏg�p���鎞�C����I�ɓ��^���Ă�����ɖ�̓��^�O�ɂȂ�ƕK���ɂ݂����鎞�Ȃǂ�����B
���ʕ��́C���Ƃ̈ӌ�����C�O���̃��X�L���[��̍��v�ʂ��Q�l�ɂ��Ȃ���C������^�ʂ�30�`50�����ʂ������Ƃ��C���҂̏ɉ����đ������邱�Ƃ𐄏�����B���ʊԊu�́C���������܁C�����Ò��E�����牺���ł�24 ���ԁC���������܂ł�48 ���ԁC�t�F���^�j���\�t�܂ł�72 ���Ԃ������Ƃ��邱�Ƃ𐄏�����B���^�o�H�́C������^�Ɠ����o�H�������Ƃ���B�ɂ݂������v���Ȓ��Ɍ��ʂ��K�v�ȏꍇ�́C���߂̂��₷�������Ò��E�����牺���܂��͌o�����������܂��g�p����B
�����̃K�C�h���C���Ƃ̐�����
NCCN �̃K�C�h���C���i2012�j�ł́CNRS ��4 �ȏ�̏ꍇ�́C���₩�Ɍo�����������܂⎝�����˂ő��ʂ��������ŁC���O24 ���ԂɎg�p�����I�s�I�C�h�̑��ʁi������^�ʂƃ��X�L���[��̍��v�ʁj�Ɋ�Â��đ��ʂ��v�Z����Ƃ��Ă����i�ڍׂ̕��@��Ⅳ-4-1�C�}1 �Q�Ɓj�B
��ESMO �̃K�C�h���C���i2012�j�ł́C���x�̒ɂ݂Őv���Ȓ��Ɍ��ʂ��K�v�Ȏ��͎����Ò��E�����牺���𐄏����Ă���B�܂��C�o�����X�L���[���1 ��4 ��ȏ�̎g�p�ŃI�s�I�C�h���������܂̒�����^�ʂʂ���Ƃ��Ă���B
►�Տ��^��16
����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���̃I�s�I�C�h�ւ̕ύX�i�I�s�I�C�h�X�C�b�`���O�j��C���̃I�s�I�C�h�̒lj��͒ɂ݂��ɘa���邩�H
►16-1
����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���̃I�s�I�C�h�ɕύX���邱�Ƃ́C�ɂ݂��ɘa���邩�H
����
����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���̃I�s�I�C�h�ɕύX���邱�Ƃ́C�ɂ݂��ɘa����ꍇ������B
����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���̃I�s�I�C�h�ɕύX����B
►16-2
����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���̃I�s�I�C�h��lj����邱�Ƃ́C�ɂ݂��ɘa���邩�H
����
����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���̃I�s�I�C�h��lj����邱�Ƃ́C�ɂ݂��ɘa���邩�ǂ����ɂ��āC�����͕s�\���ł���B
����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���Ƃɑ��k���������ŁC���̃I�s�I�C�h��lj�����B
���
16-1�@�I�s�I�C�h�̕ύX�i�I�s�I�C�h�X�C�b�`���O�j
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC3 ���̌n���I���r���[�kQuigley2�j�CMercadante ��i2006�j3�j�CDale ��4�j�l��1 ���̑O���r����������C�������r�����Ȃǎ��̍����G�r�f���X�ł͂Ȃ����C�I�s�I�C�h�̕ύX�͒��Ɍ��ʂ̉��P�ɗL���Ȏ�i�ł���ƌ��_�Â��Ă���B�����̌����̑����́C�����q�l����I�L�V�R�h���C�t�F���^�j���C���T�h���ւ̕ύX�ɂ����Ɍ��ʂ������Ă���B
�Ⴆ�CNarabayashi ��5�j�ɂ��O���r�����ł́C����p�̂��߃����q�l�ʂł����C�����x�ȏ�̂����u�ɂ̂��銳��25 ���ΏۂƂ��āC�o���I�L�V�R�h���ɕύX���s�����Ƃ���C�ύX��2.3 ����84���̊��҂ɂ����Ēɂ݂��y�x�ȉ��ƂȂ����B
Riley ��6�j�ɂ��O���r�����ł́C�����q�l�Œ��Ɍ��ʂ������Ȃ����C����p���R���g���[���ł��Ȃ����҂ŁC�_�o��Q���u�ɂ����炩�Ȋ��҂�������48���ΏۂƂ��āC�����q�l����I�L�V�R�h���ɕύX���C�����ȏꍇ�̓t�F���^�j�������T�h���ɕύX�C����ɖ����ȏꍇ�̓t�F���^�j�������T�h���̂����O��g�p���Ȃ������ق��ɕύX���s�����Ƃ���C�I�L�V�R�h���ւ̕ύX��79���̊��҂��C���̃I�s�I�C�h�ւ̕ύX3 ��ȓ���87���̊��҂ɂ����Ē��Ɍ��ʂ�����ꂽ�B
Ravera ��7�j�ɂ��O���r�����ł́C5 ���Ԉȏ�I�s�I�C�h�\�t�܂Ŏ��Â��Ă��K�Ȓ��Ɍ��ʂ������Ȃ����҂��܂�41 ���ΏۂƂ��āC�I�L�V�R�h�����������܂ɕύX���s�����Ƃ���C3 ����ɒɂ݂�39���������C21 ����ɂ�66�����������BNRS ��7 �ȏ�̊��҂ł�56������2.6���Ɍ��������B�u�Ɏ��ÂɌ��ʂ������Ă��銳�҂̐���2.6������92���i���ʂ���72���C���Ɍ��ʂ���19���j�ɑ������CQOL �����P�����B
����
�ȏ���C����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���̃I�s�I�C�h�ɕύX���邱�Ƃ́C�ɂ݂��ɘa����ꍇ�����邱�Ǝ��������̍���������ƍl������B
���������āC�{�K�C�h���C���ł́C����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ��ꍇ�ɂ́C���̃I�s�I�C�h�ɕύX���邱�Ƃ𐄏������iⅡ-4-1-4 �I�s�I�C�h�X�C�b�`���O�̍��Q�Ɓj�B
16-2�@�I�s�I�C�h�̒lj�
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC1 ���̌n���I���r���[������BFallon ��8�j�̌n���I���r���[�ł́C���̃I�s�I�C�h�̒lj��ɂ��Č�������1 ���̖������r������1 ���̑O���r�����i����36 ��j�������������ʁC�I�s�I�C�h�̒lj��͎ア�����݂̂ƌ��_�Â��Ă���B
Lauretti ��9�j�ɂ�閳�����r�����ł́C����22 ���ΏۂɃ����q�l���������܂݂̂ƃ����q�l���������܂ƃI�L�V�R�h�����������܂̕��p�Ƃ��r�����Ƃ���C���p�Q�ł̓��X�L���[��̃����q�l�̎g�p�����Ȃ��C���S�E�q�f���L�ӂɏ��Ȃ������ip��0.05�j�Ƃ��Ă���B
Mercadante ��i2004�j10�j�ɂ��O���r�����ł́C1 �T�Ԉȓ��ɃI�s�I�C�h��100�����ʂ��Ă�NRS ��4 �ȏ�̒ɂ݂̂��邪��14 ���ΏۂɁC���̃I�s�I�C�h��lj����錤�����s�����B5 ��̓t�F���^�j���\�t�܂�20���̌o�������q�l��lj����C�ɂ݂�NRS ��6.7 ����2.7 �ɒቺ�����B5 ��͌o�������q�l�Ƀt�F���^�j���\�t�܂�lj����C�ɂ݂�NRS ��6.4 ����3.3 �ɒቺ�����B4 ��͌o�������q�l�Ɍo�����T�h����lj����C�ɂ݂�NRS ��6.2 ����3.0 �ɒቺ�����B����p�̑����͂Ȃ������B
����
�ȏ���C�����͕s�\���ł��邪�C����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���̃I�s�I�C�h��lj����邱�Ƃ́C�ɂ݂��ɘa����\��������Ǝ��������B
���������āC�{�K�C�h���C���ł͐��Ƃ̍��ӂƂ��āC����I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC���Ƃɑ��k���������ő��̃I�s�I�C�h��lj����邱�Ƃ𐄏�����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̕ύX�ɂ��āC�����q�l�̕���p�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��ꍇ�́C�I�s�I�C�h��ύX���邱�Ƃ𐄏����Ă���C40�`80���ʼn��P���݂���Ƃ��Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̕���p��\���Ȓ��Ɍ��ʂ������Ȃ��ꍇ�ɂ́C�����̕ʂ̃I�s�I�C�h�ɕύX���邱�Ƃ𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C���̃I�s�I�C�h�ɕύX���邱�Ƃŕ���p�̌y���ƗǍD���u�ɃR���g���[����������\��������Ƃ��Ă���B
�I�s�I�C�h�̒lj��ɂ��ẮC�����̃K�C�h���C���ŃI�s�I�C�h�̕��p�ɂ��Ă̋L�ڂ͂Ȃ��B
►�Տ��^��17
����I�s�I�C�h�̌o�����^�܂��͓\�t�܂œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC�I�s�I�C�h�������Ò��E�����牺���ɕύX���邱�Ƃ́C�ɂ݂��ɘa���邩�H
����
����I�s�I�C�h�̌o�����^�܂��͓\�t�܂œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC�I�s�I�C�h�������Ò��E�����牺���ɕύX���邱�Ƃ́C�ɂ݂��ɘa����\��������B
����I�s�I�C�h�̌o�����^�܂��͓\�t�܂œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC�I�s�I�C�h�������Ò��E�����牺���ɕύX����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC1 ���̌n���I���r���[��1 ���̑O���r����������B
Radbruch ��11�j�͌n���I���r���[�̂Ȃ���Enting ��12�j��Kornick ��13�j�̑O���r���������グ�āC�I�s�I�C�h���o�����^��\�t�܂��玝���Ò��E�����牺���ɕύX���邱�Ƃ͒ɂ݂����P����Ƃ��Ă���B
Enting ��12�j�ɂ��O���r�����ł́C�I�s�I�C�h�ɂ���u�Ɏ��Â��s�\����100��̊��҂�ΏۂƂ��C�o�����^�E�o��I�s�I�C�h��Ö������^�E�牺���^�ɕύX�����B��ȕύX���@�́C�o�������q�l��Ö������^�E�牺���^�ɕύX�C�t�F���^�j���\�t�܂��t�F���^�j���������q�l�̐Ö������^�E�牺���^�ɕύX�ł������B�ύX��C���Î���NRS ��6.3 ����3.4 �ɁC�̓�����NRS ��8.4 ����4.6 �ɒቺ�����B���S�C�֔�C���C�C�����C���o�Ȃǂ̕���p�͕ύX�O78���ŔF�߂��C�ύX��25���ŏ���������12���ŐV���ɐ������B�d�Ăȕ���p�͐����Ȃ������B
Kornick ��13�j�ɂ��O���r�����ł́C�t�F���^�j���\�t�܂�NRS ��8 �ȏ�̒ɂ݂̂��銳��9 ���ΏۂƂ��ē����ɗp�ʂ̎����Ò��ɕύX�����Ƃ���C5 ���ȓ��ɑS���NRS ��4 �ȉ��ɂȂ�C�d�Ăȕ���p�͐����Ȃ������B
Drexel ��14�j�ɂ��O���r�����ł́C�����q�l���������܂�4 ���Ԗ��̃����q�l�P��牺���^������Ă��Ă��d�x�̖��C�∫�S������������Ɍ��ʂ������Ȃ�����36 ���ΏۂƂ��C�����q�l�������牺���ɕύX�����B�S��Œɂ݂̉��P��QOL �̉��P�C�����q�l���^�ʂ̌������F�߂�ꂽ�B���Ɍ��ʂ͎����牺���ɕύX��10 ���Ԉȓ��ɂ����炳��CNRS ��5 �ȏ�̒ɂ݂̂��銳�҂͂��Ȃ��Ȃ����B
����
�ȏ���C�\���Ȓm���͂Ȃ����C����I�s�I�C�h�̌o�����^�܂��͓\�t�܂œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC�I�s�I�C�h�������Ò��E�����牺���ɕύX���邱�Ƃ́C�ɂ݂��ɘa����\��������ƍl������B
���������āC�{�K�C�h���C���ł́C����I�s�I�C�h�̌o�����^�܂��͌o�瓊�^�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC�I�s�I�C�h�������Ò��E�����牺���ɕύX���邱�Ƃ𐄏�����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̌o����o�瓊�^�ŏ\���Ȓ��Ɍ��ʂ������Ȃ��ꍇ�́C���^�o�H�������Ò��E�����牺���ɕύX���邱�Ƃ𐄏����Ă���B
NCCN �K�C�h���C���i2012�j�ł́C�����q�l���������܂̌o�����^��1 ���Ԃ�����2�`3��J��Ԃ��Ă��ɂ݂��ɘa�ł��Ȃ����́C�ɂ݂̕]�����ēx��蒼���ƂƂ��ɁC�����Ò��E�����牺���ɕύX���邱�Ƃ𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C���x�̒ɂ݂Őv���Ȓ��Ɍ��ʂ��K�v�Ȏ��͎����Ò��E�����牺���𐄏����Ă���B
►�Տ��^��18
�I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC�I�s�I�C�h�ƃP�^�~���̕��p�́C�I�s�I�C�h�P�Ƃɔ�r���Ēɂ݂��ɘa���邩�H
����
�I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC�I�s�I�C�h�ƃP�^�~���̕��p�́C�I�s�I�C�h�P�Ƃɔ�r���Ēɂ݂��ɘa����\��������B
�I�s�I�C�h�ʂ��Ă��K�Ȓ��Ɍ��ʂ������Ȃ��ꍇ�C���Ƃɑ��k���������ŁC�I�s�I�C�h�ɃP�^�~���p����B
�i�P�^�~���E�R���`�R�X�e���C�h�ȊO�̒��ɕ⏕��ɂ��ẮC�_�o��Q���u���Q�Ɓj
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC1 ���̌n���I���r���[��1 ���̓�d�ӌ��������r����������B
Bell ��15�j�ɂ��n���I���r���[�ł́C��K�͂Ȏ��̍����������r�����͂Ȃ��C�����Ƃ��Ă͕s�\���ł��邪�C�P�^�~���̗L��������������4 �̖������r������32 �̋L�q�I�����𒊏o�����B�P�^�~���̎g�p�ʂ�1 mg/kg/���`600 mg/���ł������B
�Ⴆ�CMercadante ��16�j�ɂ�閳�����r�����ł́C�����q�l�Ŋɘa����Ȃ��_�o��Q���u�ɂ̂��邪��10���ΏۂƂ����Ƃ���C�P�^�~���͗p�ʈˑ����ɒɂ݂��ɘa�����kNRS 6.6��3.8�i�P�^�~��0.25 mg/kg ���^�Q�j�C5.9��1.8�i�P�^�~��0.5 mg/kg ���^�Q�j�C6.5��6.6�i�v���Z�{�Q�j�l�B����p�Ƃ��āC���o��30�`40���C������20���ɔF�߂�ꂽ�B�܂��C�P�^�~�����^�Q�ł̓v���Z�{�Q��薰�C�������F�߂�ꂽ�k1.7�i�P�^�~��0.25 mg/kg ���^�Q�jvs 1.9�i�P�^�~��0.5 mg/kg ���^�Q�jvs 0.3�i�v���Z�{���^�Q�j�C���^��30 ����0�`3 �X�P�[���l�B
Jackson ��17�j�ɂ��O���r�����ł́C�I�s�I�C�h�Œ��Ɍ��ʂ��s�\���Ȃ���39 ���ΏۂɁC�P�^�~��100�`500 mg/����3�`5 ���Ԏ����牺�����s�����Ƃ���C�̐���17 �ᒆ15 ��i88���j�C�_�o��Q���u��23 �ᒆ14 ��i61���j�ɗL���ł������B�L���̒�`�́CNRS ��50���ȏ�ቺ���C�����1 ���̃I�s�I�C�h�g�p�ʂ܂����u�Ɏ��I�s�I�C�h�g�p��50���ȏ㌸�����邩�����@�\�����炩�ɉ��P����ꍇ�Ƃ����B����p�Ƃ��āC���V��15���C���o7.7���C���C5.1���C�߂܂�2.5�����F�߂�ꂽ�B
Kannan ��18�j�ɂ��O���r�����ł́C�A�~�g���v�`������o���v���_�i�g���E���ƃ����q�l��p�̑ς�����ő哊�^�ʂ܂Ŏg�p���Ă��Ă�NRS ��6 �ȏ�̐_�o��Q���u�ɂ̂��邪��9 ���ΏۂɁC�o���P�^�~���i1 ��0.5 mg/kg ��3��/���j�ɂ����Ɍ��ʂ��݂��Ƃ���C�ɂ݂�NRS ��24 ���Ԍ�ɂ�7.6 ����3.6 �Ɍ��������ip��0.0092�j�B
Ogawa ��19�j�ɂ��O���r�����ł́C�����q�l�Œ��Ɍ��ʂ������Ȃ����C�܂��̓����q�l�̑ς�����������p�̂���I��������15���ΏۂɁC�P�^�~�������Ò����s�����Ƃ���C���^��6 ���Ԃ�1 �Ⴊ���o������ςŁC����1 �Ⴊ�S�g����ŃP�^�~�����^���~�ƂȂ������C�c���13 ���3�`20 mg/h �̃P�^�~�����^�ŁC�ɂ݂�VAS ��5.9 ����0.3 �ɒቺ�����B
����CHardy ��20�j�ɂ�閳�����r�����ł́C�I�s�I�C�h����ɕ⏕����g�p���Ă�Brief Pain Inventory�iBPI�j��1 ���σX�R�A��3 �ȏ�̒ɂ݂����銳��187 ���ΏۂƂ��C�P�^�~���i100��300��500 mg/���j�܂��̓v���Z�{�i�����H�����j�̎����牺����5 ���ԍs�����Ƃ���C����BPI ��2 �ȏ�̒ቺ��L���Ƃ����L�����ɍ��͂Ȃ��i�P�^�~��27�� vs �v���Z�{31���j�C�ɂ݂̎�ށi�N�Q��e��vs �_�o��Q���j�ɂ��L�����ɂ����͂Ȃ������B�����J�n�O���L�Q���ۂ����������Ǘ�͎����J�n������1.95 �{�C�S�o�߂�ʂ��ăP�^�~���Q�Ńv���Z�{�Q��葽�������iNNT��2��25�CNNH��3��6�j�B
����
�ȏ���C�\���Ȓm���ł͂Ȃ����C�I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ��_�o��Q���u�ɂ�I�s�I�C�h�ϐ������\�������銳�҂ɂ����āC�I�s�I�C�h�ƃP�^�~���̕��p�́C���_�Ǐ�̔����̉\�����������C�ɂ݂��ɘa����\��������ƍl������B
���������āC�{�K�C�h���C���ł́C�I�s�I�C�h�ʂ��Ă����Ɍ��ʂ�����ꂸ���̎��Âɔ������Ȃ��ꍇ�́C���Ƃɑ��k���������ŃI�s�I�C�h�ɃP�^�~���p���邱�Ƃ��l������B
��1�FBPI�iBrief Pain Inventory�j
�ȈՒɂݎ���\�Ƃ��Ă�銳�҂̎��L�L�ڌ`���̒����\�B�ɂ݂̋����i���݁C�ň��̎��C�ł��y�����FNRS�j�ƕ��ʁC����̒��Ɍ��ʁC�ɂ݂����퐶���ɉe��������x�iNRS�C7 ���ځj����\������Ă���B
��2�FNNT�iNumber Needed to Treat�j
1 ��̌��ʂ邽�߂ɂ��̎��Â����l�̊��҂ɗp���Ȃ���Ȃ�Ȃ����������w�W�B
��3�FNNH�iNumber Needed to Harm�j
���l�̊��҂����Â����1 ��̗L�Q�ǗႪ�o�����邩�������w�W�B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�P�^�~���ɂ��Ă͌n���I���r���[���s�킸�C�����̑ΏۂƂ��Ă��Ȃ��B
ESMO �̃K�C�h���C���i2012�j�ł́C�P�^�~���̏��ʓ��^�͓���̒ɂ݂ɑ��ď\���ł͂Ȃ���������x�̍���������Ƃ��Ă���B
►�Տ��^��19
�I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC�I�s�I�C�h�ƃR���`�R�X�e���C�h�̕��p�́C�I�s�I�C�h�P�Ƃɔ�r���Ēɂ݂��ɘa���邩�H
����
�I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC����̕a����4�ł̓I�s�I�C�h�ƃR���`�R�X�e���C�h�̕��p�́C�I�s�I�C�h�P�Ƃɔ�r���Ēɂ݂��ɘa����\��������B
�I�s�I�C�h�����^����Ă��Ă����Ɍ��ʂ������Ȃ����҂ɂ����āC����̕a�Ԃɂ����ẮC����p�ɒ��ӂ��Ȃ���R���`�R�X�e���C�h�𓊗^����B
�i�P�^�~���E�R���`�R�X�e���C�h�ȊO�̒��ɕ⏕��ɂ��ẮC�_�o��Q���u���Q�Ɓj
��4�F�R���`�R�X�e���C�h�̌��ʂ����҂ł���a��
�Ґ������nj�Q�Ȃǐ_�o�ւ̈����ɂ��ɂ݁C���ǂɂ��ɂ݁C���W�������i�ɔ������ɁC����̔햌�L�W�ɁC���]�ڂɔ����ɂ݂Ȃǂ��w���B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC2 ���̖������r�����iBruera ��21�j�CMercadnte ��22�j�j�ƕ����̋L�q�I�����iHardy23�j�CWatanabe ��24�j�j������B
Bruera ��21�j�ɂ��C��I�s�I�C�h�ipropoxyfen ��dipyrone �̍��܁j�̌o�����^���Ă���I��������40 ���ΏۂƂ���������N���X�I�[�o�[��r�����ł́C���`���v���h�j�]����32 mg�C5 ���Ԃ̓��^�ɂ��C�ɂ݂�VAS ���ቺ�����i58��37 vs 58��50�Cp��0.01�j�B
Mercadante ��22�j�ɂ��C�ɘa�P�A�a���ɓ��@���������x�ȏ�̂����u�ɂ̂��銳��76 ���ΏۂƂ����������r�����ł́C�I�s�I�C�h���^�ɉ����ăf�L�T���^�]��8 mg/���̓��^�͏�����Ǐ�i���S�E�q�f�C�֔�j�ƑS�ʓI���K���isense of well-being�j�ɒZ���I���ʂ������炵�����C���Ɍ��ʂ̓I�s�I�C�h�P�ƂƓ����ł���iNRS�@7.1��1.9 vs 5.4��2.2�C2 �T�Ԍ�j�C�R���`�R�X�e���C�h�ɂ����Ɍ��ʂ������Ȃ������B�������{�����́C�I�s�I�C�h�Œ��Ɍ��ʂ��s�\���Ȋ��҂�����ΏۂƂ��Ă���킯�ł͂Ȃ��C1 �J���ȓ��ɃR���`�R�X�e���C�h���^�������҂ƁC�ɂ݈ȊO�̏Ǐ�ɑ��ăR���`�R�X�e���C�h�̓K�������銳�҂͏��O����Ă���̂ŁC�ɂ݂ɑ���R���`�R�X�e���C�h�̓K���ƍl�����銳�҂͏��O����Ă���\��������B
����
�ȏ���C�I�s�I�C�h�œK�Ȓ��Ɍ��ʂ������Ȃ����҂ɂ����āC�����u�ɑS�̂Ƃ��Ă͒��Ɍ��ʂ����シ��Ƃ��������͖R�������C�Ґ������nj�Q�Ȃǐ_�o�ւ̈����ɂ��ɂ݁C���ǂɂ��ɂ݁C���W�������i�ɔ������ɁC����̔햌�L�W�ɁC���]�ڂɔ����ɂ݂Ȃǂ̕a�Ԃɂ����Ă̓I�s�I�C�h�ƃR���`�R�X�e���C�h�̕��p�́C�I�s�I�C�h�P�Ƃɔ�r���Ēɂ݂��ɘa����\��������ƍl������B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C�����g�p�ɔ�������p�i�������C�ݒ�ᇁC�Պ������C���o�J���W�_�ǁC�����l��e�Ȃǁj�ɒ��ӂ��C�R���`�R�X�e���C�h�̓K���ƍl������a�Ԃł���C�I�s�I�C�h�ƃR���`�R�X�e���C�h�̕��p�𐄏�����B���p�̌��ʂ��F�߂���Ό��ʂ̔F�߂���ŏ��ʂŕ��p���C���ʂ��Ȃ���Ζ��R�Ǝg�p�����Ɉ����ԂŌ��ʁE���~����B
�����̃K�C�h���C���Ƃ̐�����
NCCN �̃K�C�h���C���i2012�j�ł́C�_�o�����C�������]�ڂɂ��ɂ݁C���ǁC�����Ǖǂɂ��ɂ݂ɑ���R���`�R�X�e���C�h�̓��^�𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�_�o�����ɂ��ɂ݂̏ꍇ�̓R���`�R�X�e���C�h�̓��^�𐄏����Ă���B
�i�������q�C�{�ꏺ�F�C�R�{�@���j
�y�� ���z
�Տ��^��16
1�j Nabal M, Librada S, Redondo MJ, et al. The role of paracetamol and nonsteroidal anti-inflammatory drugs in addition to WHO step Ⅲ opioids in the control of pain in advanced cancer. A systematic review of the literature. Palliat Med 2012�G26�F305-12
2�j Quigley C. Opioid switching to improve pain relief and drug tolerability. Cochrane Database Syst Rev 2004�i3�j�FCD004847
3�j Mercadante S, Bruera E. Opioid switching�Fa systematic and critical review. Cancer Treat Rev 2006�G32�i4�j�F304-15
4�j Dale O, Moksnes K, Kaasa S. European Palliative Care Research Collaborative pain guidelines�Fopioid switching to improve analgesia or reduce side effects. A systematic review. Palliat Med 2011�G25�F494-503
5�j Narabayashi M, Saijo Y, Takenoshita S, et al. Opioid rotation from oral morphine to oral oxycodone in cancer patients with intolerable adverse effects�Fan open-label trial. Jpn J Clin Oncol 2008�G38�F296-304
6�j Riley J, Ross JR, Rutter D, et al. No pain relief from morphine? Individual variation in sensitivity to morphine and the need to switch to an alternative opioid in cancer patients. Support Care Cancer 2006�G14�F56-64
7�j Ravera E, Di Santo S, Bosco R, et al. Controlled-release oxycodone tablets after transdermal-based opioid therapy in patients with cancer and non-cancer pain. Aging Clin Exp Res 2011�G23�F328-32
8�j Fallon MT, Laird BJ. A systematic review of combination step �V opioid therapy in cancer pain�Fan EPCRC opioid guideline project. Palliat Med 2011�G25�F597-603
9�j Lauretti GR, Oliveira GM, Pereira NL. Comparison of sustained-release morphine with sustained-release oxycodone in advanced cancer patients. Br J Cancer 2003�G89�F2027-30
10�j Mercadante S, Villari P, Ferrera P, et al. Addition of a second opioid may improve opioid response in cancer pain�Fpreliminary data. Support Care Cancer 2004�G12�F762-6
�Տ��^��17
11�j Radbruch L, Trottenberg P, Elsner F, et al. Systematic review of the role of alternative application routes for opioid treatment for moderate to severe cancer pain�FAn EPCRC opioid guidelines project. Palliat Med 2011�G25�F578-96
12�j Enting RH, Oldenmenger WH, van der Rijt CC, et al. A prospective study evaluating the response of patients with unrelieved cancer pain to parenteral opioids. Cancer 2002�G94�F3049-56
13�j Kormick CA, Santiago-Palma J, Schulman G, et al. A safe and effective method for converting patients from transdermal to intravenous fentanyl for the treatment of acute cancer-related pain. Cancer 2003�G97�F3121-4
14�j Drexel H, Dzien A, Spiegel RW, et al. Treatment of severe cancer pain by low-dose continuous subcutaneous morphine. Pain 1989�G36�F169-76
�Տ��^��18
15�j Bell RF, Eccleston C, Kalso EA. Ketamine as an adjuvant to opioids for cancer pain. Cochrane Database Syst Rev 2012�G11�FCD003351
16�j Mercadante S, Arcuri E, Tirelli W, et al. Analgesic effect of intravenous ketamine in cancer patients on morphine therapy�Fa randomized, controlled, double-blind, crossover, double-dose study. J Pain Symptom Manage 2000�G20�F246-52
17�j Jackson K, Ashby M, Martin P, et al. �gBurst�h ketamine for refractory cancer pain�Fan open-label audit of 39 patients. J Pain Symptom Manage 2001�G22�F834-42
18�j Kannan TR, Saxena A, Bhatnagar S, et al. Oral ketamine as an adjuvant to oral morphine for neuropathic pain in cancer patients. J Pain Symptom Manage 2002�G23�F60-5
19�j Ogawa S, Kanamaru T, Noda K, et al. Intravenous microdrip infusion of ketamine in subanaesthetic doses for intractable terminal cancer pain. Pain Clinic 1994�G7�F125-9
20�j Hardy J, Quinn S, Fazekas B, et al. Randomized, double-blind, placebo-controlled study to assess the efficacy and toxicity of subcutaneous ketamine in the management of cancer pain. J Clin Oncol 2012�G30�F3611-7
�Տ��^��19
21�j Bruera E, Roca E, Cedaro L, et al. Action of oral methylprednisolone in terminal cancer patients�Fa prospective randomized double-blind study. Cancer Treat Rep 1985�G69�F751-4
22�j Mercadante SL, Berchovich M, Casuccio A, et al. A prospective randomized study of corticosteroids as adjuvant drugs to opioids in advanced cancer patients. Am J Hosp Palliat Care 2007�G24�F13-9
23�j Hardy JR, Rees E, Ling J, et al. A prospective survey of the use of dexamethasone on a palliative care unit. Palliat Med 2001�G15�F3-8
�y�Q�l�����z
�Տ��^��19
24�j Watanabe S, Bruera E. Corticosteroids as a adjuvant analgesics. J Pain Symptom Manage 1994�G9�F442-5
�֘A����Տ��^��
- ►20�ˏo�ɂ̂��銳�҂ɂ����āC�s���ׂ��]���͉����H
- ►21�ˏo�ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�̃��X�L���[��́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►22�莞���ɖ�̐�ڂ̒ɂ݁iend-of-dose failure�j�̂��銳�҂ɂ����āC�I�s�I�C�h�̒�����^�ʂ̑��ʁE���^�Ԋu�̒Z�k�́C���ʁE���^�Ԋu�̒Z�k�����Ȃ��ꍇ�ɔ�r���āC�ɂ݂��ɘa���邩�H
- ►23���X�L���[��̓��^�Œ��Ɍ��ʂ��s�\���ȓˏo�ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�̒�����^�ʂ̑��ʂ́C���ʂ��Ȃ��ꍇ�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►24�ˏo�ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�ɔ�I�s�I�C�h���ɖ�p���邱�Ƃ́C���p���Ȃ��ꍇ�ɔ�r���Ēɂ݂��ɘa���邩�H
����
- ►20�ɂ݂̌����̕]���ƒɂ݂̕]�����s���B
- ►21①�ˏo�ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�̃��X�L���[��𓊗^����B
1B�i���������C�Ⴂ�G�r�f���X���x���j
- ���^�ʁF
- �o�����^�ł�1 �����^�ʂ�10�`20���̑��������܂��C�����Ò��E�����牺���ł�1 ���ԗʂ��}�����^����B
- ���^�Ԋu�F
- �o�����^�̏ꍇ��1 ���Ԗ��C�����Ò��E�����牺���̏ꍇ��15�`30 �����Ƃ���B
- ���^�o�H�F
- ������^�Ɠ����o�H�������Ƃ���B��������ő�ɂȂ�܂ł̎��Ԃ̒Z���ˏo�ɂɑ��ẮC�����Ò��E�����牺���E���o�S���z���܂���������B�������C���o�S���z���܂͎����ɂ��R���g���[������Ă���ꍇ�Ɍ���B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j - ►22�莞���ɖ�̐�ڂ̒ɂ݁iend-of-dose failure�j�̂��銳�҂ɂ����āC�I�s�I�C�h�̒�����^�ʂ̑��ʁC�܂��́C���^�Ԋu�̒Z�k���s���B
1B�i���������C�Ⴂ�G�r�f���X���x���j
- ►23���X�L���[��̓��^�Œ��Ɍ��ʂ��s�\���ȓˏo�ɂ̂��銳�҂ɂ����āC���Ƃ֑��k�̂����C���C�����e�ł���͈͂ŃI�s�I�C�h�̒�����^�ʂʂ���B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j - ►24�ˏo�ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�ɔ�I�s�I�C�h���ɖ�p����B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j
►�Տ��^��20
���
1 �j�ɂ݂̌�����g�̏�����摜��������]������
����ɂ��ɂ݂ł͒��ɖ�̓��^�Ȃǂ��u�Ɏ��ÂƂƂ��ɁC�O�Ȏ��ÁC���w�Ö@�C���ː����ÂȂǂ̎�ᇂ��̂��̂ɑ��鎡�Â���������B���Âɂ��ɂ݁i�p��ɏnj�Q�C���w�Ö@��_�o��Q���u�ɂȂǁj�₪��E���ƒ��ڊ֘A�̂Ȃ��ɂ݁i�Ғ��Nj���ǁC�я��v�]�Ȃǁj�ł͌����ɉ��������Â��s���B�ɂ݂��I���R���W�[�G�}�[�W�F���V�[�i�Ґ������nj�Q�C���܁E�ؔ����܁C�����ǁC�����ǂ̕ǁE���E�E�o���Ȃǁj�̏Ǐ�ł��邱�Ƃ�����̂ŁC�ɂ݂ւ̑Ή��݂̂łȂ��C�ɂ݂��Ă���a�Ԃ̔c���ƌ����ւ̑Ή����s���B������u�ɏnj�Q�i�_�o��Q���u�ɁC���]�ڒɁC�㕠���̓����ɁC�����ɁC��A���̒ɂ݁C�����ǕǂȂǁj�̏ꍇ�ɂ͂��ꂼ��̑Ή������������iⅢ-4 �e�����Q�Ɓj�B
2 �j�ɂ݂̕]�����s��
�ɂ݂̓��퐶���ւ̉e���C�ɂ݂̃p�^�[���i�����ɂ��ˏo�ɂ��j�C�ɂ݂̋����C�ɂ݂̕��ʁC�ɂ݂̌o�߁C�ɂ݂̐���C�ɂ݂̑������q�ƌy�����q�C���ݍs���Ă��鎡�Â̔����C����сC���X�L���[��̒��Ɍ��ʂƕ���p�ɂ��ĕ]������B
�ˏo�ɂ�������o�߂𖾂炩�ɂ��C�̓����ɂȂǗ\���ł���ˏo�ɁC�\���ł��Ȃ��ˏo�ɁC�莞���ɖ�̐�ڂ̒ɂ݁iend-of-dose failure�j�ɕ��ނ���B����ɓˏo�ɂ̔�������ő�ɂȂ�܂ł̎��ԂƎ������Ԃ�]�����邱�Ƃɂ��C���X�L���[��̓��^�o�H�Ȃǂ����߂�Q�l�ɂ���B
►�Տ��^��21
�ˏo�ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�̃��X�L���[��́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
�ˏo�ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�̃��X�L���[��͒ɂ݂��ɘa����B
①�ˏo�ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�̃��X�L���[��𓊗^����B
- ���^�ʁF
- �o�����^�ł�1 �����^�ʂ�10�`20���̑��������܂��C�����Ò��E�����牺���ł�1 ���ԗʂ��}�����^����B
- ���^�Ԋu�F
- �o�����^�̏ꍇ��1 ���Ԗ��C�����Ò��E�����牺���̏ꍇ��15�`30 �����Ƃ���B
- ���^�o�H�F
- ������^�Ɠ����o�H�������Ƃ���B��������ő�ɂȂ�܂ł̎��Ԃ̒Z���ˏo�ɂɑ��ẮC�Ö����E�牺���^�E���o�S���z���܂���������B�������C���o�S���z���܂͎����ɂ��R���g���[������Ă���ꍇ�Ɍ���B
②���X�L���[��̌��ʂ��s�\���ł������ꍇ�C���C�����e�ł���͈͂ŁC���X�L���[��̓��^�ʂʂ���B
���
1 �j���X�L���[��̒��Ɍ��ʂɊւ���Տ�����
�{�Տ��^��Ɋւ���Տ������́C12 ���̖������r������1 ���̔�r�������܂�6 ���̌n���I���r���[�C4 ���̑O���r�����i1 ���͖������r�����j������B
�i1�j�o�S���z���^�t�F���^�j�����܂Ɋւ��錤��
�t�F���^�j���S���z���܁kfentanyl buccal tablet�iFBT�j�Csublingual fentanyl�iSLF�j�Coral transmucosal fentanyl citrate�iOTFC�C�{�M�������j�Cintranasal fentanyl spray�iINFS�C�{�M�������j�܂���fentanyl pectin nasal spray�iFPNS�C�{�M�������j�l�Ɋւ���C12 ���̖������r������1 ���̔�r�������܂�6 ���̌n���I���r���[������1-19�j�B�����̌n���I���r���[�ł́C�ˏo�ɂɑ���t�F���^�j���S���z���܂̓v���Z�{�ɔ�r���ėL���ł���ƌ��_���Ă���B�܂��C���X�L���[��̓��^�ʂ͒�����^�ʂ���ꗥ�Ɍ��߂邱�Ƃ͂ł������ҌX�ɂ��킹�����^�ʂ̒������K�v�ł���Ƃ��Ă���B
�����̌o���̑��������܂ƃt�F���^�j���S���z���܂̔�r�Ɋւ���3 ���̖������r����������B
Coluzzi ��10�j�ɂ�閳�����r�����ł́C�I�s�I�C�h�̒�����^�Ƃ��Čo�������q�l���Z��60�`1,000 mg/�������^����C�����ɂ������x�ȉ��ɃR���g���[������Ă���C1�`4 ��/���̓ˏo�ɂ�L���邪��75 ���ΏۂƂ��C�����q�l���������܂�OTFC �̌��ʂ��r�����B15 ����̒ɂ݂̋��x��33���ȏ�ቺ���Ă���ꍇ��L���ƒ�`���C�����q�l���������܂�OTFC �͂��ꂼ��32����42���ɗL���ł������ip��0.001�j�B���^�ʂ͑Q���@�ɂ��L���ȃ��X�L���[��̓��^�ʂ����肵���Ƃ���C������^�ʂƗL���ȃ��X�L���[��̓��^�ʂɊ֘A�͔F�߂Ȃ������B����p�Ɋւ���f�[�^�͎�����Ă��Ȃ��B
Davies ��11�j�ɂ�閳�����r�����ł́C�I�s�I�C�h�̒�����^�Ƃ��Čo�������q�l���Z��60 mg/���ȏオ���^����C1�`4 ��/���̓ˏo�ɂ�L���邪��84 ���ΏۂƂ��C�����q�l���������܂�FPNS �̌��ʂƔF�e�����r�����B10 ����̒ɂ݂̋��x��2 �|�C���g�ȏ㌸�����Ă���ꍇ��L���ƒ�`���C�����q�l���������܂�FPNS �͂��ꂼ��45����52���ɗL���ł������ip��0.05�j�B����p�Ɋւ���f�[�^��FPNS ���^���̕@�o�Ɋւ��镛��p�݂̂�������Ă���C�y�x�̕@��2.2���C�y�x�̕@�`��4.5���ɔF�߂�ꂽ�B
�i2�j�o�����^�Ɋւ��錤��
Coluzzi ��10�j�ɂ��C�ˏo�ɂɑ��閳�����r�����̑ΏƌQ�ł́C�ˏo�ɂɑ��āC���X�L���[��Ƃ��ĕ���31�}14 mg �̃����q�l���������܂𓊗^���C15 �����32���̗�ɂ����Ēɂ݂̋��x��33���ȏ�ቺ���C���^�O�Ɣ�r���ē��^60 ����̒ɂ݂�NRS �͖�3.5�i�}�ɂ��\���݂̂Ő��m�Ȑ��l�̋L�ڂ͂Ȃ��j�ቺ�����B�����q�l���������܂̓��^�ʂ͑Q���@�ɂ��L���ȃ��X�L���[��̓��^�ʂ����肵�C������^�ʂƗL���ȃ��X�L���[��̓��^�ʂɊ֘A�͔F�߂Ȃ������B����p�Ɋւ���f�[�^�͎�����Ă��Ȃ��B
�i3�j�Ö������^�Ɋւ��錤��
Mercadante ��i2007�j20�j�ɂ�閳�����r�����ł́C�ˏo�ɂ̂��銳��25 ���ΏۂɁC�o�������q�l���Z1 �����^�ʂ�1/5 �����̃����q�l�Ò��i�Ò��F�o����1�F3 �̊��Z����g�p�C�Ⴆ�C�o�������q�l90 mg/���́C�����q�l�Ò����Z30 mg/�������ł���C����1/5 �ł��郂���q�l6 mg ��Ö������^�j��OTFC �̌��ʂ��r�����Ƃ���C�����q�l�Ò��Q�ł͓��^�O�C15 ����C30 ����̕��ς̒ɂ݂�NRS�́C���ꂼ��C6.9�C3.3�C1.7 �ł������B�L�����u�Ɋɘa�iNRS 33���ȏ�̒ቺ�ƒ�`�j��15 �����74���C30 �����87���ł������B����p�X�P�[��2�`3 �̕���p�Ƃ��āC���S3.7���C���C19���C����5.6�����F�߂�ꂽ�B
Mercadante ��i2004�j21�j�ɂ��O���r�����ł́C�ˏo�ɂ̂��銳��48 ��i�ˏo��171 ��j��ΏۂɁC�o�������q�l���Z1 �����^�ʂ�1/5 �����̃����q�l�Ò��̓ˏo�ɂɑ�����ʂ����������Ƃ���C95���̏Ǘ�ŗL�����u�Ɋɘa�iNRS 33���ȏ�̒ቺ�ƒ�`�j������ꂽ�B�L����ɂ�����ő���ʔ����܂ł̕��ώ��Ԃ�17.7���ł������B����p�X�P�[��2�`3 �̕���p�́C���S�E�q�f7.0���C���C15���C����0.6���ŔF�߂�ꂽ�B
Mercadante ��i2008�j22�j�ɂ��O���r�����ł́C�ˏo�ɂ̂��銳��99 ��i�ˏo��469 ��j��ΏۂɁC�o�������q�l���Z1 �����^�ʂ�1/5 �����̃����q�l�Ò��̓ˏo�ɂɑ�����ʂ����������Ƃ���C�����u�ɋ��x��NRS �œ��^�O7.2 ����15 ����2.7 �֒ቺ���C�S�̂�61���ŗL�����u�Ɋɘa�iNRS 33���ȏ�̒ቺ�ƒ�`�j������ꂽ�B�d��ȕ���p�͔F�߂��Ȃ������B
�i4�j�牺���^�Ɋւ��錤��
Enting ��23�j�ɂ��O���r�����ł́C�ˏo�ɂ̂��銳��58 ���ΏۂɁC�牺�v�Z�ʂł̑��I�s�I�C�h1 �����^�ʂ�10�`15��������hydromorphone�i43 ��j�C�����q�l�i11 ��j�Csufentanil�i4 ��j�����Ȓ��˂��C����p�i��̓I�ȋL�ڂȂ��j�̂Ȃ��͈͂ŗL���ȓ��^�ʂ܂ő��ʂ����Ƃ���C�L�����́u�悢�v84���C�u�܂��܂��v14���C�u�ς��Ȃ��v2���ł������B1 �����^�ʂ͌o�������q�l���Z280 mg/���C���σ��X�L���[�^�ʂ͔牺�����q�l���Z25 mg �ł������B���ʔ����܂ł̎��Ԃ�5�`10 ���ł������B����p�ɂ�钆�~��1 ��ł������B
����
�ȏ���C�ˏo�ɂɑ��ăI�s�I�C�h�̃��X�L���[�^�͒ɂ݂��ɘa����ƍl������B
���������āC�{�K�C�h���C���ł́C�ˏo�ɂɑ��āC�I�s�I�C�h�̃��X�L���[��𓊗^���邱�Ƃ𐄏�����B
2 �j���X�L���[��̓��^�ʁC���^�Ԋu�C���^�o�H
�i1�j���^��
�O�q�̗Տ������ł́C���X�L���[��Ƃ��Čo���E�Ö����E�牺���^�̂�����ɂ����Ă��I�s�I�C�h��1 �����^�ʂ�10�`20�������̗ʂ𓊗^���Ă���C���̓��^�ʂ͈��S���L���ł��邱�Ƃ����������B����C�����Ò��E�����牺���̏ꍇ�C�{�M�ł�1 ���ԗʁi������^�ʂ�1/24�j�̋}�����^�����X�L���[��Ƃ��čL���p�����Ă���C�o���I�Ɉ��S�Ō��ʂ�����ƍl�����Ă���B
���������āC�����̒m���Ɛ��Ƃ̍��ӂ���C�{�K�C�h���C���ł́C����̃��X�L���[��̓��^�ʂƂ��Čo�����^�ł�1 �����^�ʂ�10�`20�������̃I�s�I�C�h���������܂��C�����Ò��E�����牺���ł�1 ���ԗʂ�����̓��^�ʂƂ��ē��^���邱�Ƃ𐄏�����B�������C���X�L���[��̓��^�ʂ́C���Ɍ��ʂƕ���p��]�����C���҂̏�Ԃɉ����Ē��߂���B
�܂��C�t�F���^�j�����������܂́C������^�ʂɂ�����炸��p�ʂ���J�n���C�L���ȗp�ʂ܂ő��ʂ���B
����ɁC���X�L���[��́C�̊i���������C����ł���C�S�g��Ԃ��s�ǂł���ꍇ�ɂ́C��菭�ʂ���J�n���邱�Ƃ��]�܂����B
�i2�j���^�Ԋu
�̓��^�Ԋu�Ɋւ��ẮC�����ƂȂ�Տ������͂Ȃ��B
�{�K�C�h���C���ł́C���ꂼ��̍ō������Z�x���B���ԁiTmax�j�������Ă��C���Ƃ̍��ӂ���C�o���̏ꍇ��1 ���Ԗ��C�o�Ö����^�E�牺���^�̏ꍇ��15�`30 �����Ƃ��邱�Ƃ𐄏�����B
���X�L���[��̒lj����قړ��Ԋu�ŕK�v�ȏꍇ�́C�����ɂ̊ɘa���s�\���ł���ƍl�����邽�߁C�I�s�I�C�h�̒�����^�ʂ̑��ʂ����������iⅢ-1-3 �I�s�I�C�h�����^����Ă��銳���̍��Q�Ɓj�B
�i3�j���^�o�H
���^�o�H�́C������^����Ă���I�s�I�C�h�Ɠ����o�H���g�p���邱�Ƃ������Ƃ���B�o�����^���ł��ȕւł��邪�C���ʔ����܂łɎ��Ԃ������邽�߁C�ɂ݂��������Ă���ő�ɂȂ�܂ł̎��Ԃ̒Z���ˏo�ɂɑ��ẮC���ʔ����܂ł̎��Ԃ��Z���Ö����E�牺���^�i���Ҏ��Ȓ��ߒ��ɖ@�Fpatient control analgesia�GPCA�j�E���o�S���z���܂���������B�������C���o�S���z���܂͎����ɂ��R���g���[������Ă���ꍇ�Ɍ���B
���������^�Ɋւ��ẮC���̓��^�o�H������ȏꍇ�̓��^�o�H�̑I�����ƂȂ肤��B���X�L���[��������^����ꍇ�C���^�ʂ̓I�s�I�C�h1 �����^�ʂ�10�`20����1 �^�ʂƂ��C���^�Ԋu��Tmax����2 ���Ԃ�ڈ��Ƃ���
����
�ȏ���C�m�������m���ł͂Ȃ����C���X�L���[�^�ʂ̑��ʂɂ��ˏo�ɂɑ�����ʂ����P����\��������B
���������āC�{�K�C�h���C���ł́C�����̒m���Ɛ��Ƃ̍��ӂ��C���X�L���[��̒��Ɍ��ʂ��s�\���ł������ꍇ�C���C�����e�ł���͈͂ŁC���X�L���[��̓��^�ʂʂ��邱�Ƃ𐄏�����B�������C���X�L���[��̑��ʕ��@�͈��S���ƗL�������m�F���ꂽ�W�������ꂽ���@���Ȃ��̂ŁC���҂̌X�ɂ��킹���]���Ɗώ@���K�v�ł���B���Ȃ킿�C���X�L���[��̓��^��C�����Z�x���ō��ƂȂ鎞�Ԃ̒��Ɍ��ʁC���C�C�ċz���Ȃǂ�]�����C���C�C�ċz���̒ቺ���݂�ꂸ�ɒɂ݂��ɘa�ł��Ȃ��ꍇ�ɁC50����ڈ��Ƃ��đQ�����C���Ɍ��ʂƕ���p���p���I�ɕ]������B
���FTmax�imaximum drug concentration time�j
�ō������Z�x���B���ԁB���^��C�����Z�x���ő�k�ō������Z�x�iCmax�j�l�ɓ��B����܂ł̎��ԁB
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�t�F���^�j���S���z���܂𒆐S�ɋL�ڂ���Ă���B�ˏo�ɂɑ��Čo���̑��������܁CFBT�C�܂���INFS �𓊗^���邱�Ƃ𐄏����Ă���BFBT �܂���INFS �͌��ʔ�������葁���C�������Ԃ��Z�����߂Ɍo���̑��������܂����K�ȏꍇ������Ƃ��Ă���B���X�L���[��̓��^�ʂ͒�����^�ʂ���ꗥ�Ɍ��߂邱�Ƃ͂ł����C���ҌX�ɂ��킹�����^�ʂ̒����𐄏����Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́CNRS ��4 �ȏ�̓ˏo�ɂɑ��āC1 �����^�ʂ�10�`20���̃I�s�I�C�h���o���������͐Ö����E�牺���^���邱�Ƃ𐄏����Ă���B�o�����^�ł͓��^1 ���Ԍ�ɁC�Ö������^�ł͓��^15 ����ɁC�牺���^�ł͓��^30 ����ɍĕ]�����s���B���X�L���[��̌��ʂ��Ȃ��C�������͒ɂ݂����������ꍇ�̓��X�L���[��̓��^�ʂ�50�`100�����ʂ��Ă���ɒlj����^���s���B�ˏo�ɂ̉��P��NRS 4�`6 �܂łɂƂǂ܂�Γ��ʂ𓊗^���C�ĕ]�����s���B���ʂ̓��^��2�`3 ��J��Ԃ��CNRS 4�`6 �̂܂܂ł���ꍇ�͓��^�o�H�̕ύX����������B�ˏo�ɂ̉��P��NRS 0�`3 �ɉ��P����C�K�v�ɉ�����1 ���Ɏg�p�������X�L���[��̓��^�ʂ������^�ɒlj����邱�Ƃ𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C���X�L���[��́C1 �����^�ʂ�10�`15���̃I�s�I�C�h�𓊗^���邱�Ƃ𐄏����Ă���B1 ����4 ��ȏヌ�X�L���[����g�p����ꍇ�͒�����^�ʂ����邱�Ƃ𐄏����Ă���B
►�Տ��^��22
�莞���ɖ�̐�ڂ̒ɂ݁iend-of-dose failure�j�̂��銳�҂ɂ����ăI�s�I�C�h�̒�����^�ʂ̑��ʁE���^�Ԋu�̒Z�k�́C���ʁE���^�Ԋu�̒Z�k�����Ȃ��ꍇ�ɔ�r���āC�ɂ݂��ɘa���邩�H
����
�莞���ɖ�̐�ڂ̒ɂ݁iend-of-dose failure�j�̂��銳�҂ɂ����āC�I�s�I�C�h�̒�����^�ʂ̑��ʁC�܂��́C���^�Ԋu�̒Z�k�́C�ɂ݂��ɘa����B
�莞���ɖ�̐�ڂ̒ɂ݁iend-of-dose failure�j�̂��銳�҂ɂ����ăI�s�I�C�h�̒�����^�ʂ̑��ʁC�܂��́C���^�Ԋu�̒Z�k���s���B
���
�{�Տ��^��Ɋւ��閳��ה�r�����C�O���r�����͂Ƃ��ɂȂ����C�����u�ɂɑ�WHO ���������u�Ɏ��Ö@�̗L�p���������������̊ώ@����������C�����ł͒�����^�ʂ̑��ʂ܂��͓��^�Ԋu�̒Z�k���s�������̂��܂܂�Ă����iⅡ-3 WHO ���������u�Ɏ��Ö@�Q�Ɓj�B
1 �j����������
���������܂Ɋ֘A�����Տ������Ƃ��āC2 ���̖������r����������B
Tod ��24�j�ɂ�閳�����r�����ł́C�����q�l���������܂������^����Ă��邪��20 ���ΏۂɁC4 ���Ԗ��̃����q�l���^�ƏA�Q�O�̔{�ʓ��^���r�����B��ԂɃ��X�L���[��̎g�p���K�v�ł��������҂̊����C���E��Ԃ̒ɂ݂Ƃ��C�A�Q�O�ɔ{�ʓ��^�����Q�ɒɂ݂������i���ꂼ��C20�� vs 55���Cp��0.016�G0.8 vs 2.5�Cp��0.01�G0.5 vs 2.3�Cp��0.01�j�C��Ԃ̓ˏo�ɂ̗\�h��ړI�Ƃ����ꍇ�ɂ͏A�Q�O�̔{�ʓ��^�������^�Ԋu�̒Z�k���L���ł���ƌ��_�����B
����CDale ��25�j�ɂ�閳�����r�����ł́C�����u�ɂɑ��ă����q�l���������܂������^����Ă��銳��19 ���ΏۂɁC�\���ȃI�s�I�C�h������^�ʂ̑��ʂ��s�������ƂɁC4 ���Ԗ��̃����q�l���������܂̓��^�ƏA�Q�O�̔{�ʓ��^���r�����B���Q�ɂ������u�ɋ��x�͓����i1.3 vs 0.8�Cp��0.058�j�ł���C���^�Ԋu�̒Z�k�Ɣ�r���ďA�Q�O�̔{�ʓ��^�̗L������ے�ł��Ȃ��Ƃ��Ă���B
����
�ȏ���C���������܂����I�s�I�C�h�Ƃ��Ďg�p����ꍇ�ɒ莞���ɖ�̐�ڂ̒ɂ݂�h�����߂ɁC�I�s�I�C�h�̒�����^�ʂʂ�����@�Ɠ��^�Ԋu��Z��������@�̂����ꂪ�L�����͒m������v���Ă��炸���_�ł��Ȃ��B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂƂ��āC���������܂��g�p���Ă���ꍇ�C�莞���ɖ�̐�ڂ̒ɂ݂���������ꍇ�ɂ̓I�s�I�C�h���������܂̓������܂ޒ�����^�ʂ̑��ʁC�܂��́C���^�Ԋu�̒Z�k�̂����ꂩ���s���C���Ɍ��ʂ�]�����邱�Ƃ𐄏�����B
2 �j����������
���������܂Ɋ֘A�����Տ������́C�������r�����C�O���r�����Ƃ��ɂȂ��B���Ȃ킿�C���������܂����I�s�I�C�h�Ƃ��Ďg�p����ꍇ�ɁC������^�ʂ̑��ʂ܂��͓��^�Ԋu�̒Z�k���莞���ɖ�̐�ڂ̒ɂ݂��ɘa���邩�͖��炩�ł͂Ȃ��B
�������C�����u�ɂɑ���WHO ���������u�Ɏ��Ö@�̗L�p���������������̊ώ@����������C�����ɂ͒�����^�ʂ̑��ʂ܂��͓��^�Ԋu�̒Z�k���s�������̂��܂܂�Ă���ƍl�������iⅡ-3 WHO ���������u�Ɏ��Ö@�̍��Q�Ɓj�B�܂��C���������܂͍�p���Ԃ��������ߓ��^�ʂ̑��ʂɂ�茌���Z�x�̈ێ����\�ƂȂ�C�莞���ɖ�̐�ڂ̒ɂ݂�h���\��������ƍl������B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂƂ��āC�莞���ɖ�̐�ڂ̒ɂ݂ɑ��ď��������܂ɂ��I�s�I�C�h������^�ʂ̑��ʂ𐄏�����B
�I�s�I�C�h�̒�����^�ʂ̑��ʂɂ���Ă��莞���ɖ�̐�ڂ̒ɂ݂��Ȃ��Ȃ�Ȃ��C�������͑��ʂɂ���ĕ���p���o������ꍇ�́C24 ���ԏ��������܂ł����12 ���Ԗ��ɁC12 ���ԏ��������܂ł����8 ���Ԗ��ɓ��^���邱�Ƃ���������B
����
�ȏ���C�莞���ɖ�̐�ڂ̒ɂ݂ɑ��āC�I�s�I�C�h�̒�����^�ʂ̑��ʁC�܂��́C���^�Ԋu�̒Z�k�́C��������C�ɂ݂��ɘa����\��������ƍl������B�{�K�C�h���C���ł́C�莞���ɖ�̐�ڂ̒ɂ݂ɑ��āC�I�s�I�C�h�̒�����^�ʂ̑��ʁC�܂��́C���^�Ԋu�̒Z�k���s�����Ƃ𐄏�����B
�����̃K�C�h���C���Ƃ̐�����
�@EAPC �̃K�C�h���C���i2012�j�ł́C�����ɂ��R���g���[������Ă��Ȃ����߂̒ɂ݂̑����ɂ́C������^�ʂ����邱�Ƃ𐄏����Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C������^�ʂʂ��邱�Ƃ𐄏����Ă���B
►�Տ��^��23
���X�L���[��̓��^�Œ��Ɍ��ʂ��s�\���ȓˏo�ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�̒�����^�ʂ̑��ʂ́C���ʂ��Ȃ��ꍇ�ɔ�r���Ēɂ݂��ɘa���邩�H
����
���X�L���[��̓��^�Œ��Ɍ��ʂ��s�\���ȓˏo�ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�̒�����^�ʂ̑��ʂ́C�ɂ݂��ɘa����Ƃ��������͕s�\���ł���B
���X�L���[��̓��^�Œ��Ɍ��ʂ��s�\���ȓˏo�ɂ̂��銳�҂ɂ����āC���Ƃ֑��k�̂����C���C�����e�ł���͈͂ŃI�s�I�C�h�̒�����^�ʂʂ���B
���
�{�Տ��^��Ɋւ���Տ������͂Ȃ��B�֘A�����Տ������Ƃ���1 ���̑O���r����������B
Mercadante ��26�j�ɂ��O���r�����ł́C���]�ڂɊ֘A�����̓��ɂ���ėU�������ˏo�ɂ̂��銳��25 ���ΏۂƂ��C�����q�l�����Ò��ɂ�鑝�ʂ��s���C���Î��ɂ������iNRS ��4 �ȉ��ƒ�`�j������C�̓����ɂ�NRS ��4 �ȉ��ƂȂ�̂�ڕW�ɒ���̌o�������q�l��p�����e�ł���͈͂ő��ʂ����Ƃ���C���ÑO�̈��Î��ɁE�̓����ɂ̕���NRS �͂��ꂼ��5.3�C9.2 �ł��������C���Î��ɂ��ɘa���ꂽ�����ɂ�1.8�C4.8 �։��P���C�މ@���ɂ͂��ꂼ��2.0�C4.6 �ł������B���όo�������q�l�ʂ�102 mg/������125 mg/���ɑ��ʂ��ꂽ�B�I�s�I�C�h�̑��ʂ�W���镛��p�Ƃ��ẮC���S�E�q�f��12���C���C��4���ŔF�߂�ꂽ�B
����
�ȏ���C�I�s�I�C�h�̒�����^�ʂ̑��ʂɂ�荜�]�ڂɂ��̓����ɂ̒ɂ݂��ቺ���邱�Ƃ���������邪�C���̌����́u���X�L���[��̓��^�Œ��Ɍ��ʂ��s�\���ȓˏo�Ɂv��ΏۂƂ������̂ł͂Ȃ��C�܂��C���]�ڂɂ��̓����ɂɊւ��錤���ł���C���]�ڂɂ��̓����ɈȊO�̓ˏo�ɂł����l�ɒ��Ɍ��ʂ������邩�͕s���ł���B�܂��C���@�ɂ����ÂȂǃI�s�I�C�h������^�ʂ̑��ʈȊO�̉���ɂ����Ɍ��ʂ��֗^���Ă���\��������B
����ɁC���Î��̎����ɂ��ɘa����Ă���ł̃I�s�I�C�h�̒�����^�ʂ̑��ʂ͉ߗʓ��^�̊댯��������C���ʂ��s���ꍇ�ɁC�ǂ̂��炢�̑��ʂ��s���悢���ɂ��āC���f�ޗ��ƂȂ鍪���͑��݂��Ȃ��B
���Ȃ킿�C���X�L���[��̓��^�Œ��Ɍ��ʂ��s�\���ȓˏo�ɂɑ��āC�I�s�I�C�h�̒�����^�ʂ̑��ʂ��ɂ݂��ɘa����\���͂��邪�����͕s�\���ł���ƍl������B
���������āC�{�K�C�h���C���ł́C�����̒m���Ɛ��Ƃ̍��ӂ���C���X�L���[��̓��^�Œ��Ɍ��ʂ��s�\���ȓˏo�ɂɑ��āC���Ƃւ̑��k�̂����C���C�Ȃǂ̕���p���o�����Ȃ��͈͂ŃI�s�I�C�h�̒�����^�ʂ̑��ʂ��������邱�Ƃ𐄏�����B���ʕ��́C���S���̓_����20����ڈ��Ƃ����T�d�ȑ��ʂ��s���C�p�����ď\���Ȋώ@���s�����Ƃ��]�܂����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�CESMO �̃K�C�h���C���i2012�j�����NCCN �� �K�C�h���C���i2012�j�ɂ����āC�ˏo�ɂɑ��ăI�s�I�C�h�̒�����^�ʂ̑��ʂ� �ւ��Č��y���Ă�����̂͂Ȃ��B
►�Տ��^��24
�ˏo�ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�ɔ�I�s�I�C�h���ɖ�p���邱 �Ƃ́C���p���Ȃ��ꍇ�ɔ�r���Ēɂ݂��ɘa���邩�H
����
�ˏo�ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�ɔ�I�s�I�C�h���ɖ�p���� ���Ƃ́C�ɂ݂��ɘa����\��������B
�ˏo�ɂ̂��銳�҂ɂ����āC�I�s�I�C�h�ɔ�I�s�I�C�h���ɖ�p����B
���
�{�Տ��^��Ɋւ��閳�����r�����C�O���r�����͂Ƃ��ɂȂ��B���Ȃ킿�C�ˏo�ɂɑ��ăI�s�I�C�h�ɔ�I�s�I�C�h���ɖ�p���邱�Ƃ��C�I�s�I�C�h�P�Ɠ��^�Ɣ�r���Ēɂ݂����P���邩�͖��炩�ł͂Ȃ��B
�������֘A�����m���Ƃ��āC�S�ʓI�Ȓɂ݂ɑ��Ĕ�I�s�I�C�h���ɖ�E�I�s�I�C�h�̕��p�ɂ��C���Ɍ��ʂ��������邱�Ƃ�������Ă����i�Տ��^��12 �Q�Ɓj�B
���������āC�{�K�C�h���C���ł́C��I�s�I�C�h���ɖ��^����Ă��Ȃ��ꍇ�̓I�s�I�C�h�ɔ�I�s�I�C�h���ɖ�p���邱�Ƃ𐄏�����B�������C���̒��Ɍ��ʂ͒����x�ł���C����NSAIDs ���g�p����ꍇ�͒������^�ɂ�蕛��p�̔����p�x�������Ȃ邽�߁C���Ɍ��ʂƕ���p��]�����������^���s�������f����̂��]�܂����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2002�j�ł́CNSAIDs �Ȃǂ̍R���ǖ�́C���]�ڂɂ��ɂ݂�S���E�畆�a�ςɊ֘A����ˏo�ɂɑ��ėL���ȉ\��������Ƃ��Ă���B
EAPC �̃K�C�h���C���i2012�j�ł́C�ˏo�ɂɑ��ăI�s�I�C�h�Ɣ�I�s�I�C�h���ɖ�̕��p�ɂ��Ă̋L�ڂ͂Ȃ��B
�y�� ���z
�Տ��^��21
1�j Farrar JT, Cleary J, Rauck R, et al. Oral transmucosal fentanyl citrate�Frandomized, double-blinded, placebo-controlled trial for treatment of breakthrough pain in cancer patients. J Natl Cancer Inst 1998�G90�F611-6
2�j Portenoy RK, Taylor D, Messina J, et al. A randomized, placebo-controlled study of fentanyl buccal tablet for breakthrough pain in opioid-treated patients with cancer. Clin J Pain 2006�G22�F805-11
3�j Portenoy RK, Messina J, Xie F, et al. Fentanyl buccal tablet�iFBT�jfor relief of breakthrough pain in opioid-treated patients with chronic low back pain�Fa randomized, placebo-controlled study. Curr Med Res Opin 2007�G23�F223-33
4�j Kress HG, Orońska A, Kaczmarek Z, et al. Efficacy and tolerability of intranasal fentanyl spray 50 to 200 microg for breakthrough pain in patients with cancer�Fa phase Ⅲ, multinational, randomized, double-blind, placebo-controlled, crossover trial with a 10-month, open-label extension treatment period. Clin Ther 2009�G31�F1177-91
5�j Mercadante S, Radbruch L, Davies A, et al. A comparison of intranasal fentanyl spray with oral transmucosal fentanyl citrate for the treatment of breakthrough cancer pain�Fan open-label, randomised, crossover trial. Curr Med Res Opin 2009�G25�F2805-15
6�j Lennernäs B, Frank-Lissbrant I, Lennernäs H, et al. Sublingual administration of fentanyl to cancer patients is an effective treatment for breakthrough pain�Fresults from a randomized phase Ⅱ study. Palliat Med 2010�G24�F286-93
7�j Portenoy RK, Burton AW, Gabrail N, et al. A multicenter, placebo-controlled, double-blind, multiple-crossover study of Fentanyl Pectin Nasal Spray�iFPNS�jin the treatment of breakthrough cancer pain. Pain 2010�G151�F617-24
8�j Taylor D, Galan V, Weinstein SM, et al. Fentanyl pectin nasal spray in breakthrough cancer pain. J Support Oncol 2010�G8�F184-90
9�j Zeppetella G, Messina J, Xie F, et al. Consistent and clinically relevant effects with fentanyl buccal tablet in the treatment of patients receiving maintenance opioid therapy and experiencing cancer-related breakthrough pain. Pain Pract 2010�G10�F287-93
10�j Coluzzi PH, Schwartzberg L, Conroy JD, et al. Breakthrough cancer pain�Fa randomized trial comparing oral transmucosal fentanyl citrate�iOTFC�jand morphine sulfate immediate release�iMSIR�j. Pain 2001�G91�F123-30
11�j Davies A, Sitte T, Elsner F, et al. Consistency of efficacy, patient acceptability, and nasal tolerability of fentanyl pectin nasal spray compared with immediate-release morphine sulfate in breakthrough cancer pain. J Pain Symptom Manage 2011�G41�F358-66
12�j Fallon M, Reale C, Davies A, et al. Efficacy and safety of fentanyl pectin nasal spray compared with immediate-release morphine sulfate tablets in the treatment of breakthrough cancer pain�Fa multicenter, randomized, controlled, double-blind, double-dummy multiple-crossover study. J Support Oncol 2011�G9�F224-31
13�j Nalamachu S, Hassman D, Wallace MS, et al. Long-term effectiveness and tolerability of sublingual fentanyl orally disintegrating tablet for the treatment of breakthrough cancer pain. Curr Med Res Opin 2011�G27�F519-30
14�j Zeppetella G, Ribeiro MD. Opioids for the management of breakthrough�iepisodic�jpain in cancer patients. Cochrane Database Syst Rev 2006�i2�j�FCD004311
15�j Gordon DB. Oral transmucosal fentanyl citrate for cancer breakthrough pain�Fa review. Oncol Nurs Forum 2006�G33�F257-64
16�j Elsner F, Zeppetella G, Porta-Sales J, et al. Newer generation fentanyl transmucosal products for breakthrough pain in opioid-tolerant cancer patients. Clin Drug Investig 2011�G31�F605-18
17�j Hansen MS, Mathiesen O, Trautner S, et al. Intranasal fentanyl in the treatment of acute pain-a systematic review. Acta Anaesthesiol Scand 2012�G56�F407-19
18�j Dietrich E, Gums JG. Intranasal fentanyl spray�Fa novel dosage form for the treatment of breakthrough cancer pain. Ann Pharmacother 2012�G46�F1382-91
19�j Smith H. A comprehensive review of rapid-onset opioids for breakthrough pain. CNS Drugs 2012�G26�F509-35
20�j Mercadante S, Villari P, Ferrera, P et al. Transmucosal fentanyl vs intravenous morphine in doses proportional to basal opioid regimen for episodic-breakthrough pain. Br J Cancer 2007�G96�F1828-33
21�j Mercadante S, Villari P, Ferrera P, et al. Safety and effectiveness of intravenous morphine for episodic�ibreakthrough�jpain using a fixed ratio with the oral daily morphine dose. J Pain Symptom Manage 2004�G27�F352-9
22�j Mercadante S, Intravaia G, Villari P, et al. Intravenous morphine for breakthrough�iepisodic-�j pain in an acute palliative care unit�Fa confirmatory study. J Pain Symptom Manage 2008�G35�F307-13
23�j Enting RH, Mucchiano C, Oldenmenger WH, et al. The�gpain pen�hfor breakthrough cancer pain�Fa promising treatment. J Pain Symptom Manage 2005�G29�F213-7
�Տ��^��22
24�j Todd J, Rees E, Gwilliam B, et al. An assessment of the efficacy and tolerability of a�gdouble dose�hof normal-release morphine sulphate at bedtime. Palliat Med 2002�G16�F507-12
25�j Dale O, Piribauer M, Kaasa S, et al. A double-blind, randomized, crossover comparison between single-dose and double-dose immediate-release oral morphine at bedtime in cancer patients. J Pain Symptom Manage 2009�G37�F68-76
�Տ��^��23
26�j Mercadante S, Villari P, Ferrera P, et al. Optimization of opioid therapy for preventing incident pain associated with bone metastases. J Pain Symptom manage 2004�G28�F505-10
�Q
�I�s�I�C�h�ɂ�镛��p
�P
���S�E�q�f
�� �I�s�I�C�h�����^���ꂽ���҂ɂ����āC���S�E�q�f�������������ɗL���Ȏ��Â͉����H
�֘A����Տ��^��
- ►25�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�s���ׂ��]���͉����H
- ►26�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC���f��́C�v���Z�{�ɔ�r���Ĉ��S�E�q�f�����P���邩�H
- ►27�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�I�s�I�C�h�̕ύX�i�I�s�I�C�h�X�C�b�`���O�j�́C�ύX���Ȃ����Ƃɔ�r���Ĉ��S�E�q�f�����P���邩�H
- ►28�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�I�s�I�C�h�̓��^�o�H�̕ύX�́C�ύX���Ȃ����Ƃɔ�r���Ĉ��S�E�q�f�����P���邩�H
����
- ►25���S�E�q�f�����鑼�̗v�����ӕʂ��C���Â���������B
- ►26 �I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�z�肳���@�����琧�f���I�����C���^����B
1C�i���������C�ƂĂ��Ⴂ�G�r�f���X���x���j - ►27�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�I�s�I�C�h��ύX����B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►28�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�I�s�I�C�h�̌o�����^�������Ò��E�����牺���ɕύX����B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j
►�Տ��^��25
�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�s���ׂ��]���͉����H
����
���S�E�q�f�����鑼�̗v�����ӕʂ��C���Â���������B
���
���҂̈��S�E�q�f�̌����Ƃ��ăI�s�I�C�h�ȊO�ɁC�i�W�M�^���X�C�R�ۖ�C�S�܁C�R����܂Ȃǁj�C�����펾���i�ݒ�ᇁC�����ǕǁC�֔�Ȃǁj�C�d�����ُ�i���J���V�E�����ǁC��i�g���E�����ǂȂǁj�C�����ǁC�������C�����_�o�n�̕a�ρi�]�]�ځC���������Ȃǁj�C���ː����ÂȂǂ�����B�����̌����ɂ͎��É\�Ȃ��̂����邽�߁C�I�s�I�C�h�ɂ�鈫�S�E�q�f�Ɣ��f����O�Ɏ��É\�Ȍ�����]�����C���Â���������B
��̓I�ɂ́C���^���m�F���C���S�̔�������Ƃ̎��ԊW����������B�܂��C����������_�o�����ȂǗ��w�������Ƃ�C���t�����i��J���V�E���l��1���܂ށj�C�����P��X ���ʐ^�C�����摜�������������邱�Ƃɂ��C��v�Ȉ��S�E�q�f�̌������ӕʂ��邱�Ƃ��ł���B
�I�s�I�C�h�������ƍl������ꍇ�́C���^��ʂ̒���ł͐����Ԃőϐ����ł��邱�Ƃ��������߉\�ł���Όo�߂��݂�B���Ɍ��ʂ��\���ł���I�s�I�C�h�����X�Ɍ��ʂ��C���Ɍ��ʂ��s�\���ł���Δ�I�s�I�C�h���ɖ�E�_�o�u���b�N��2�E���ː����ÂȂǑ��̒��Ɏ�i�������ăI�s�I�C�h�����ʂł��邩����������B�����q�l�����^����Ă���ꍇ�C�t�@�\��Q��������ƃ����q�l�̓��^�ʂ͓���ł������q�l�̑�ӎY�����~�ς��邱�Ƃɂ�舫�S�E�q�f�����邱�Ƃ�����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�ɂ݂��ɘa����Ă��銳�҂ɂ����āC�����q�l�ɂ�镛��p�����ƂȂ��Ă���ꍇ�́C�����q�l���^�ʂ����ʂ��邱�ƂŁC�����̕���p���y���ł���\��������Ƃ��Ă���B�܂��C�����_�o�n�̕a�ρC��Ӑ���Q�i���J���V�E�����ǂȂǁj�C�s���ǁC�����ǕǁC�i�R�ۖ�CNSAIDs�C���w�Ö@�j�C���ː����Ẩ\����]�����C��Ӑ������i���J���V�E�����ǂȂǁj�C�E���C�s���ǂ͎��Â��C�K�v�����Ȃ�����p���Ă��邩������Ȃ��͒��~����ׂ��Ƃ��Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C���S���݂�ꂽ�ꍇ�C������従��̗L�����m���߂邱�ƁC�I�s�I�C�h�ȊO�̈��S�̌����i�֔�C�����_�o�n�̕a�ρC���w�Ö@�C���ː����ÁC���J���V�E�����ǂȂǁj�����O���邱�Ƃ𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�_�o�u���b�N����ː����ÁC���̒��ɖ�p���邱�ƂŃI�s�I�C�h���^�ʂ����炵���S�����P�ł��邱�Ƃ�����Ƃ��Ă���B
��1�F��J���V�E���l���J���V�E���l�{�i4.0-�A���u�~���l�j�B���҂ł̓A���u�~�����ቺ���Ă��邱�Ƃ��������ߒ��ӂ���B
��2�F�_�o�u���b�N
�Ǐ��������_�o�j���C�M�Ȃǂɂ��_�o�̓`�B�@�\���ꎞ�I�E�i�v�I�ɎՒf���邱�Ƃɂ���āC�܂��́C�I�s�I�C�h�Ȃǒ��ɖ�̍d���O�o�E�N�������o�ւ̓��^�ɂ���Ē��Ɍ��ʂ��i�B
�i���߁j���`�̐_�o�u���b�N�͈�ʓI�ɑO�҂������C��҂Ƃ��킹�����̂��ȓI���Ɂianesthesiological procedure�j�ƌĂԂ��Ƃ����邪�C�{�K�C�h���C���ł́C�ȕւɁC���������킹�āu�_�o�u���b�N�v�ƌĂԁB
►�Տ��^��26
�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC���f��́C�v���Z�{�ɔ�r���Ĉ��S�E�q�f�����P���邩�H
����
�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC���f��́C���S�E�q�f�����P����B
�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�z�肳���@�����琧�f���I�����C���^����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC4 ���̌n���I���r���[�����邪�iGlare ��1�j�CNaeim ��2�j�CMcNicol ��3�j�CLaugsand ��4�j�j�C���̍����Տ������͂قƂ�ǂȂ��B
1 �j�z�肳���@���ɉ��������f��̎g�p
�z�肳���@���ɂ�萧�f����g�p���邱�Ƃ̗L�p�����������������Ƃ��āC3 �̑O���r����������BBentley ��5�j�́C�ɘa�P�A�a���ɓ��@���Ă���37 ��̂��҂ɑ��āC�z�肳���a�Ԃɉ����Đ��f��𓊗^�����Ƃ���C���S��82���C�q�f��84���ɗՏ��I�ȉ��P���݂�ꂽ�BLichter ��i1993�j6�j�́C87 ��̏I�������҂ɑ��āC�z�肳���a�Ԃɉ��������S�E�q�f�̎��Â��s�����Ƃ���C48 ���Ԉȓ���93���̊��҂ɂ����Ĉ��S�E�q�f���Տ��I�ɉ��P�����BStephenson ��7�j�́C�ɘa�P�A�a���ɓ��@���Ă���61 ��̂��҂ɑ��ĕa�Ԃɉ��������S�E�q�f�̎��Â��s�����B�����́C�����lj^���̒ቺ�i44���j�C�I�s�I�C�h���܂ޖȂǂɂ�鉻�w��e�̂̎h���i33���j�Ȃǂł���C1 �T�Ԉȓ��Ɉ��S��56���C�q�f��89�����R���g���[�����ꂽ�B
2 �j���I���̐��f��
�I�s�I�C�h�ɂ�鈫�S�E�q�f�Ɋւ��鎿�̍����Տ������͂Ȃ��B
�i1�j�h�p�~����e�̝h�R��i�n���y���h�[���C�v���N�����y���W���Ȃǁj
�I�s�I�C�h�ɂ�鈫�S�E�q�f�Ɍ��肵���͂Ȃ��B�n���y���h�[���ɂ��ẮC�I�s�I�C�h�ɂ�鈫�S�ɂ͌��肳��Ă��Ȃ����CCritchley ��8�j�ɂ��n���I���r���[�ł́C�����ǕǁC�����q�l�̍d���O���^�C�������킩��Ȃ����҂̈��S�E�q�f�ɑ��ėL���ł���\��������ƌ��_����Ă���B
�i2�j������従����i��i���g�N���v���~�h�C�h���y���h���j
�I�s�I�C�h�ɂ�鈫�S�E�q�f�Ɍ��肵���͂Ȃ��BBruera ��9�j�ɂ��C�����I�Ȉ��S��i����26 ��̂��҂�ΏۂƂ����������r�����ł́C�v���Z�{�ɔ�r���ď��������g�N���v���~�h�����SVAS����L�ӂɒቺ�������i���ÑO���VAS�F17 vs 12�Cp��0.04�j�B
�i3�j�R�q�X�^�~����i�W�t�F���q�h���~��/�W�v���t�B�����C�N�����t�F�j���~���}���C���_���C�q�h���L�V�W���Ȃǁj
�I�s�I�C�h�ɂ�鈫�S�E�q�f�Ɍ��肵���͂Ȃ��B���S��ΏۂƂ����O���r�����ł�cyclizine ��N�����t�F�j���~���}�C�����_�����g�p����Ă���iMorita ��j�B
3 �j���I���̐��f��
���I���̐��f�����ł���ꍇ�ɁC���f��Ƃ��Ďg�p����Ă����܂́C���^�R���_�a��i�I�����U�s���C���X�y���h���j�C�t�F�m�`�A�W���n�R���_�a��i�N�����v���}�W���Ȃǁj�C�Z���g�j���h�R��Ȃǂł���B�����̖�܂Ɋւ��鎿�̍����Տ������͂قƂ�ǂȂ��B
Hardy ��10�j�ɂ��C�I�s�I�C�h���^���Ă���I�������҂ň��S�E�q�f��i���Ă���92 ���ΏۂɁC�I���_���Z�g����24 mg�C���g�N���v���~�h30 mg�C�v���Z�{��p�����������r�����ł́C�v���Z�{�Q�C�I���_���Z�g�����Q�C���g�N���v���~�h�Q�ł��ꂼ��33���C48���C52����24 ���Ԉȓ��ɚq�f�����S�ɏ����������C�Q�ԍ��͂Ȃ������B
�܂��C������S�ɑ��鏭����̋L�q�I�����ŁC�I�����U�s����X�y���h���Ȃǂ̔��^�R���_�a��̗L�p������������Ă���BPassik ��11�j�̓I�s�I�C�h���g�p���Ă���15 ��̂��҂�ΏۂƂ��āC�I�����U�s��2.5�C5�C10 mg �����ꂼ��2 ���Ԃ����^�����Ƃ���C���ׂĂ̗p�ʂɂ����ē��^�O�Ɣ�r���Ĉ��S�̉��P��F�߂��BOkamoto ��ɂ�����������ł́C�I�s�I�C�h�ɂ�鈫�S�E�q�f��i���邪��20 ��ɑ��ă��X�y���h��1 mg/�����g�p���C50���ň��S�C64���Śq�f�����������BEisenchlas ��12�j�̑O���������ł́C���҂̓�����S70 ��i�I�s�I�C�h�ɂ�鈫�S2 ��j�ɑ��ă��{���v���}�W��3�`25 mg/���i�����l6 mg�j�牺���^��2 ����ɂ͈��SNRS���̒����l��8 ����1 �ɒቺ���C86����NRS 6 �ȏ�̈��S�̉��P�C92���Śq�f�����������B��ȕ���p�Ƃ��ẮC�����l2/10 �̒��Â��݂�ꂽ�B
����
�ȏ���C�m���͏\���ł͂Ȃ����̂́C����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�ɂ݂��ɘa����ƍl������B
���������Ė{�K�C�h���C���ł́C����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC���̋@���ɂ�邪���u�ɂƓ��l�ɁC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s�����Ƃ𐄏�����B�ȏ���C�I�s�I�C�h�ɂ�鈫�S�E�q�f�ɑ��Đ��f��̌��ʂ����邱�Ƃ��������̍����m���͂قƂ�ǂȂ����C�Տ��o������C�I�s�I�C�h�̓��^�����S�E�q�f�������҂ɑ��Đ��f��𓊗^���邱�Ƃ́C���S�E�q�f�����P���邱�ƂɗL�p�ȉ\��������ƍl������B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂ���C�I�s�I�C�h�̓��^�����S�E�q�f�������҂ɑ��āC�z�肳����ȋ@�����琧�f���I�������^���邱�Ƃ𐄏�����B
���f��Ƃ��ẮC�g�p�o�����L�x�ȃh�p�~����e�̝h�R��C������従����i��C�܂��́C�R�q�X�^�~�������I���Ƃ���B�I���̖ڈ��Ƃ��āC�����I�Ȉ��S�E�q�f�ɂ̓h�p�~����e�̝h�R��C�H��̈��S�E�q�f�ɂ͏�����従����i��C���쎞�̈��S�E�q�f�ɂ͍R�q�X�^�~������g�p����B���I���̐��f�����ł������ꍇ�ɂ́C���I���̐��f���2 ��ޕ��p���邩�C�܂��́C���I���̐��f��Ƃ��āC���^�R���_�a��C�t�F�m�`�A�W���n�R���_�a��C�܂��̓Z���g�j���h�R��̂����ꂩ���g�p����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�ɂ�鈫�S�������҂ɑ��āC�n���y���h�[���Ȃǂ̍R�h�p�~�����g�N���v���~�h�Ȃǂ̍R�h�p�~����p�Ƒ��̍�p��������܂��g�p���邱�Ƃ𐄏����Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C���I���Ƃ��āC�v���N�����y���W��10 mg ��6 ���Ԗ��̓��^�C�n���y���h�[��0.5�`1 mg ��6�`8 ���Ԗ��̓��^�C�܂��́C���g�N���v���~�h10�`20 mg ��6�`8 ���Ԗ��̓��^�𐄏����Ă���B���I���Ƃ��āC�Z���g�j���h�R���1 �T�Ԓ莞�����Ƃ����̌�ڗp�Ƃ��邱�Ƃ𐄏����Ă���B
���FVAS�ivisual analogue scale�j
100 mm �̐��̍��[���u�ɂ݂Ȃ��v�C�E�[���u�ň��̒ɂ݁v�Ƃ����ꍇ�C���҂̒ɂ݂̒��x��\���Ƃ���Ɉ��t���Ă��炤���́B�Q��
���FNRS�inumerical rating scale�j
�ɂ݂�0 ����10 ��11 �i�K�ɕ����C�ɂ݂��S���Ȃ��̂�0�C�l������Ȃ��ōň��̒ɂ݂�10 �Ƃ��āC�ɂ݂̓_����₤���́B�Q���B
►�Տ��^��27
�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�I�s�I�C�h�̕ύX�i�I�s�I�C�h�X�C�b�`���O�j�́C�ύX���Ȃ����Ƃɔ�r���Ĉ��S�E�q�f�����P���邩�H
����
�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�I�s�I�C�h�̕ύX�i�I�s�I�C�h�X�C�b�`���O�j�́C���S�E�q�f�����P����B
�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�I�s�I�C�h��ύX����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�n���I���r���[��3 ������B�������r�����͂Ȃ��C�O���r������3 ������B
Laugsand ��4�j�ɂ��n���I���r���[�ł́C�I�s�I�C�h�ɂ�鈫�S�E�q�f�̃}�l�W�����g�ɂ��āC55 ���̕��������r���[���C���̂���17 �����I�s�I�C�h�̕ύX�ɂ�鈫�S�E�q�f�̕ω��Ɋւ��錤���ł��������C����������̍����Տ������ł͂Ȃ������B�����āC���S�̂��銳�҂ɂ����ă����q�l����I�L�V�R�h���Ȃǂ̑��̃I�s�I�C�h�ɕύX���邱�Ƃɂ��ẮC�ア�����ƌ��_�Â��Ă���B
Quigey ��13�j�ɂ��n���I���r���[�ł́C�ɂ݂̂��銳�҂ɑ���I�s�I�C�h�̕ύX�̗L�����ɂ���52 ���̕��������r���[���C�I�s�I�C�h��ύX���邱�Ƃ��u�Ɋɘa�ƃI�s�I�C�h�ɂ�镛��p���y�����邽�߂ɗL���Ȏ�i�ł���ƌ��_�Â��Ă���B
Mercadante ��14�j�ɂ��n���I���r���[�ł́C31 ���̕��������r���[���C1 ��ނ̃I�s�I�C�h���u�Ɋɘa���s�\���Ȋ��҂ɑ��ăI�s�I�C�h�̕ύX���s�����Ƃ�50���ȏ�̊��҂ɂ����ėՏ��I�ȉ��P���F�߂��C�I�s�I�C�h�̕ύX��70�`80���̊��҂��u�Ɋɘa�ƕ���p�̃o�����X�����P���邩������Ȃ��ƌ��_�Â����B
Ashby ��15�j�ɂ��C�I�s�I�C�h�̂��ߑς����Ȃ�����p�i���S�E�q�f�C���C�C����ρj���Ă��邪��49 ���ΏۂƂ��C�I�s�I�C�h�̕ύX���s�����O���r�����ł́C���f������p���Ȃ��爫�S�E�q�f���y���������C���邢�́C���f���K�v�Ƃ������S�E�q�f�������������̂�68���i19 �ᒆ13 ��j�ł������B�����q�l����t�F���^�j���֕ύX�����ꍇ��73���i11 �ᒆ8 ��j�C�I�L�V�R�h������t�F���^�j���֕ύX�����ꍇ��100���i2 �ᒆ2 ��j�C�����q�l����I�L�V�R�h���֕ύX�����ꍇ��60���i5 �ᒆ3 ��j�ň��S�E�q�f���Տ��I�ɉ��P�������͏��������B
Narabayashi ��16�j�ɂ��C�o�������q�l���u�Ɋɘa���s�\���������͕���p�ɂ��p���������27 ��̂��҂�ΏۂƂ��C�I�L�V�R�h���ւ̕ύX���s�����O���r�����ł́C���S��F�߂�13 ��C�q�f��F�߂�5 ��̑S��ň��S�E�q�f�����������i2.3��0.4�C2.2��0.2�C4 �i�K�j�B
����
�ȏ���C����������̍����G�r�f���X�ł͂Ȃ����C�I�s�I�C�h�����^���ꈫ�S�E�q�f�������������҂ɑ��āC�I�s�I�C�h�̕ύX�́C���S�E�q�f�����P����\��������ƍl������B
���������āC�{�K�C�h���C���ł́C�I�s�I�C�h�����^���ꈫ�S�E�q�f�������������҂ɑ��āC�I�s�I�C�h��ύX���邱�Ƃ𐄏�����B�I�s�I�C�h�́C�����q�l����I�L�V�R�h���܂��̓t�F���^�j���ɁC���邢�́C�I�L�V�R�h������t�F���^�j���ɕύX����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̕���p�����ƂȂ�ꍇ�ɂ́C�I�s�I�C�h��ύX���邱�Ƃ��キ�������Ă���B
NCCN �̃K�C�h���C���i2012�j�����ESMO �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̌��ʁC���f��̕��p�Ȃǂ��s���Ă����S�������ꍇ�́C���S�̌����ƒ��x���ĕ]�����C�I�s�I�C�h��ύX���邱�ƂŒ��Ɍ��ʂ��ێ����Ȃ��畛��p�����炷���Ƃ��ł���\��������Ƃ��Đ������Ă���B
►�Տ��^��28
�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�I�s�I�C�h�̓��^�o�H�̕ύX�́C�ύX���Ȃ����Ƃɔ�r���Ĉ��S�E�q�f�����P���邩�H
����
�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�I�s�I�C�h�̓��^�o�H�̕ύX�́C���S�E�q�f�����P����\��������B
�I�s�I�C�h�����^����C���S�E�q�f�������������҂ɑ��āC�I�s�I�C�h�̌o�����^�������Ò��E�����牺���ɕύX����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�n���I���r���[��1 ������B�������r�����͂Ȃ��C�O���r������2 ������B
Laugsand ��4�j�ɂ��n���I���r���[�ł́C�I�s�I�C�h�ɂ�鈫�S�E�q�f�̃}�l�W�����g�ɂ��āC55 ���̕��������r���[���C���̂���6 �����I�s�I�C�h�̓��^�o�H�̕ύX�ɂ�鈫�S�E�q�f�̕ω��Ɋւ��錤���ł��������C����������̍����Տ������ł͂Ȃ������B�����āC���S�E�q�f�ɑ��ă����q�l�̌o�����^��牺���^�ɕύX���邱�Ƃɂ��ẮC�ア�����ƌ��_�Â��Ă���B
Enting ��17�j�ɂ��O���r�����ł́C�I�s�I�C�h�ɂ���u�Ɋɘa���s�\����100��̊��҂�ΏۂƂ��C�I�s�I�C�h��Ö������^�E�牺���^�ɕύX�i��ȕύX�́C�o�������q�l��Ö������^�E�牺���^�C�t�F���^�j���\�t�܂��t�F���^�j���������q�l�̐Ö������^�E�牺���^�j�����Ƃ���C�ɂ݂̉��P�Ƃ��킹�āC66���i23 �ᒆ20��j�ň��S�E�q�f�̗Տ��I�ȉ��P�������͏������F�߂�ꂽ�B�V���ɕ���p���o�������̂�12 ��ł��������C�d�Ăȕ���p�͔F�߂Ȃ������B
����
�ȏ���C����ꂽ�m���ł��邪�C�I�s�I�C�h�����^���ꈫ�S�E�q�f�������������҂ɑ��āC�I�s�I�C�h�̓��^�o�H�̕ύX�́C���S�E�q�f�����P����\��������ƍl������B
�{�K�C�h���C���ł́C���Ƃ̍��ӂ���C�I�s�I�C�h�����^���ꈫ�S�E�q�f�������������҂ɑ��āC�o�����^�������Ò��E�����牺���ɕύX���邱�Ƃ𐄏�����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2001b�j�ł́C�o�������q�l����牺���^�ɕύX���邱�Ƃň��S�E�q�f�����P���邱�Ƃ�����Ƃ��Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C���^�o�H�̕ύX�œ��l�̒��Ɍ��ʂ�ۂ��Ȃ��爫�S�E�q�f�����P�ł���\��������Ƃ��Ă���B
�i�l��@�~�C���Ԉ�q�C�V���q�q�C�u�^�וv�C�ז���I�j
�y�� ���z
�Տ��^��26
1�j Glare P, Pereira G, Kristjanson LJ, et al. Systematic review of the efficacy of antiemetics in the treatment of nausea in patients with far-advanced cancer. Support Care Cancer 2004�G12�F432-40
2�j Naeim A, Dy SM, Lorenz KA, et al. Evidence-based recommendations for cancer nausea and vomiting. J Clin Oncol 2008�G26�F3903-10
3�j McNicol E, Horowicz-Mehler N, Fisk RA, et al. Management of opioid side effects in cancer-related and chronic noncancer pain�Fa systematic review. J Pain 2003�G4�F231-56
4�j Laugsand EA, Kaasa S, Klepstad P. Management of opioid-induced nausea and vomiting in cancer patients�Fsystematic review and evidence-based recommendations. Palliat Med 2011�G25�F442-53
5�j Bentley A, Boyd K. Use of clinical pictures in the management of nausea and vomiting�Fa prospective audit. Palliat Med 2001�G15�F247-53
6�j Lichter I. Results of antiemetic management in terminal illness. J Palliat Care 1993�G9�i2�j�F19-21
7�j Stephenson J, Davies A. An assessment of aetiology-based guidelines for the management of nausea and vomiting in patients with advanced cancer. Support Care Cancer 2006�G14�F348-53
8�j Critchley P, Plach N, Grantham M, et al. Efficacy of haloperidol in the treatment of nausea and vomiting in the palliative patient�Fa systematic review. J Pain Symptom Manage 2001�G22�F631-4
9�j Bruera E, Belzile M, Neumann C, et al. A double-blind, crossover study of controlled-release metoclopramide and placebo for the chronic nausea and dyspepsia of advanced cancer. J Pain Symptom Manage 2000�G19�F427-35
10�j Hardy J, Daly S, McQuade B, et al. A double-blind, randomised, parallel group, multinational, multicentre study comparing a single dose of ondansetron 24 mg p. o. with placebo and metoclopramide 10 mg t. d. s. p. o. in the treatment of opioid-induced nausea and emesis in cancer patients Support Care Cancer 2002�G10�F231-6
11�j Passik SD, Lundberg J, Kirsh KL, et al. A pilot exploration of the antiemetic activity of olanzapine for the relief of nausea in patients with advanced cancer and pain. J Pain Symptom Manage 2002�G23�F526-32
12�j Eisenchlas JH, Garrigue N, Junin M, De Simone GG. Low-dose levomepromazine in refractory emesis in advanced cancer patients�Fan open-label study. Palliat Med 2005�G19�F71-5
�Տ��^��27
13�j Quigley C. Opioid switching to improve pain relief and drug tolerability. Cochrane Database Syst Rev 2004�i3�j�FCD004847
14�j Mercadante S, Bruera E. Opioid switching�Fa systematic and critical review. Cancer Treat Rev 2006�G32�F304-15
15�j Ashby MA, Martin P, Jackson KA. Opioid substitution to reduce adverse effects in cancer pain management. Med J Aust 1999�G170�F68-71
16�j Narabayashi M, Saijo Y, Takenoshita S, et al. Opioid rotation from oral morphine to oral oxycodone in cancer patients with intolerable adverse effects�Fan open-label trial. Jpn J Clin Oncol 2008�G38�F296-304
�Տ��^��28
17�j Enting RH, Oldenmenger WH, van der Rijt CC, et al. A prospective study evaluating the response of patients with unrelieved cancer pain to parenteral opioids. Cancer 2002�G94�F3049-56
�y�Q�l�����z
�Տ��^��26
18�j Lichter I. Which antiemetic? J Palliat Care 1993�G9�F42-50
19�j Morita T, Tei Y, Shishido H, Inoue S. Chlorpheniramine maleate as an alternative to antiemetic cyclizine. J Pain Symptom Manage 2004�G27�F388-90
20�j Okamoto Y, Tsuneto S, Matsuda Y, et al. A retrospective chart review of the antiemetic effectiveness of risperidone in refractory opioid-induced nausea and vomiting in advanced cancer patients. J Pain Symptom Manage 2007�G34�F217-22
21�j Khojainova N, Santiago-Palma J, Kornick C, et al. Olanzapine in the management of cancer pain. J Pain Symptom Manage 2002�G23�F346-50
22�j Mystakidou K, Befon S, Liossi C, Vlachos L. Comparison of the efficacy and safety of tropisetron, metoclopramide, and chlorpromazine in the treatment of emesis associated with far advanced cancer. Cancer 1998�G83�F1214-23
�Q
�ց@��
�� �I�s�I�C�h�����^���ꂽ���҂ɂ����āC�֔����������������ɗL���Ȏ��Â͉����H
�֘A����Տ��^��
- ►29�I�s�I�C�h�����^����C�֔邪�����������҂ɑ��āC�s���ׂ��]���͉����H
- ►30�I�s�I�C�h�����^����C�֔邪�����������҂ɑ��āC���܂́C�v���Z�{�ɔ�r���ĕ֔�����P���邩�H
- ►31�I�s�I�C�h�����^����C�֔邪�����������҂ɑ��āC�I�s�I�C�h�̕ύX�i�I�s�I�C�h�X�C�b�`���O�j�́C�ύX���Ȃ����Ƃɔ�r���ĕ֔�����P���邩�H
����
- ►29�֔�����鑼�̗v�����ӕʂ��C���Â���������B
�܂��C�r�ւ̏悵�C������f�@���C���ǂƏh�ւ̗L���ɂ��ĕ]������B - ►30�I�s�I�C�h�����^����C�֔邪�����������҂ɑ��āC���܂𓊗^����B
���܂́C�ւ̐���ɂ��킹�āC��ɕւ��d���ꍇ�͐Z���������܂��C��ɒ�従����ቺ���Ă���ꍇ�͑咰�h�������܂��g�p����B���ʂ��s�\���ł���Η��҂p����B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►31�I�s�I�C�h�����^����C�֔邪�����������҂ɑ��āC���܂̓��^��o�����I���u�ŕ֔邪���P���Ȃ��ꍇ�́C�I�s�I�C�h���i�����q�l��I�L�V�R�h������t�F���^�j���ցj�ύX����B
1B�i���������C�Ⴂ�G�r�f���X���x���j
���֔�̒�`
�֔�Ƃ́u���Ǔ��e���̒ʉ߂��x���E����C�r�ւɍ������ԁv���w���B�r�ւ̏K���͌l�����傫�����߁C���Ƃ��Ƃ̔r�֏K���Ɣ�r���C�r�։̒ቺ�C�ւ̗ʂ̌�����d���C�c�֊��C�r�ւ̍���Ȃǂ��画�f����B
►�Տ��^��29
�I�s�I�C�h�����^����C�֔邪�����������҂ɑ��āC�s���ׂ��]���͉����H
����
�֔�����鑼�̗v�����ӕʂ��C���Â���������B�܂��C�r�ւ̏悵�C������f�@���C���ǂƏh�ւ̗L���ɂ��ĕ]������B
���
�I�s�I�C�h�����^����Ă��銳�҂ɕ֔邪���������ꍇ�C�܂��r�֏�֔�̌�����]������B
�r�֏̕]���Ƃ��āC�ŋ߂ƌ��݂̕ւ̉C�ʁC�d���C�r�֎��̕s�����i�r�֍���C�ɂ݁C�c�֊��j�悷��B���ɁC���ǂƏh�ւ̗L����]������B
�����̐f�@�ł́C��従��C���Ǔ��̃K�X�����̗L���C�։�̗L���C���ɂ��m�F����B���ǂ��^����ꍇ�́C�����P��X ���B�e���s���C���ǂ��f�f�����Β��ǂɑ��鎡�ÂƏ��u���s���B
�h�ւ����݂���ꍇ�ɂ́C�r�ւ��݂��Ă��Ă��h�ւ̎��͂≺�����Nj���ʂ��ĉ����ւ��o��u�여���֔�v��悷�邱�Ƃ�����B�h�ւ��������Ĉ�������Ə�������ᇌ`���ɂ��o������E�̌����ƂȂ�̂Œ��ӂ��K�v�ł���B�h�ւ��^����ꍇ�i�r�֎��̕s����������C�여���֔��F�߂�C���܂𓊗^���Ă�3 ���Ԉȏ�r�ւ�F�߂Ȃ��Ȃǁj�́C�����f�Œ������֒̕������m�F���C�h�ւ��݂���ꍇ�͌o�����I���u�i���ܓ��^�C�����C�E�ւȂǁj���s���B
�֔�����������錴���Ƃ��āC�E���C��ӈُ�i���J���V�E�����ǁC���A�a�C��J���E�����ǁC�A�ŏǁC�b��B�@�\�ቺ�ǂȂǁj�C�i�R�R������C���A��C�R��������C�R����C���_��C�S�܁C�~����C�Z���g�j���h�R��Ȃǁj�̗L�����m�F����B�\�ł���Ό����̎��ÂƂ��āC�E���̕�C��ӈُ�̎��ÁC�֔������������̕ύX�⒆�~���s���B�\���Ȓ��Ɍ��ʂ������Ă���ꍇ�C�I�s�I�C�h�̌��ʂ���������B
�܂��C�����K���ɂ��Ē��悵�C�����̏\���Ȑێ��H���@�ۂ̑����H���ێ�C�y���^����U���𑣂��B�܂��C�����̃}�b�T�[�W��ۉ������߁C�r�֏K�����ۂ����悤�ɂ��C����I�ɔr�֏�]������B
�����̃K�C�h���C���Ƃ̐�����
NCCN �̃K�C�h���C���i2012�j�ł́C�֔�����ꍇ�C�֔�������N�����I�s�I�C�h�ȊO�̌��������Â��邱�ƁC�I�s�I�C�h�����ʂ��邽�߂ɔ�I�s�I�C�h���ɖ���g�p���邱�Ƃ𐄏����Ă���B�܂��C�֔邪���������ꍇ�Ɍ������ĕ]�����邱�ƂƁC�h�ւ̊m�F�𐄏����Ă���B�֔�̗\�h�Ƃ��Đ����ێ�̑��ʁC�H���@�ېێ�C�^���𐄏����Ă���B
►�Տ��^��30
�I�s�I�C�h�����^����C�֔邪�����������҂ɑ��āC���܂́C�v���Z�{�ɔ�r���ĕ֔�����P���邩�H
����
�I�s�I�C�h�����^����C�֔邪�����������҂ɑ��āC���܂́C�֔�����P����B
�I�s�I�C�h�����^����C�֔邪�����������҂ɑ��āC���܂𓊗^����B
���܂́C�ւ̐���ɂ��킹�āC��ɕւ��d���ꍇ�͐Z���������܂��C��ɒ�従����ቺ���Ă���ꍇ�͑咰�h�������܂��g�p����B���ʂ��s�\���ł���Η��҂p����B
���
�{�Տ��^��Ɋ֘A�����Տ������Ƃ��ẮC2 ���̌n���I���r���[�ƕ�I���r���[�Ɋ�Â��K�C�h���C���C����і������r����1 ���C�O���r����1 ��������B
Larkin ��1�j�ɂ�郌�r���[�ł́C�ɘa�P�A���Ă��銳�҂ɂ�����֔�ɑ��ĐZ���������܂݂̂ł͕s�\���ȉ\��������C�Z���������܂Ƒ咰�h�������܂p���邱�Ƃ���Ƃ̈ӌ���萄�����Ă���B�������CMcNicol ��2�j�ɂ��n���I���r���[�ł́C�I�s�I�C�h�̕���p��Ƃ��āC��������Ă���Z���������܂Ƒ咰�h�������܂̕��p�͈�ʓI�ɃG�r�f���X���s�\���ł���o���Ɋ�Â��Ă���ƌ��_�Â��Ă���B����ɁCMiles ��3�j�ɂ��n���I���r���[�ł́C�ɘa�P�A���Ă��銳�҂֔̕鎡�Âɑ��鉺�܁C�܂��͂��鉺�܂̑g�ݍ��킹�ɂ�鎡�Â��C���̎��Â��D��Ă��邩�������G�r�f���X�͂Ȃ��ƌ��_���Ă���
Agra ��4�j�ɂ�閳�����r�����ł́C�č��̊ɘa�P�A�a���ɓ��@���I�s�I�C�h�̓��^�����I��������91 ���ΏۂƂ��C�Z���i�ƃ��N�c���[�X�Ƃ̌��ʂ��r�����Ƃ���C�I�s�I�C�h�J�n�Ɠ����ɃZ���i���邢�̓��N�c���[�X���^���J�n���C�ώ@���Ԃɂ�����72 ���Ԉȏ�r�ւ�F�߂Ȃ��i0.9 vs 0.9�Cp��0.85�j�C�r�ւ̂����������i0.9 vs 1.0�Cp��0.72�j�͗��҂ō��ق�F�߂Ȃ������B����p�́C�Z���i���^��7.0���C���N�c���[�X���^��6.3���ʼn����C�q�f�Ȃǂ�F�߂�����������e�Ղɉ��P�����B���ʂƕ���p�Ƃ������̂��߁C��p�̓_����Z���i�𗘗p���邱�Ƃ��]�܂����ƌ��_�����B
�܂��CTwycross ��5�j�ɂ��O���r�����ł́C������ᇂ̊��҂�60 mg/���ȏ�̗��_�����q�l�𓊗^����Ă���C���Â�v����֔����23 ���ΏۂɁC�s�R�X���t�@�[�g�i�g���E�������҂̏�Ԃɉ�����5�C10�C15 mg ��1 ��1 �^�ŊJ�n���C2.5�`5 mg/���ő����������60 mg/���Ƃ��ē��^�ʂ������Ƃ���C75����14 ���Ԃ̊ώ@���Ԓ��ɕ��ʕւ��݂�ꂽ�B�����C���܁C�E�ւ��K�v�łȂ�����p��F�߂Ȃ������̂������^�ʂ̒����l��15 mg �ł������B���^��ŏ��̔r�ւ܂ł̕��ς�12 ���Ԃł��̎��_�ł̓��^�ʂ̒����l��15 mg �ł������B5���ɉ�����F�߂��B
����
�ȏ���C�Z���������܂ł��郉�N�c���[�X�C�咰�h�������܂ł���Z���i�C�s�R�X���t�@�[�g�i�g���E���͂�������I�s�I�C�h�ɂ��֔�ɗL���ł���ƍl������B����ȊO�̈�ʓI�ȉ��܂Ƃ��āC�Z���������܂ł́C���މ��܂ł���_���}�O�l�V�E���C���_���}�O�l�V�E���C�N�G���_�}�O�l�V�E��������C�咰�h�������܂ł́C�Z���m�V�h�C�剩��������B��������G�r�f���X�͌����Ă��邪�C�����̌��ʂ����҂ł���ƍl�����邽�߁C�I�s�I�C�h�����^����֔邪�����������҂ɑ��āC���܂̓��^�́C�֔�����P����ƍl������B
���������āC�{�K�C�h���C���ł́C�I�s�I�C�h�����^����֔邪�����������҂ɑ��āC���܂𓊗^���邱�Ƃ𐄏�����B���܂̑I���ɂ��ď\���ȍ����͂Ȃ����C���Ƃ̍��ӂƂ��āC�ւ��d���ꍇ�́C�܂��ւ��炩�������p�����Z���������܂��g�p���C����C��従����ቺ���Ă���ꍇ�́C�܂����lj^���𑣐i�����p�����咰�h�������܂��g�p���邱�Ƃ𐄏�����B��������\���Ȍ��ʂ�����܂ő��ʂ��C���ʂ��s�\���ȏꍇ�͍�p�@���̈قȂ闼�҂p����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�������֔̕�ɑ��Ăǂ̉��܂����D��Ă��邩�������Տ������͂Ȃ��Ƃ��������ŁC�P�Ƃ̉��܂����C��p�@���̈قȂ鉺�܂ƕ��p�����ق����C����֔̕�ɑ��ėL���������������Ƃ��Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�Z���������܁idocusate�j�Ƒ咰�h�������܁i�Z���i�j�p���C�I�s�I�C�h�ʂ��鎞�ɂ͉��܂����ʂ��C�֔邪���������ꍇ�ɑ��̉��܁i�}�O�l�V�E�����܁C�r�T�R�W���C���N�c���[�X�C�\���r�g�[���C���܁j��g�N���v���~�h�̒lj����^�𐄏����Ă���B
►�Տ��^��31
�I�s�I�C�h�����^����C�֔邪�����������҂ɑ��āC�I�s�I�C�h�̕ύX�i�I�s�I�C�h�X�C�b�`���O�j�́C�ύX���Ȃ����Ƃɔ�r���ĕ֔�����P���邩�H
����
�I�s�I�C�h�����^����C�֔邪�����������҂ɑ��āC�I�s�I�C�h�̕ύX�́C�֔�����P����B
�I�s�I�C�h�����^����C�֔邪�����������҂ɑ��āC���܂̓��^��o�����I���u�ŕ֔邪���P���Ȃ��ꍇ�́C�I�s�I�C�h���i�����q�l��I�L�V�R�h������t�F���^�j���ցj�ύX����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�������r�����͂Ȃ��C�I�[�v������1 �����܂ރR�N�����f�[�^�x�[�X�ƁC�O���r����1 ���ƃI�[�v������1 �����܂ތn���I���r���[������iQuigley6�j�CMercadante ��7�j�j�B
Donner ��8�j�ɂ��O���r�����ł́C�u�Ɏ��ÂɃI�s�I�C�h���K�v�Ȃ���98 ���ΏۂƂ��C�����q�l���������܂���t�F���^�j���\�t�܂ւ̕ύX���s�����Ƃ���C�֔�̕p�x��59������35���������C���܂̎g�p�p�x��62������38�����������B�֔�ȊO�̕���p�͈Ⴂ��F�߂Ȃ������B3 ��ň����C���C�C�����C���ɂ������q�l�̗��E�nj�����F�߂���3 ���ȓ��ɉ��P�����B
Mystakidou ��9�j�ɂ��P��{�ݑO�����ώ@�����ł́C�ɂ݂ɑ��I�s�I�C�h���^���K�v�Ȃ���321 ���ΏۂƂ��C�o�������q�l���J�n���t�F���^�j���\�t�܂ɕύX�����Ƃ���C�֔�̕p�x���o�������q�l���^����17���C�t�F���^�j���\�t�܂֕ύX7 �����8.1���ł������B
Radbruch ��10�j�ɂ��O���r�����ł́C�ɂ݂ɑ������q�l���������܂̓��^���Ă��邪��46 ���ΏۂƂ��C�t�F���^�j���\�t�܂ւ̕ύX���s�����Ƃ���C�֔�̕p�x�͗L�Ӎ���F�߂Ȃ������B�������ώ@�����Ƃ̉��܁i���N�c���[�X�C�s�R�X���t�@�[�g�i�g���E���C�r�T�R�W���Ȃǁj���g�p���Ă��銳�҂̓����q�l���^����78�`87������C�t�F���^�j���֕ύX���22�`48���֒ቺ�����B�t�F���^�j���ύX��12 ���C17 ���ł͕ύX�O�ɔ�ׂėL�Ӎ���F�߂��ip��0.001�j�B
����
�ȏ���C�����q�l����t�F���^�j���\�t�܂֕ύX���邱�Ƃ͕֔�̉��P�ɗL���ł���ƍl������B����C�I�L�V�R�h������t�F���^�j���\�t�܂ւ̕ύX���֔�̉��P�ɗL���ł��邱�Ƃ������G�r�f���X�͂Ȃ��B�������C�I�L�V�R�h���̓����q�l�Ɠ����x�֔̕����ƍl�����Ă��邱�Ƃ���C�I�L�V�R�h������t�F���^�j���\�t�܂֕ύX���邱�Ƃ��֔�̉��P�ɗL���ł���ƍl������B���Ȃ킿�C�I�s�I�C�h�̓��^���֔�������҂ɑ��āC�I�s�I�C�h�̕ύX�́C�֔�����P����ƍl������B
���������āC�{�K�C�h���C���ł́C�I�s�I�C�h�̓��^���֔�������҂ɑ��āC���܂̓��^��o�����I���u�ŕ֔邪���P���Ȃ��ꍇ�́C�I�s�I�C�h���i�����q�l��I�L�V�R�h������t�F���^�j���ցj�ύX���邱�Ƃ𐄏�����B
���F���E�nj�/���E�nj�Q
�Տ��ł͖̓ˑR�̋x��ɂ��g�̏Ǐ�𗣒E�nj�Q�iwithdrawal syndrome�j�ƕ\�����邱�Ƃ���ʓI�ł���B�ޖ�Ǐ�C�ޖ�Ƃ������邪�C�{�K�C�h���C���ɂ����ẮC�K�C�h���C�����g�p�����Ï]���҂̍���������邽�߁C�{����ʂ��ė��E�nj�/���E�nj�Q�ɓ��ꂵ�Ďg�p����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̕���p�����ƂȂ�ꍇ�ɂ́C�I�s�I�C�h��ύX���邱�Ƃ𐄏����Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̌��ʂ��������C�֔�ɑ��鎡�Â��s���Ă����P���Ȃ��ꍇ�C�I�s�I�C�h�̕ύX���l������Ƃ��Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̌��ʁC���ܓ��^�C�I�s�I�C�h�̕ύX���L�p�ł���Ƃ��Ă���B
�i���䌘��C�r�i���V�j
�y�� ���z
�Տ��^��30
1�j Larkin PJ, Sykes NP, Centeno C, et al. The management of constipation in palliative care�Fclinical practice recommendations. Palliat Med 2008�G22�F796-807
2�j McNicol E, Horowicz-Mehler N, Fisk RA, et al. Management of opioid side effects in cancer- related and chronic noncancer pain�Fa systematic review. J Pain 2003�G4�F231-56
3�j Miles CL, Fellowes D, Goodman ML, et al. Laxatives for the management of constipation in palliative care patients. Cochrane Database Syst Rev 2006�i4�j�FCD003448
4�j Agra Y, Sacristàn A, Gonzàlez M, et al. Efficacy of senna versus lactulose in terminal cancer patients treated with opioids. J Pain Symptom Manage. 1998�G15�F1-7
5�j Twycross RG, McNamara P, Schuijt C, et al. Sodium picosulfate in opioid-induced constipation�F results of an open-label, prospective, dose-ranging study. Palliat Med 2006�G20�F419-23
�Տ��^��31
6�j Quigley C. Opioid switching to improve pain relief and drug tolerability. Cochrane Database Syst Rev 2004�i3�j�FCD004847
7�j Mercadante S, Bruera E. Opioid switching�Fa systematic and critical review. Cancer Treat Rev 2006�G32�F304-15
8�j Donner B, Zenz M, Tryba M, et al. Direct conversion from oral morphine to transdermal fentanyl�F a multicenter study in patients with cancer pain. Pain 1996�G64�F527-34
9�j Mystakidou K, Tsilika E, Parpa E et al. Long-term cancer pain management in morphine pre- treated and opioid naive patients with transdermal fentanyl. Int J Cancer 2003�G107�F486-92
10�j Radbruch L, Sabatowski R, Loick G, et al. Constipation and the use of laxatives�Fa comparison between transdermal fentanyl and oral morphine. Palliat Med 2000�G14�F111-9
3
�� �C
�� �I�s�I�C�h�����^���ꂽ���҂ɂ����āC���C�������������ɗL���Ȏ��Â͉����H
�֘A����Տ��^��
- ►32�I�s�I�C�h�����^����C���C�������������҂ɑ��āC�s���ׂ��]���͉����H
- ►33�I�s�I�C�h�����^����C���C�������������҂ɑ��āC���_�h����C�R�����G�X�e���[�[�j�Q��C�J�t�F�C���́C�v���Z�{�ɔ�r���Ė��C�����P���邩�H
- ►34�I�s�I�C�h�����^����C���C�������������҂ɑ��āC�I�s�I�C�h�̕ύX�i�I�s�I�C�h�X�C�b�`���O�j�́C�ύX���Ȃ����Ƃɔ�r���Ė��C�����P���邩�H
- ►35�I�s�I�C�h�����^����C���C�������������҂ɑ��āC�I�s�I�C�h�̓��^�o�H�̕ύX�́C�ύX���Ȃ����Ƃɔ�r���Ė��C�����P���邩�H
����
- ►32���C�̋��x�Ƌ�ɂ̒��x��]������B
���C�����鑼�̗v�����ӕʂ��C���Â���������B
�I�s�I�C�h�̓��^�ʂ������Ȃ�����]������B - ►33�I�s�I�C�h�����^����C���C�������������҂ɑ��āC���Ƃɑ��k���������ŁC���_�h�����lj�����
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j - ►34�I�s�I�C�h�����^����C���C�������������҂ɑ��āC�I�s�I�C�h��ύX����B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►35�I�s�I�C�h�����^����C���C�������������҂ɑ��āC�I�s�I�C�h�̌o�����^�������Ò��E�����牺���ɕύX����B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j
►�Տ��^��32
�I�s�I�C�h�����^����C���C�������������҂ɑ��āC�s���ׂ��]���͉����H
����
���C�̋��x�Ƌ�ɂ̒��x��]������B
���C�����鑼�̗v�����ӕʂ��C���Â���������B
�I�s�I�C�h�̓��^�ʂ������Ȃ�����]������B
���
�I�I�s�I�C�h�����^���ꂽ���҂ɖ��C�����������ꍇ�ɂ́C���C���I�s�I�C�h�̉ߗʓ��^�̒���̉\��������̂ŁC���^�ʂ��K�ł��邩���܂��m�F����B
���ɁC���C���鑼�̗v�����ӕʂ��C���Â���������B���҂̖��C�̌����Ƃ��ăI�s�I�C�h�ȊO�ɁC�i�����_��C������p�̂��鐧�f��Ȃǁj�C�����_�o�n�̕a�ρC�d�����ُ�i���J���V�E�����ǁC��i�g���E�����ǂȂǁj�C�����厾���C�����l�ُ�C�t�@�\��Q�C�̋@�\��Q�C���A�����j�A���ǁC�E���C�����ǁC��_�f���ǂȂǂ�����B�����̌����ɂ́C���É\�Ȃ��̂����邽�߁C�I�s�I�C�h�ɂ�閰�C�Ɣ��f����O�Ɏ��É\�Ȍ�����]�����C���Â���������B�Ⴆ�C�ł́C�����ɓ��^����Ă��閰�C�̌����ƂȂ�𒆎~�E���ʁC�܂��́C��Ԃ̓��^�Ƃ���B
��̓I�ɂ́C���^���m�F���C���C�̈����Ƃ̎��ԊW���m�F����B�܂��C�_�o�w�I�����Ȃǐg�̏������Ƃ�C���t�����i��J���V�E���l���܂ށj�C�����摜�������������邱�Ƃɂ��C��v�Ȗ��C�̌������ӕʂ��邱�Ƃ��ł���B���̂����ŁC���C�ɑ�����������҂ɂ���ĈقȂ邽�߁C���C�����҂ɂƂ��ċ�ɂƂȂ��Ă��Ȃ��������Ҏ��g�ɕ]�����Ă��炢�C���C�����ÑΏۂƂ��邩�f����B
�I�s�I�C�h�������ƍl������ꍇ�́C���^��ʌ�ł͐����Ԃőϐ����ł��邱�Ƃ��������߉\�ł���Όo�߂��ώ@����B���Ɍ��ʂ��\���ł���I�s�I�C�h�̌��ʂ���������B���Ɍ��ʂ��s�\���ł���C��I�s�I�C�h���ɖ�E�_�o�u���b�N�E���ː����ÂȂǑ��̒��Ɏ�i�������ăI�s�I�C�h�����ʂł��邩����������B�����q�l�����^����Ă���ꍇ�C�t�@�\��Q��������ƃ����q�l�̓��^�ʂ͓���ł������q�l�̑�ӎY�����~�ς��邱�Ƃɂ�薰�C�����邱�Ƃ�����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̓��^�ʂ����ʂ��邱�Ƃ𐄏����Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�J�n�܂��͑��ʌ�2�`3 ���ȏ�o�߂��Ă����C�����P���Ȃ��ꍇ�C�I�s�I�C�h�ȊO�̌�����]�����邱�Ƃ𐄏����Ă���B�܂��C��菭�Ȃ����^�ʂ��u�Ɋɘa���ێ��ł���Ȃ�I�s�I�C�h���^�ʂ����ʂ���C�I�s�I�C�h�̓��^�ʂ����炷���߂ɔ�I�s�I�C�h���ɖ�Ȃǂ̓��^���l������C�ō������Z�x�����炷�ړI�ŃI�s�I�C�h����菭�ʂ̓��^�ʂŕp��ɓ��^���邱�Ƃ𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̌��ʂ��s�����Ƃŕ���p�����P����\��������C�I�s�I�C�h�����ʂ��邽�߂̎�i�Ƃ��Ē��ɕ⏕��̎g�p�C�_�o�u���b�N����ː����ÂȂǂ̕��@�������Ă���B
►�Տ��^��33
�I�s�I�C�h�����^����C���C�������������҂ɑ��āC���_�h����C�R�����G�X�e���[�[�j�Q��C�J�t�F�C���́C�v���Z�{�ɔ�r���Ė��C�����P���邩�H
����
�I�s�I�C�h�����^����C���C�������������҂ɑ��āC���_�h����͖��C�����P���邪�C�R�����G�X�e���[�[�j�Q��C�J�t�F�C���ɂ��Ė��C�����P���鍪���͂Ȃ��B
�I�s�I�C�h�����^����C���C�������������҂ɑ��āC���Ƃɑ��k���������ŁC���_�h�����lj�����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�n���I���r���[��1 ���C�������r����3 ���C�O���r����1 ��������B
1 �j���_�h����
�����̖������r�����ƑO���r�����ŁC�I�s�I�C�h�ɂ�閰�C�ɑ��鐸�_�h����̌��ʂ�������Ă���B
McNicol ��1�j�̌n���I���r���[�ł́C�I�s�I�C�h�����^���ꖰ�C�������������҂ɑ��āC���_�h���L���ł���Ƃ��Ă���B
Wilwerding ��2�j�ɂ�閳����N���X�I�[�o�[��r�����ł́C�ɂ݂ɑ��ăI�s�I�C�h��K�v�Ƃ��邪��43 ��i�K���������C����ɂƂ��Ă���킯�ł͂Ȃ��j��ΏۂƂ��C���`���t�F�j�f�[�g15 mg/���ƃv���Z�{�̑S�ʓI�ȏǏ�ւ̌��ʂ��r�����Ƃ���C���Ɍ��ʂȂǂɍ��݂͂��Ȃ��������C���C��L�ӂɉ��P�����i��Βl�̋L�ڂȂ��Cp��0.01�j�B����p�Ƃ��āC���`���t�F�j�f�[�g�Ɋ֘A�������͔̂F�߂Ȃ������B
Bruera ��i1987�j3�j�ɂ�閳����N���X�I�[�o�[��r�����ł́C�ɂ݂ɑ��ăI�s�I�C�h��K�v�Ƃ��邪��32 ���ΏۂƂ��C���`���t�F�j�f�[�g15 mg/���ƃv���Z�{�̒��Ɍ��ʂƖ��C�ւ̌��ʂ��r�����Ƃ���C�����x�̒��Ɍ��ʂƂƂ��ɁC���C��VAS�i0 ���ň��C100 ���ŗǁj��L�ӂɉ��P�����i36��58 vs 36��45�Cp��0.01�j�B���`���t�F�j�f�[�g�Ɋ֘A�����d�x�̕���p�͔F�߂Ȃ������B
Bruera ��i1992a�j4�j�ɂ�閳����N���X�I�[�o�[��r�����ł́C�ɂ݂ɑ��ăI�s�I�C�h�̎����牺�����s���Ă��邪��20 ���ΏۂƂ��C���`���t�F�j�f�[�g10 mg/���ƃv���Z�{�̔F�m�@�\�ւ̌��ʂ��r�����Ƃ���C���C�̃x�[�X���C���Ɣ�r�����������L�ӂɉ��P�����i100��65 vs 100��92�Cp��0.001�j�B���`���t�F�j�f�[�g�Ɋ֘A�����d�x�̕���p�͔F�߂Ȃ������B
���̑��ɁCBruera ��i1992b�j5�j�ɂ��O���r�����ł́C���`���t�F�j�f�[�g�ɂ��C�I�s�I�C�h�̓��^���Ă��邪�҂̖��C�����P���邱�Ƃ���������Ă���B
2 �j�R�����G�X�e���[�[�j�Q��i�h�l�y�W���j
�I�s�I�C�h�̖��C�Ƀh�l�y�W���������x�L���ł��������C����p�����p�x�ɂ݂�ꂽ���Ƃ�1 ���̑O���r�����Ŏ�������Ă���B
Bruera ��i2003�j6�j�ɂ��O���r�����ł́C�ɂ݂ɑ��ăI�s�I�C�h���g�p���ꖰ�C��i���Ă��邪��27 ���ΏۂƂ��C�h�l�y�W��5 mg/����7 ���ԓ��^�����Ƃ���C7 ����̖��CNRS �����P�����i6.4��4.8�Cp��0.035�j�B����p�Ƃ��ẮC20 �ᒆ���S��6 ��C�q�f��5 ��C������5 ��C��������3 ��C�H�~�s�U��3 ��C���ɂ�1 ��ŔF�߁C���~��ɏ��������B
3 �j�J�t�F�C��
�I�s�I�C�h�̖��C�ɑ���J�t�F�C���̌��ʂɂ��ẮC1 ���̖������r����������B
Mercadante ��7�j�ɂ�閳����N���X�I�[�o�[��r�����ł́C�ɂ݂ɑ��Ĉ��ʂ̃����q�l���g�p���Ă��邪��12 ���ΏۂƂ��C�����q�l���^��̃J�t�F�C��200 mg �ƃv���Z�{�̌��ʂ��r�����Ƃ���C���C�ɂ��Ă�NRS �͗L�ӂȕω��݂͂��Ȃ������i28��28 vs 22��24�Cp �l�̋L�ڂȂ��j�B����C�F�m�@�\�����ɗp������tapping speed test �ɂ͗L�ӂȉ��P���F�߂�ꂽ�i120��129 vs 133��123�Cp��0.041�j�B�J�t�F�C���ɂ�镛��p�݂͂��Ȃ������B
����
�ȏ���C�I�s�I�C�h�����^����C���C�������������҂ɑ��āC���_�h����́C���C�����P���鑊���̍���������ƍl�����邪�C�R�����G�X�e���[�[�j�Q��C�J�t�F�C���ɂ��Ė��C�����P����Ƃ���\���ȍ����͂Ȃ��B
�{�M�ł́C���_�h����ł��郁�`���t�F�j�f�[�g�ƃ��_�t�B�j���̓i���R���v�V�[�ƒ��ӌ���/��������Q�ȊO�ɂ͎g�p���������K������Ă���B������Ƃ��ăy������������B�y�������́C�����_�o�n�̃h�p�~���쓮���j���[�����̐_�o�I���ł̃h�p�~����荞�ݑj�Q�ɂ����ʂ����邽�߁C�I�s�I�C�h�ɂ�閰�C�����P����\�������邪�C�����ƂȂ�G�r�f���X���قƂ�Ǒ��݂��Ă��Ȃ��i�{�V��j�B���������āC�{�K�C�h���C���ł́C���Ƃɑ��k���������Ŏg�p���������邱�Ƃ𐄏�����B
����C�R�����G�X�e���[�[�j�Q���J�t�F�C���́C�\���ȃG�r�f���X���Ȃ����߁C�������Ȃ��B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C���`���t�F�j�f�[�g�̎g�p�𐄏����Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�J�n�܂��͑��ʌ�2�`3 ���ȏ�o�߂��Ă����C�����P���Ȃ��ꍇ�C�J�t�F�C���C���`���t�F�j�f�[�g�C���_�t�B�j���Ȃǂ𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C���_�h����̎g�p�𐄏����Ă���B
►�Տ��^��34
�I�s�I�C�h�����^����C���C�������������҂ɑ��āC�I�s�I�C�h�̕ύX�i�I�s�I�C�h�X�C�b�`���O�j�́C�ύX���Ȃ����Ƃɔ�r���Ė��C�����P���邩�H
����
�I�s�I�C�h�����^����C���C�������������҂ɑ��āC�I�s�I�C�h�̕ύX�i�I�s�I�C�h�X�C�b�`���O�j�́C���C�����P����B
�I�s�I�C�h�����^����C���C�������������҂ɑ��āC�I�s�I�C�h��ύX����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�n���I���r���[��2 ������B�������r�����͂Ȃ��C�O���r������3 ������B
Quigey ��8�j�ɂ��n���I���r���[�ł́C�ɂ݂�i���銳�҂ɑ���I�s�I�C�h�̕ύX�̗L�����ɂ���52 ���̕����Ɋւ��ă��r���[���Ă���B�O���r����14 ���C����������15 ���C�Ǘ��23 ���������������ʁC1 �̕������C�I�s�I�C�h��ύX���邱�Ƃ��u�Ɋɘa�ƃI�s�I�C�h�ɂ�镛��p���y�����邽�߂ɗL���Ȏ�i�ł���ƌ��_�Â��Ă���B
�܂��CMercadante ��9�j�ɂ��n���I���r���[�ł́C�O���r����13 ���C����������10 ���Ȃǂ��܂�31 ���̕������������C1 ��ނ̃I�s�I�C�h���u�Ɋɘa���s�\���Ȋ��҂ɑ��ăI�s�I�C�h�̕ύX���s�����Ƃ�50���ȏ�̊��҂ɂ����ėՏ��I�ȉ��P���F�߂���ƌ��_�Â����B
�Ⴆ��Narabayashi ��10�j�ɂ��O���r�����ł́C���Ɍ��ʂ��s�\���ł�������ς�����������p�̂��߂Ɍo�������q�l�̌p��������Ȃ���25 ���ΏۂƂ��C�o���I�L�V�R�h���ւ̕ύX���s�����Ƃ���C�ύX�O�ɑς����������C��i���Ă���7 ��S��őς����������C�͏��������i0�`3 ��4 �i�K�̕]���ŁC2.1��0.9�Cp��0.031�j�B
McNamara11�j�ɂ��O���r�����ł́C�ɂ݂ɑ��ă����q�l�����^����Ă���C�����q�l�ɂ�閰�C�₹��ςȂǂ̐��_�Ǐ�̂��邪��19 ���ΏۂƂ��C�����q�l����t�F���^�j���\�t�܂ɕύX���s�����Ƃ���C4 ���ڂ���Ȃ閰�C�ړx�i0�`12 �_�C9.4��7.3�Cp��0.0012�j�C���C�ɂ��킸��킵����VAS�i68��49�Cp��0.017�j�����P�����B�ώ@���Ԓ��ɁC19 �ᒆ17 ��̊��҂�36 ���̗L�Q���ۂ��݂�ꂽ�B���̂����C���ÂɊ֘A������̂́C�d�ĂȂ��̂Ƃ��Čċz�}����1 ������C���̑��C���ӊ��C�����C���S�C�q�f�C�֔�C�����C�~�I�N���[�k�X�C�����q�l�̗��E�nj��12 ���F�߂�����ߐ��ł�������B
Ashby ��12�j�ɂ��O���r�����ł́C�I�s�I�C�h�������ƍl�����镛��p�̂��銳��49 ���ΏۂƂ��C�����q�l����t�F���^�j���֕ύX�����Ƃ���C���C��L����10 �ᒆ4 ��ŗՏ��I�ȉ��P���݂��C����2 ��ŏ��������B�����q�l����I�L�V�R�h���ւ̕ύX�ł́C���C�̂���2 �ᒆ2 ��ŗՏ��I�ȉ��P���݂�ꂽ�B����p�Ɋւ���L�ڂ͓��ɂȂ������B
����
�ȏ���C�I�s�I�C�h�����^���ꖰ�C�������������҂ɑ��āC�I�s�I�C�h�̕ύX�́C���C�����P���鑊���̍���������ƍl������B����������̍����G�r�f���X�ł͂Ȃ����C�����q�l����I�L�V�R�h���܂��̓t�F���^�j���ɁC�I�L�V�R�h������t�F���^�j���ɕύX���邱�ƂŖ��C�̉��P���F�߂���ƍl������B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C�I�s�I�C�h�ɂ�閰�C�ɑ��āC�I�s�I�C�h�̕ύX�𐄏�����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̕ύX�𐄏����Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�J�n�܂��͑��ʌ�2�`3 ���ȏ�o�߂��Ă����C�����P���Ȃ��ꍇ�C���̑Ή��ɉ����āC�I�s�I�C�h�̕ύX���������邱�Ƃ𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̕ύX�𐄏����Ă���B
►�Տ��^��35
�I�s�I�C�h�����^����C���C�������������҂ɑ��āC�I�s�I�C�h�̓��^�o�H�̕ύX�́C�ύX���Ȃ����Ƃɔ�r���Ė��C�����P���邩�H
����
�I�s�I�C�h�����^����C���C�������������҂ɑ��āC�I�s�I�C�h�̓��^�o�H�̕ύX�́C���C�����P����\��������B
�I�s�I�C�h�����^����C���C�������������҂ɑ��āC�I�s�I�C�h�̌o�����^�������Ò��E�����牺���ɕύX����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�������r�����͂Ȃ��C�O���r������1 ������B
Enting ��13�j�ɂ��O���r�����ł́C�I�s�I�C�h�ɂ����Ɍ��ʂ��s�\����100 ��̊��҂�ΏۂƂ��C�I�s�I�C�h��Ö����E�牺���^�ɕύX�i��ȕύX�́C�o�������q�l��Ö����E�牺���^�C�t�F���^�j���\�t�܂��t�F���^�j���������q�l�̐Ö������^�j�����Ƃ���C���Ɍ��ʂ̉��P�Ƃ��킹�āC���C�̉��P�܂��͏�����60���i45 �ᒆ27 ��j�ł݂�ꂽ���C�ŏI�I�ɖ��C��38 ��ł݂�ꂽ�B�d�Ăȕ���p�͂Ȃ������B
����
�ȏ���C���̍����G�r�f���X�ł͂Ȃ����C�I�s�I�C�h�����^���ꖰ�C�������������҂ɑ��āC�I�s�I�C�h�̓��^�o�H�̕ύX�́C���C�����P����\��������ƍl������B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C�I�s�I�C�h�ɂ�閰�C�ɑ��ăI�s�I�C�h�̓��^�o�H�̕ύX�𐄏�����B���Ȃ킿�C�o�����^�������Ò��E�����牺���ɕύX����B
�������C���^���C���ɂ��C���҂��������邤���ŕs�ւƂȂ�\��������C���҂Ƃ悭���k���ē��^�o�H�̕ύX���s���K�v������B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2001b�j�ł́C�ŏ��̑Ή��i���̌����̊ӕʁC�I�s�I�C�h�̌��ʁj�Ŋɘa���Ȃ��ꍇ�ɁC���^�o�H�̕ύX�i�o������牺���^�ցj�𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C���^�o�H�̕ύX�𐄏����Ă���B
�i���{���v�C���}�����}�C�쑺�O��q�C�؉�����C�ז���I�j
�y�� ���z
�Տ��^��33
1�j McNicol E, Horowicz-Mehler N, Fisk RA, et al. Management of opioid side effects in cancer-related and chronic noncancer pain�Fa systematic review. J Pain 2003�G4�F231-56
2�j Wilwerding MB, Loprinzi CL, Mailliard JA, et al. A randomized, crossover evaluation of methylphenidate in cancer patients receiving strong narcotics. Support Care Cancer 1995�G3�F135-8
3�j Bruera E, Chadwick S, Brenneis C, et al. Methylphenidate associated with narcotics for the treatment of cancer pain. Cancer Treat Rep 1987�G71�F67-70
4�j Bruera E, Miller MJ, Macmillan K, et al. Neuropsychological effects of methylphenidate in patients receiving a continuous infusion of narcotics for cancer pain. Pain 1992a�G48�F163-6
5�j Bruera E, Fainsinger R, MacEachern T, et al. The use of methylphenidate in patients with incident cancer pain receiving regular opiates. A preliminary report. Pain 1992b�G50�F75-7
6�j Bruera E, Strasser F, Shen L, et al. The effect of donepezil on sedation and other symptoms in patients receiving opioids for cancer pain�Fa pilot study. J Pain Symptom Manage 2003�G26�F1049-54
7�j Mercadante S, Serretta R, Casuccio A. Effects of caffeine as an adjuvant to morphine in advanced cancer patients. A randomized, double-blind, placebo-controlled, crossover study. J Pain Symptom Manage 2001�G21�F369-72
�Տ��^��34
8�j Quigley C. Opioid switching to improve pain relief and drug tolerability. Cochrane Database Syst Rev 2004�i3�j�FCD004847
9�j Mercadante S, Bruera E. Opioid switching�Fa systematic and critical review. Cancer Treat Rev 2006�G32�F304-15
10�j Narabayashi M, Saijo Y, Takenoshita S, et al�GAdvisory Committee for Oxycodone Study. Opioid rotation from oral morphine to oral oxycodone in cancer patients with intolerable adverse effects�Fan open-label trial. Jpn J Clin Oncol 2008�G38�F296-304
11�j McNamara P. Opioid switching from morphine to transdermal fentanyl for toxicity reduction in palliative care. Palliat Med 2002�G16�F425-34
12�j Ashby MA, Martin P, Jackson KA. Opioid substitution to reduce adverse effects in cancer pain management. Med J Aust 1999�G170�F68-71
�Տ��^��35
13�j Enting RH, Oldenmenger WH, van der Rijt CC, et al. A prospective study evaluating the response of patients with unrelieved cancer pain to parenteral opioids. Cancer 2002�G94�F3049-56
�y�Q�l�����z
�Տ��^��33
14�j Homsi J, Walsh D, Nelson KA. Psychostimulants in supportive care. Support Care Cancer 2000�G8�F385-97
15�j �{�V�^���C�S�R�N�q�C�ԕ䗝�G�C���D�I�s�I�C�h�E���ɕ⏕��ɋN������C���҂̖��C�ɑ���y�������̗L�����ƈ��S���̌����D��14 ����{�ɘa��Êw���C2009
�S
�����
�� �I�s�I�C�h�����^���ꂽ���҂ɂ����āC��������������������ɗL���Ȏ��Â͉����H
�֘A����Տ��^��
- ►36�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�s���ׂ��]���͉����H
- ►37�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�R���_�a��́C�v���Z�{�ɔ�r���Ă���ς����P���邩�H
- ►38�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�I�s�I�C�h�̕ύX�i�I�s�I�C�h�X�C�b�`���O�j�́C�ύX���Ȃ����Ƃɔ�r���Ă���ς����P���邩�H
- ►39�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�I�s�I�C�h�̓��^�o�H�̕ύX�́C�ύX���Ȃ����Ƃɔ�r���Ă���ς����P���邩�H
����
- ►36����ς����鑼�̗v�����ӕʂ��C���Â���������B
- ►37�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�R���_�a��𓊗^����B
2B�i�ア�����C�Ⴂ�G�r�f���X���x���j - ►38�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�I�s�I�C�h��ύX����B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►39�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�I�s�I�C�h�̌o�����^�������Ò��E�����牺���ɕύX����B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j
�������
���͂�F������ӎ��̐����x���ቺ���C�L���́C��������Q�C����\�͂̏�Q�Ȃǂ̔F�m�@�\��Q���N�����ԁB�ʏ�C�����Ԃ��琔���̒Z���Ԃɔ������C�����ϓ����傫���B
►�Տ��^��36
�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�s���ׂ��]���͉����H
����
����ς����鑼�̗v�����ӕʂ��C���Â���������B
���
���҂̂���ς̌����Ƃ��āC�i�x���]�W�A�[�s���n��܁C�R���`�R�X�e���C�h�C�R����Ȃǁj�C�����_�o�n�̕a�ρC�d�����ُ�i���J���V�E�����ǁC��i�g���E�����ǂȂǁj�C���A�����j�A���ǁC�E���C�����ǁC��_�f���ǂȂǂ�����B���̂����C�C���J���V�E�����ǁC�E���ɂ�邹��ς͉t���������̂ŁC���Â��鉿�l�������B�r�^�~��B �Q���R�C�����厾���́C���҂ɂ�����p�x�͏��Ȃ��ƍl�����邪�C�������Âɂ����P����\��������B
��̓I�ɂ́C���^���m�F���C����ς̔����∫���Ƃ̎��ԊW���m�F����B�܂��C�_�o�w�I�����Ȃǐg�̏������Ƃ�C���t�����i��J���V�E���l���܂ށj�C�����摜�������������邱�Ƃɂ��C��v�Ȃ���ς̌������ӕʂ��邱�Ƃ��ł���B
�I�s�I�C�h�������ƍl������ꍇ�́C�\���Ȓ��Ɍ��ʂ������Ă���C���ɂ�������͈͂ŃI�s�I�C�h�̌��ʂ���������B���Ɍ��ʂ��s�\���ł���Δ�I�s�I�C�h���ɖ�C�_�o�u���b�N�C���ː����ÂȂǑ��̒��Ɏ�i�������ăI�s�I�C�h�����ʂł��邩����������B�����q�l�����^����Ă���ꍇ�C�t�@�\��Q��������ƃ����q�l�̓��^�ʂ͓���ł������q�l�̑�ӎY�����~�ς��邱�Ƃɂ�薰�C�����邱�Ƃ�����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̓��^�ʂ����ʂ��邱�Ƃ𐄏����Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�ȊO�̌������ӕʂ��邱�ƁC�I�s�I�C�h�̓��^�ʂ����炷���߂ɔ�I�s�I�C�h���ɖ���l�����邱�Ƃ𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̌��ʂ��s�����Ƃŕ���p�����P����\��������C�I�s�I�C�h�����ʂ��邽�߂̎�i�Ƃ��Ē��ɕ⏕��̎g�p�C�_�o�u���b�N����ː����ÂȂǂ̕��@�������Ă���B
►�Տ��^��37
�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�R���_�a��́C�v���Z�{�ɔ�r���Ă���ς����P���邩�H
����
�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�R���_�a��́C����ς����P����B
�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�R���_�a��𓊗^����B
���
�I�s�I�C�h�ɂ�邹��ςɑ���Ö@�Ɋւ��ẮCMcNicol ��ɂ��n���I���r���[���s���Ă��邪�C�������r�����͂Ȃ�1�j�B�������I�s�I�C�h�ƌ��肵�Ȃ�����ςɂ��ẮC�R���_�a�^�Ɋւ���n���I���r���[��2 ���C�x���]�W�A�[�s���n��ܓ��^�Ɋւ���n���I���r���[��1 ������B
1 �j�R���_�a��
�i1�j��^�R���_�a��
��^�R���_�a��Ƃ́C�h�p�~��D2��e�̂ɑ��č����e�a�������h�R��ł���C�n���y���h�[����N�����v���}�W���Ȃǂɑ�\�����R���_�a��̂��Ƃ��w���B
Breitbart ��2�j�ɂ�閳�����r�����ł́C����ς��o������AIDS ����30 ���ΏۂƂ��C�n���y���h�[��2.8 mg �ƃN�����v���}�W��50 mg �ƃ����[�p��3 mg �̌��ʂ��r�����Ƃ���C����ς̏d�Ǔx�̕]���w�W�ł���Delirium Rating Scale�����C�n���y���h�[���Q�C�N�����v���}�W���Q�ł͉��P�������C�����[�p���Q�ł͉��P���Ȃ������k20��12�ip��0.001�j vs 21��12�ip��0.001�j vs 18��17�ip��0.63�j�l�B�n���y���h�[���Q�ƃN�����v���}�W���Q�ɂ����Ă͕���p��F�߂Ȃ��������C�����[�p���Q�ɂ͉ߒ��Â₹��ς���������Ȃǂ̗L�Q���ۂ��݂�ꂽ�B�N�����v���}�W���Q�ł͒����I�ɂ͔F�m�@�\�������������B
Candy ��3�j�ɂ��C�I�������҂ɐ���������ςɑ���n���I���r���[�ł́C1 ���̖������r�����̌��ʂ���C����ς̎��Ö�Ƃ��ăn���y���h�[�����ł��K�ł���C�N�����v���}�W���͌y�x�̔F�m�@�\��Q�����e�ł���̂ł���Ύg�p�\�ƌ��_�����B
����
�ȏ���C�I�s�I�C�h�ɂ�邹��ςɌ��肵���m���ł͂Ȃ����C��^�R���_�a��̓I�s�I�C�h�ɂ�邹��ς����P����\��������ƍl������B
���FDelirium Rating Scale
����ς̐f�f��ړI�Ƃ��ĊJ�����ꂽ�]���ړx�B10 ���ڂ���Ȃ�C13 �_�ȏ�i�ő�32 �_�j�ł���ςƐf�f�����B
�i2�j���^�R���_�a��
���^�R���_�a��Ƃ́C1980 �N��㔼��蓱�����ꂽ�V�K�R���_�a����w���B�]���̍R���_�a��Ɣ�r���āC�h�p�~��D2��e�̈ȊO�̐_�o�`�B������e�̂ɑ��Ă��I��I�ɍ�p���C���̊O�H�Ǐ�𒆐S�Ƃ��������_�o�ɑ��镛��p�����Ȃ��B
Lonergan ��i2009a�j4�j�ɂ��C���^�R���_�a��̂���ςɑ�����ʂƕ���p���݂��n���I���r���[�ł́C�������r����3 �����������C3 mg/���ȉ��̃n���y���h�[���ƃ��X�y���h���C�I�����U�s���͌��ʂƕ���p�̓_�œ����ł���C4.5 mg/���ȏ�̃n���y���h�[���̓I�����U�s���Ɣ�r���āC���̊O�H�Ǐ����ƌ��_�����B�Ⴆ�C�n���y���h�[��1.7 mg/���ƃ��X�y���h��1.0 mg/���Ƃł́C����ς̏d�Ǔx�̕]���w�W�ł���Memorial Delirium Assessment Scale�iMDAS�j���̒ቺ�ɂ͌����ȍ��͂Ȃ��i75�� vs 42�� good response�Cp��0.11�j�C�n���y���h�[��7.1 mg/���ƃI�����U�s��4.5 mg/���Ƃł́CDelirium Rating Scale �̒ቺ���͂�����������ł���C�v���Z�{�Ɣ�r���ėL�ӂɉ��P�����i�n���y���h�[��70 vs �I�����U�s��72�� vs �v���Z�{30���Cp��0.01�j�B
����
�ȏ���C���^�R���_�a��ł��郊�X�y���h���ƃI�����U�s���́C����ςɑ��ăn���y���h�[���Ɠ����̌��ʂ����邱�Ƃ����������B�܂��C�N�G�`�A�s����y���X�s�����Ɋւ��Ă͗Տ��������Ȃ����C�w�I�ɑ��̔��^�R���_�a��Ɠ���̖�܂Ƃ��Č��ʂ����҂ł���ƍl������B���Ȃ킿�C�I�s�I�C�h�ɂ�邹��ςɌ��肵���m���ł͂Ȃ����C���^�R���_�a��̓I�s�I�C�h�ɂ�邹��ς����P����\��������ƍl������B
���FMDAS
����ς̏d�Ǔx�𑪒肷�邽�߂ɊJ�����ꂽ�]���ړx�B10 ���ڂ���Ȃ�CMDAS ���{��łł�10 �_�ȏ�i�ő�30 �_�j�ł���ςƐf�f�����B
2 �j�x���]�W�A�[�s���n���
Breitbart ��2�j�ɂ�閳�����r�����ł́C����ς��o������AIDS ����30 ���ΏۂƂ��C�n���y���h�[���C�N�����v���}�W���Ɣ�r���āC�����[�p���̒P�Ɠ��^�ł́C����ς̏Ǐ��P���Ȃ������BLonergan ��i2009b�j5�j�ɂ�邹��ςɑ���x���]�W�A�[�s���n��܂̎g�p�Ɋւ���n���I���r���[�ł́C����ςɑ���x���]�W�A�[�s���n��܂̒P�Ɠ��^�̌��ʂ��������Տ������́C�A���R�[�����E������ψȊO�̂���ςɂ͂Ȃ��ƌ��_���Ă���B���������āC�x���]�W�A�[�s���n��܂́C�P�Ɠ��^�ł���ς͉��P�����C����������\��������B
����
�ȏ���C�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�R���_�a��́C����ς����P����\��������ƍl������B
���������āC�{�K�C�h���C���ł́C�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�R���_�a��̓��^�𐄏�����B
���^�́C���҂ɑ���G�r�f���X�͂Ȃ����C�҂ɑ���G�r�f���X����C��^�R���_�a��܂��͔��^�R���_�a���I������B���^�ʂɊւ��ẮC���̊O�H�Ǐ�▰�C�ȂǕ���p��h�����߂ɁC�K�v�ŏ��ʂɂƂǂ߂�B�R���_�a��͏��ʂ���J�n���C�Ǐ�ɂ��킹�đ��ʂ���B���^���Ԃɂ��ẮC���C�𗈂���p�����邱�Ƃ���C������^���s���ꍇ�ɂ͗[�܂��͏A�Q�O�̓��^���]�܂������C�Ǐ�ɂ��킹�ĕ������^����������B1 ��ނ̍R���_�a��ɂ���Ă�����ς����P���Ȃ��ꍇ�ɂ́C���Ƃ̍��ӂ���C���̍R���_�a��֕ύX���邩�C�܂��́C�ő����E�s���Ȃǂ̏Ǐɘa����Ȃ��ꍇ�͍R���_�a��ƃx���]�W�A�[�s���n��܂p����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2001b�j�ł́C���̌����̊ӕʁC�I�s�I�C�h�̌��ʂ������������ƂɁC�R���_�a��i��̓I�ɂ̓n���y���h�[���C�ő������������ɂ̓x���]�W�A�[�s���n��܂̕��p�j�̎g�p�𐄏����Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�n���y���h�[���C�I�����U�s���܂��̓��X�y���h���̓��^���������邱�Ƃ𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�R���_�a��̓��^�𐄏����Ă���B
���{�����a�@���_��w��쐬�����u����ς̎��Îw�j�i2005 �N�j�v�ł́C�Ö@�Ƃ��ăn���y���h�[���̎g�p����������Ă���B
►�Տ��^��38
�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�I�s�I�C�h�̕ύX�i�I�s�I�C�h�X�C�b�`���O�j�́C�ύX���Ȃ����Ƃɔ�r���Ă���ς����P���邩�H
����
�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�I�s�I�C�h�̕ύX�i�I�s�I�C�h�X�C�b�`���O�j�́C����ς����P����B
�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�I�s�I�C�h��ύX����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�n���I���r���[��2 ������B�������r�����͂Ȃ��C�O���r������5 ������B
Quigey ��6�j�ɂ��n���I���r���[�ł́C�ɂ݂�i���銳�҂ɑ���I�s�I�C�h�̕ύX�̗L�����ɂ��āC�O���r����14 ���C����������15 ���C�Ǘ��23 �����܂�52 ���̕����������������ʁC1 �̕������C�I�s�I�C�h��ύX���邱�Ƃ��u�Ɋɘa�ƃI�s�I�C�h�ɂ�镛��p���y�����邽�߂ɗL���Ȏ�i�ł���ƌ��_�Â��Ă���B
�܂��CMercadante ��7�j�ɂ��n���I���r���[�ł́C�I�s�I�C�h�̕ύX�Ɋւ��āC�O���r������13 ���C����������10 ���Ȃǂ��܂�31 ���̕������������C1 ��ނ̃I�s�I�C�h���u�Ɋɘa���s�\���Ȋ��҂ɑ��ăI�s�I�C�h�̕ύX���s�����Ƃ�50���ȏ�̊��҂ɂ����ėՏ��I�ȉ��P���F�߂���ƌ��_�Â����B
Morita ��8�j�ɂ��O���r�����ł́C�����q�l�ɂ�邹��ςƐf�f���ꂽ����20 ���ΏۂƂ��C�����q�l���t�F���^�j���ɕύX�����Ƃ���CMDAS ��10 �_�ȏ�ł��銳�҂͎��ÑO85���ł��������C����3 �����15���C����7 �����5���Ɍ��������ip��0.001�j�B����p�͓��ɂ݂��Ȃ������B
Gagnon ��9�j�ɂ��O���r�����ł́C�I�s�I�C�h�ɂ�镛��p�̂��߂ɃI�s�I�C�h�̕ύX���s��������63 ���ΏۂƂ��C����ς̂��߂ɃI�L�V�R�h���牺���^�ɕύX����38 ��̂����C13 ��i34���j�ł���ς͗Տ��I�ɉ��P�����B���˕��ʂ̋Ǐ������ȊO�̕���p�͔F�߂Ȃ������B
Maddocks ��10�j�ɂ��O���r�����ł́C�����q�l�������ƍl�����邹��ς̂��銳��13 ���ΏۂƂ��C�I�L�V�R�h���牺���^�֕ύX�����Ƃ���C6 ����ɂ�13 �ᒆ9 ��i69���j�ł���ς����������B�ύX�ɔ�������p�݂͂��Ȃ������B
Ashby ��11�j�ɂ��O���r�����ł́C�I�s�I�C�h�������ƍl�����镛��p�̂��銳��49 ���ΏۂƂ��C�����q�l����t�F���^�j���֕ύX�����Ƃ���C����ς�15 �ᒆ12 ��ŗՏ��I�ȉ��P���݂��C2 ��͏��������B�I�L�V�R�h������t�F���^�j���ւ̕ύX�ł́C����ς�2 �ᒆ1 ��ŗՏ��I�ɉ��P�����B�����q�l����I�L�V�R�h���ւ̕ύX�ł́C4 �ᒆ3 ��ł���ς����������B����p�Ɋւ���L�ڂ͓��ɂȂ������B
���ɁCMcNamara12�j�ɂ��O���r�����ł́C�ɂ݂ɑ��ă����q�l�����^����Ă���C�����q�l�ɂ�閰�C�₹��ςȂǂ̐��_�Ǐ�̂��邪��19���ΏۂƂ��C�����q�l����t�F���^�j���\�t�܂ɕύX���s�����Ƃ���C�F�m�@�\�����ɂ�����L���̍��ڂʼn��P���F�߂��Ă���B
����
�ȏ���C�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�I�s�I�C�h�̕ύX�́C����ς����P���鑊���̍���������ƍl������B����������̍����G�r�f���X�ł͂Ȃ����C�����q�l����I�L�V�R�h���܂��̓t�F���^�j���ɁC���邢�́C�I�L�V�R�h������t�F���^�j���ɕύX���邱�Ƃł���ς̉��P��F�߂Ă���B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C�I�s�I�C�h�ɂ�邹��ςɑ��ăI�s�I�C�h�̕ύX�𐄏�����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̕ύX�𐄏����Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̕ύX���������邱�Ƃ𐄏��� �Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�̕ύX�𐄏����Ă���B
►�Տ��^��39
�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�I�s�I�C�h�̓��^�o�H�̕ύX�́C�ύX���Ȃ����Ƃɔ�r���Ă���ς����P���邩�H
����
�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�I�s�I�C�h�̓��^�o�H�̕ύX�́C����ς����P����\��������B
�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�I�s�I�C�h�̌o�����^�������Ò��E�����牺���ɕύX����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�������r�����͂Ȃ��C�O���r������1 ������B
Enting ��13�j�ɂ��O���r�����ł́C�I�s�I�C�h�ɂ���u�Ɋɘa���s�\����100 ��̊��҂�ΏۂƂ��C�I�s�I�C�h�������Ò��E�����牺���ɕύX�����Ƃ���C���Ɍ��ʂ̉��P�Ƃ��킹�āC��������ь��o�̉��P�܂��͏��������ꂼ��87���i15 �ᒆ13 ��j�C70���i10 �ᒆ7 ��j�ł݂�ꂽ�B
����
�ȏ���C���̍����G�r�f���X�ł͂Ȃ����C�I�s�I�C�h�����^����C����ς������������҂ɑ��āC�I�s�I�C�h�̓��^�o�H�̕ύX�͂���ς����P����\��������ƍl������B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C�I�s�I�C�h�ɂ�邹��ςɑ��ăI�s�I�C�h�̓��^�o�H�̕ύX�𐄏�����B
�������C����ς��������Ă��銳�҂ł́C���^���[�g�ɂ��S�����Ȃǂɂ��C����ϏǏ�������ꍇ��C�]�|��[�g�����Ȃǂ̊댯������������ꍇ�����邽�߁C���^�o�H�̕ύX�̍ۂɂ͏\���ɒ��ӂ���B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2001b�j�ł́C���̌����̊ӕʁC�I�s�I�C�h�̌��ʂ������������ƂɁC���^�o�H�̕ύX�𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C���^�o�H�̕ύX�𐄏����Ă���B
�i���{���v�C���}�����}�C�쑺�O��q�C�؉�����C�ז���I�j
�y�� ���z
�Տ��^��37
1�j McNicol E, Horowicz-Mehler N, Fisk RA, et al. Management of opioid side effects in cancer-related and chronic noncancer pain�FA systematic review. J Pain 2003�G4�F231-56
2�j Breitbart W, Marotta R, Platt MM, et al. A double-blind trial of haloperidol, chlorpromazine, and lorazepam in the treatment of delirium in hospitalized AIDS patients. Am J Psychiatry 1996�G153�F231-7
3�j Candy B, Jackson KC, Jones L, et al. Drug therapy for delirium in terminally ill adult patients. Cochrane Database Syst Rev 2012�FCD004770
4�j Lonergan E, Britton AM, Luxenberg J, Wyller T. Antipsychotics for delirium. Cochrane Database Syst Rev 2009a�FCD005594
5�j Lonergan E, Luxenberg J, Areosa Sastre A, et al. Benzodiazepines for delirium. Cochrane Database Syst Rev 2009b�FCD006379
�Տ��^��38
6�j Quigley C. Opioid switching to improve pain relief and drug tolerability. Cochrane Database Syst Rev 2004
7�j Mercadante S, Bruera E. Opioid switching�Fa systematic and critical review. Cancer Treat Rev 2006�G32�F304-15
8�j Morita T, Takigawa C, Onishi H, et al�GJapan Pain, Rehabilitation, Palliative Medicine, and PsychoOncology�iPRPP�jStudy Group. Opioid rotation from morphine to fentanyl in delirious cancer patients�Fan open-label trial. J Pain Symptom Manage 2005�G30�F96-103
9�j Gagnon B, Bielech M, Watanabe S, et al. The use of intermittent subcutaneous injections of oxycodone for opioid rotation in patients with cancer pain. Support Care Cancer 1999�G7�F265-70
10�j Maddocks I, Somogyi A, Abbott F, et al. Attenuation of morphine-induced delirium in palliative care by substitution with infusion of oxycodone. J Pain Symptom Manage 1996�G12�F182-9
11�j Ashby MA, Martin P, Jackson KA. Opioid substitution to reduce adverse effects in cancer pain management. Med J Aust 1999�G170�F68-71
12�j McNamara P. Opioid switching from morphine to transdermal fentanyl for toxicity reduction in palliative care. Palliat Med 2002�G16�F425-34
�Տ��^��39
13�j Enting RH, Oldenmenger WH, van der Rijt CC, et al. A prospective study evaluating the response of patients with unrelieved cancer pain to parenteral opioids. Cancer 2002�G94�F3049-56
�y�Q�l�����z
�Տ��^��37
14�j ����ς̎��Îw�j�C���{�����a�@���_��w��@�ҁC���a���X�C2005
�R
�����u�Ƀ}�l�W�����g�ɂ����銳�ҋ���
�� �����u�Ƀ}�l�W�����g�����Ă��銳�҂ɁC�u�Ƀ}�l�W�����g�ɂ��ċ�����s�����Ƃ͗L�����H
�֘A����Տ��^��
- ►40�����u�Ƀ}�l�W�����g�ɂ��Ċ��҂ɋ�����s�����ƂŁC�ɂ݂͊ɘa���邩�H
- ►41�����u�Ƀ}�l�W�����g�ɂ��Ă̋���́C�ǂ̂悤�ɍs���ׂ����H
����
- ►40�����u�Ƀ}�l�W�����g�ɂ��Ċ��҂ɋ�����s���B
1A�i���������C�����G�r�f���X���x���j - ►41-1�����u�Ƀ}�l�W�����g�ɂ��Ă̋���́C���̊��҂����ۂɐS�z���Ă��邱�Ƃ𖾂炩�ɂ��C���Ҍʂɉ�����������s���B
- ►41-2�����u�Ƀ}�l�W�����g�ɂ��Ă̊��ҋ���́C�p�����čs���B
- ►41-3�����u�Ƀ}�l�W�����g�ɂ��Ă̊��ҋ���̓��e�ɂ́C�ɂ݂ƃI�s�I�C�h�Ɋւ��鐳�����m���C�ɂ݂̎��Ìv��Ƌ�̓I�Ȓ��ɖ�̎g�p���@�C��Ï]���҂ւ̒ɂ݂̓`�����C��Ö@�Ɛ����̍H�v�C�Z���t�R���g���[���Ȃǂ��܂߂�B
1B�i���������C�Ⴂ�G�r�f���X���x���j
�������u�Ƀ}�l�W�����g
�K�Ō��ʓI���u�Ɋɘa���s�����߂ɁC���҂̑̌��ɏœ_�����Ă���I�]���C�ɂ݂̎��ÂƃP�A�i�Ö@�C���̑��̎��ÁC��Ö@�C�P�A�j����ьp���I�ȕ]�����܂߂����E��ōs���ߒ����w���B
►�Տ��^��40
�����u�Ƀ}�l�W�����g�ɂ��Ċ��҂ɋ�����s�����ƂŁC�ɂ݂͊ɘa���邩�H
����
�����u�Ƀ}�l�W�����g�ɂ��Ċ��҂ɋ�����s�����ƂŁC�ɂ݂͊ɘa����B
�����u�Ƀ}�l�W�����g�ɂ��Ċ��҂ɋ�����s���B
���
�{�Տ��^��Ɋ֘A�����Տ������́C�����̌n���I���r���[�Ɩ������r����������BAllard ��1�j �ɂ��n���I���r���[�ł́C�����u�ɂ̂��銳�҂�ΏۂƂ��āC���ҌX�ɉ���������ƃt�H���[�A�b�v���s���i�I�s�I�C�h�ɂ��Ă̔F����c����������C������C�I�s�I�C�h�̓������@���R�[�`���O����Ȃǁj���Ƃɂ��C�ɂ݂�I�s�I�C�h�ɂ��Ă̐������m���̏K���݂̂Ȃ炸�C�ɂ݂̉��P�ɂ����ʓI�ł��邱�Ƃ���������Ă���B�܂��CGoldberg ��2�j �ɂ����@���̂��҂ւ̊��ҋ���ɂ��Ă̌n���I���r���[�ł́C���҂ɑ��ăJ�E���Z�����O�Ȃǂ�p��������I�ȉ���́C�ɂ݂����P���C�ɂ݂�I�s�I�C�h�ɂ��Ă̐������m�����K�������ƌ��_���ꂽ�B�܂��CDevine ��3�j �̐��l���҂ւ̐S������I����ɂ��Ă̌n���I���r���[�ł́C�����N�Z�[�V�����C���ɖ�g�p�ɂ��Ă̊��ҋ���C�J�E���Z�����O�ɂ́C���҂̒ɂ݂��ɘa������ʂ����邱�Ƃ�������Ă���B
���҂�ΏۂƂ��āC�����u�Ƀ}�l�W�����g�ɂ��Ă̊��ҋ��炪�ɂ݂ɋy�ڂ����ʂ�]�������������r������9 ������i�\1�j�B���̂��ׂĂɂ����Ēɂ݂̋������y������Ă���C����v���O�����Ƃ��āC���q��X���C�h��p����������r�f�I�C�^���e�[�v�C�ɂݓ��L�C�p�������t�H���[�A�b�v�Ȃǂ��܂��܂ȕ��@���g�ݍ��킹�Ď��{����Ă����B
����
�ȏ���C�����u�Ƀ}�l�W�����g�ɂ��Ċ��҂ɋ�����s�����ƂŁC�ɂ݂͊ɘa����ƍl������B
���������āC�{�K�C�h���C���ł́C�����u�Ƀ}�l�W�����g���銳�҂ɂ́C�����u�Ƀ}�l�W�����g�ɂ��ċ�����s�����Ƃ𐄏�����B
de Wit ��̃v���O�����i1997�j4�j |
|
|---|---|
| �Ώ� | ������a�@�̊���313 ��i�I�����_�j |
| ���@ | ����Q�ł́C①�ɂ݂₪���u�Ƀ}�l�W�����g�Ɋւ�����⋳��C②�ɂݓ��L��p�����ɂ݂̋L�^���@�̐����C③�ɂ݂ɂ��Ĉ�Ï]���҂Ƃǂ̂悤�ɃR�~���j�P�[�V�������Ƃ邩�ȂǂɊւ���������s�����B������^�������e�[�v�ƁC���q��p���āC�X�̊��҂̃j�[�Y�ɂ��킹���v���O��������@���ɍs�����B ����Q�́C�v���O����������C�މ@3 ���ځC7 ���ڂɊŌ�t���d�b�ɂ��t�H���[�A�b�v���s�����B�މ@��͉���Q�C�ΏƌQ�Ƃ��ɖK��Ō�t���ւ�����Q�Ɗւ��Ȃ������Q�ɐU�蕪�����C①�K��Ō�Ȃ��̑ΏƌQ�i103 ��j�C②�K��Ō�Ȃ��̉���Q�i106 ��j�C③�K��Ō삠��̑ΏƌQ�i51 ��j�C④�K��Ō삠��̉���Q�i53 ��j��4 �Q���r�����B�f�[�^���W�́C�x�[�X���C���C�މ@2�C4�C8 �T��ɍs�����B |
| ���� | �މ@��75���̊��҂����q��S���ǂ݁C62�����e�[�v�����ׂĒ����C86�����ɂݓ��L���L�^���Ă����B�K��Ō�Ȃ��̌Q�ł̔�r�ł́C5 �ȏ�̒ɂ݂�i���銄�����ቺ�����i2�T�ԖځF16�� vs 29���Cp��0.05�G4 �T�ځF15�� vs 32���Cp��0.01�j�B�K��Ō삠��̌Q�ł̗L�Ӎ��͂Ȃ������B |
Lai ��̃v���O�����i2004�j5�j |
|
| �Ώ� | ��ᇕa���ɓ��@���Ă��銳��30 ��i��p�j |
| ���@ | 10�`15 ���̋���Z�b�V������5 ���ԁC�ɂ݂ɂ��ČP��������ᇊŌ�t��16 �y�[�W�̍��q��p���čs�����B�Ō��2 ���Ԃł́C���҂̌ʂ̋^��ɉ����āC����܂Ŋw�K���Ă������Ƃ̐U��Ԃ��C����Ɍ������b���������s�����B ���q�̓��e�́C①�ɂ݂̓��X�̐����ւ̉e���C②�ɂ݂̊ɘa���@�⏈����܁C③�I�s�I�C�h�̌���C④����p�ւ̑Ώ��C⑤�ɂ݂����������Ƃ̕��Q�C⑥��Ö@�C⑦�ɂ݂̋������ώ@���邱�Ƃ̏d�v���C⑧NRS����p���Ĉ�Ï]���҂ɒɂ݂�`������@�C⑨��Ï]���҂ɒɂ݂�i���錠���C⑩���Ҏ��g���s�����ƁC⑪����̒ɂ݂͊ɘa�ł��邱�Ƃł������B |
| ���� | ����O��̔�r�ŁC����Q�ł͑ΏƌQ�Ɣ�ו��ϓI�Ȓɂ݂̋������ቺ���Ă����i5.0��2.8 vs 4.3��3.7�Cp��0.05�j�B�܂��C�I�s�I�C�h�ւ̐��m�Ȓm���������C�u�ɂ݂̓R���g���[���ł���v�Ƃ����F���������Ă����B |
Rimer ��̃v���O�����i1987�j6�j |
|
| �Ώ� | �O���ʉ@���̂���230 ��i�č��j |
| ���@ | ����Q�̊��҂́C�P��������ᇊŌ�t�Ƃ̃Z�b�V���������B�Z�b�V�����ł́C①�Ō�t���쐬�����d�v�����L�ڃJ�[�h�i��ܖ��ƋN���肤�镛��p�Ȃǂ��L�ڂ���Ă���j�ƁC②�uNo More Pain�v�̍��q�i�ʂ̒��ɖ�̕���v���������L�ڂ���Ă���j�����Ƃ�15 ���Ԃ̃J�E���Z�����O���s�����B���q�ɂ́C���̊��҂Ɏg�p�������ɖ�̎�ނ���@���L�ڂ���C�Ō�t�͂��̍��q��g�g�݂Ƃ��ăJ�E���Z�����O���s�����B |
| ���� | ����Q�ł͑ΏƌQ�Ɣ�r���āC�����1 �J����̒ɂ݂ɂ��āu�ɂ݂��Ȃ��C���邢�́C�y���ɂ݁v�Ɖ������҂����������i44�� vs 24���Cp��0.07�j�B�܂��C����Q�̊��҂́C�ΏƌQ�̊��҂Ɣ䂵�āC���m�ȃX�P�W���[���ŁC���m�Ȗ�ܗʂ�X���ɂ������B����Q�ł͈�×p����ɑ���S�z�������Ă��銳�҂̊��������������F���_�ˑ��iaddiction�j�Ɋւ���S�z�i95�� vs 82���Cp��0.02�j�C�ϐ��Ɋւ���S�z�i95�� vs 75���Cp��0.0002�j�B |
Miaskowski ��̃v���O�����iPRO-SELF�j�i2004�j7�j |
|
| �Ώ� | ���]�ڂ̂��邪��174 ��i�č��j |
| ���@ | �g���[�j���O�����Ō�t���C��1 �T�ɖK�₵�C①���q��p�������ɖ�̌���̑��k�C②�s���{�b�N�X���g�p�����o���܂̐����C③�ɂݓ��L�𗘗p�����u�ɕ]���̕��@�C④�ɂ݂��ɘa���Ȃ����̈�t�Ƃ̃R�~���j�P�[�V�������@�Ȃǂɂ��āC���҂̌ʐ��ɂ��킹���ʐڂ��s�����B���̌�C�t�H���[�A�b�v�Ƃ��āC2�C4�C5 �T�ڂɓd�b�Œɂ݂̋����ƒ��ɖ�̎g�p���@���m�F���C3�C6 �T�ڂɊ��҂̎����K�₵���B |
| ���� | ����Q�ł͑ΏƌQ�ɔ�r���āC6 �T�ڂ܂ł̒ɂ݂�NRS ���L�ӂɌ��������i�O���t�Ŏ�����Ă��萔�l�̋L�ڂ͂Ȃ��Cp��0.0001�j�B�܂��C����Q�ł́C����g�p��Ɠڗp��̍��v�g�p�ʂ���葝�����Ă����B |
Oliver ��̃v���O�����i2001�j8�j |
|
| �Ώ� | �ɂ݂̂���O���ʉ@���̊���64 ��i�č��j |
| ���@ | �ɂ݂Ɋւ���m���⎩�ȊǗ��C�u�ɃR���g���[���ɂ��āC�ʋ���ƃR�[�`���O�Z�b�V�����i��20 ���j���s�����B �Z�b�V�����ɂ́C①���҂̒ɂ݂�I�s�I�C�h�ɂ��Ă̔F�����m�F�C②����ɑ��鋳��C③WHO ���u�ɃR���g���[���K�C�h���C���Ɋւ�������C④���ÖڕW���m�F�C⑤�ڕW�ɓ��B���邽�߂̕��@����̓I�ɂ��邱�Ƃ��܂܂�Ă���B |
| ���� | ����Q�ł́C�ΏƌQ�Ɣ�r����2 �T�Ԍ�̒ɂ݂̕��ς̋��������P�����i�O���t�Ŏ�����Ă��萔�l�̋L�ڂ͂Ȃ��Cp��0.014�j�B�ɂ݂ɂ���Q�C�ɂ݂̕p�x�C�ɂ݂̒m���Ɋւ��ẮC�Q�ԍ��݂͂��Ȃ������B |
Syrjala ��̃v���O�����i2008�j9�j |
|
| �Ώ� | ����Ɋ֘A�����ɂ݂̂���O���ʉ@���̂���93 ��i�č��j |
| ���@ | ����Q�́C��{�I�Ȓɂ݂̓`�����Ɋւ���15 ���Ԃ̃r�f�I���������C�X�̊��҂��^��Ɏv���Ă��邱�Ƃɏœ_�����āC�n���h�u�b�N�����ƂɊŌ�t�ƂƂ��ɖ�20 ���Ԃ̐U��Ԃ���s�����B �n���h�u�b�N��4 �̃Z�N�V��������\������C①���Ȃ��i���ҁj���m�肽�����ƁF�ɂ݂̊ɘa�̃o���A�◘�p�\�Ȏ��Â̑I�����C��t�Ƃ̃R�~���j�P�[�V�����̏d�v�ȗv�f�ɂ��āC②����p�F�ɂ݂̎��Â�W����\���̂��镛��p�Ƃ��̑Ώ����@�ɂ��āC③��t�ɓ`���邱�ƁF�ݑ�ł̏�Ԃɏœ_�����Ă��Ǐ�̃`�F�b�N���X�g1 ���C④���ÁF26 �̈�ʓI�Ȗ�܂⑼�̒ɂ݂̎��ÂɊւ�����O���\�ȃJ�[�h���܂܂�Ă���B��L�Z�b�V����72 ���Ԍ�ɊŌ�t���d�b�ɂ��t�H���[�A�b�v��10 ���ԍs���C�ɂ݂Ƃ��̑��̏Ǐ�̕]���C����уn���h�u�b�N�̎g�p�̗L���̊m�F���s���C���҂̎���ɉ������B����̕]���͊J�n���i��l�j�C1�C3�C6 �J����ɍs�����B |
| ���� | ����Q�ł́C�ΏƌQ�Ɣ�r���āC�ɂ݂̊ɘa�̃o���A���y�����i����Q�̕��ϒl-�ΏƌQ�̕��ϒl��-0.3�Cp��0.001�j�C���i�̒ɂ݂̕��ϒl���y�������i����Q�̕��ϒl-�ΏƌQ�̕��ϒl��-0.8�Cp��0.03�j�B�܂��C�I�s�I�C�h��1 ���̕��ώg�p�ʂ����������i����Q�̕��ϒl-�ΏƌQ�̕��ϒl��0.3�Cp��0.001�j�B |
Thomas ��̃v���O�����i2012�j10�j |
|
| �Ώ� | ����Ɋ֘A�����ɂ݂�����O���ʉ@���̂���318 ��i�č��j |
| ���@ | �R�[�`���O�̌Q�i105 ��j�C�W���I�ȋ������Q�i103 ��j�C�ʏ�P�A�̌Q�i109 ��j��3 �Q�ɐU�蕪���C�W���I�ȋ���̌Q�́C�����u�Ƀ}�l�W�����g�̃r�f�I�i�o���A���������邱�Ƃɏœ_�����Ă����́j���������C�����u�Ƀ}�l�W�����g�Ɋւ�����q��������B�R�[�`���O�̌Q�́C�W���I�ȋ���ɉ����āC�����u�Ƀ}�l�W�����g�ɂ�����o���A���������邽�߂́C���@�Â��̃C���^�r���[�Z�@�̌P���������Ō�t���30 ���Ԃ̓d�b�̃Z�b�V������4 ��i6 �T�Ԃ̊Ԃɖ�1 �T�����Ɏ��{�j�C�����u�Ƀ}�l�W�����g�ɂ�����ԓx�̃o���A�C���ɖ�̎g�p�C��Ö@�C�����u�Ƀ}�l�W�����g�Ɋւ���R�~���j�P�[�V�����ɂ��Č��������B�܂��C�W���I�ȋ���̌Q�ƒʏ�P�A�̌Q�́C���T�[�`�A�V�X�^���g�ɂ��d�b��4 ����i6 �T�Ԃ̊Ԃɖ�1 �T�����Ɏ��{�j�B |
| ���� | �R�[�`���O�̌Q�ł́C�W���I�ȋ���̌Q�ƒʏ�P�A�̌Q�Ɣ�r���āC6 �T�Ԍ�̒ɂ݂ɂ��@�\��Q�Ɋւ���X�R�A���y�������i�O���t�Ŏ�����Ă��萔�l�̋L�ڂ͂Ȃ��Cp��0.03�C0.02�j�B�ɂ݂̋��x��ɂ݂̃X�R�A�́C�R�[�`���O�̌Q���ł����P�������C3 �Q�ɂ����ē��v�w�I�ȗL�Ӎ��݂͂��Ȃ������B�܂��C�����u�Ƀ}�l�W�����g�̃o���A�̃X�R�A���Q�ԍ��݂͂��Ȃ������B |
Yildrim ��̃v���O�����i2009�j11�j |
|
| �Ώ� | �ɂ݂�������@���̂���40 ��i�g���R�j |
| ���@ | ����Q�́C�����҂��쐬�������q��X���C�h��p���āC�ɂ݂̒�`��ɂ݂̌����C�ɂ݂̖Ö@�i���ɖ�̖��O�C�ʁC�g�p�ړI�C�g�p���@�j�C����p�i���ÁC�֔�C�ϐ��Ȃǁj�C�����u�Ƀ}�l�W�����g�Ɋւ��������M�E����i�ˑ��C�ϐ��Ȃǁj�C��Ö@�i��㪖@�C��㪖@�C�����N�Z�[�V�����C�}�b�T�[�W�Ȃǁj�C�ɂ݂̃A�Z�X�����g�iNRS ���g�p�j�Ɋւ��銳�ҋ���v���O�������C��Î҂ɍ��q�̓��e�ɂ��Ď��R�Ɏ��₵���B1 ��ڂ̃Z�b�V������30�`40 ���ԂŁC���҂̕a���ōs�����B�����āC3�C7 �����5�`15 ���̓��l�̃Z�b�V���������{���ꂽ�B |
| ���� | ����Q�ł́C �ΏƌQ�Ɣ�r���āC ���2�C4�C8 �T�Ԍ�̌�������ɂ݂̃X�R�A�i3.1��1.1��1.2��1.2�Cp��0.05�j�ƍł��ア�ɂ݂̃X�R�A�i1.3��0.7��0.8��0.7�Cp��0.05�j���y�������B�܂��C�ɂ݂̎��Âɑ��閞���x�̃X�R�A�����l�ɉ��P�����i7.3��8.0��8.3��8.3�Cp��0.05�j�B�܂��C�����2 �T�Ԍ�̂����u�Ƀ}�l�W�����g�̃o���A�̃X�R�A�i2.1��1.3�Cp��0.01�j���ቺ�����B |
van der Peet ��̃v���O�����i2009�j12�j |
|
| �Ώ� | �ɂ݂�����O���ʉ@���̂���120 ��i�I�����_�j |
| ���@ | ����Q�ł́C1�C3�C6 �T�ڂɊŌ�t�����҂̎����K�₵���B1 ��̖K�⎞�Ԃ́C1�`1 ���Ԕ��ŁC1 �T�ڂ̖K��ł́C���҂ɂ��킹����������邽�߂ɏ����f�[�^�����C�ɂ݂̍��q��n���C�����u�Ƀ}�l�W�����g�Ɋւ��鎿����C�\�ł���ΉƑ�������Ƃ���ŋ��炵���B�����āC1 ��2 ��CNRS ���g�p���Ēɂ݂̋��x��ɂݓ��L�ɋL�^������@�ɂ��Đ������C�ɂ݂⑼�̏Ǐ������ۂɈ�Ï]���҂֘A������悤�������B1 ��ڂ̖K���C�Ō�t�͎厡��ɕ����o���C�K�v������C���ׂẴP�[�X�Ɋւ��Ă���̒ɂ݂̎��Â̐��Ƃɒ��ɖ�ɂ��ăR���T���e�[�V��������ꂽ�B3�C6 �T�ڂ̖K��ł́C�ɂݓ��L��U��Ԃ�C�ɂ݂̋��x���m�F���C���҂��\���������Ă��Ȃ����q�̓��e�ɂ��Ęb����������J��Ԃ�����`�����肵���B |
| ���� | ����Q�ł́C�ΏƌQ�Ɣ�r���āC���4 �T�Ԍ�Œɂ݂��y�����i4.7��3.8 vs 4.4��3.8�Cp��0.02�j�C���8 �T�Ԍ�͌y�����Ȃ������B���8 �T�Ԍ�ł́C����Q�ł́C�ΏƌQ�Ɣ�r���āC�ɂ݂̒m�������サ���i53��63 vs 60��57�Cp��0.001�j���C�ɂ݂̒m���̌���ƒɂ݂̋��x�̌y���ɂ͊֘A���݂��Ȃ������B |
��NRS�inumerical rating scale�j
�ɂ݂�0 ����10 ��11 �i�K�ɕ����C�ɂ݂��S���Ȃ��̂�0�C�l������Ȃ��ōň��̒ɂ݂�10 �Ƃ��āC�ɂ݂̓_����₤���́B�Q���B
►�Տ��^��41
�����u�Ƀ}�l�W�����g�ɂ��Ă̋���́C�ǂ̂悤�ɍs���ׂ����H
����
- ►41-1�����u�Ƀ}�l�W�����g�ɂ��Ă̋���́C���̊��҂����ۂɐS�z���Ă��邱�Ƃ𖾂炩�ɂ��C���Ҍʂɉ�����������s���B
- ►41-2�����u�Ƀ}�l�W�����g�ɂ��Ă̊��ҋ���́C�p�����čs���B
- ►41-3�����u�Ƀ}�l�W�����g�ɂ��Ă̊��ҋ���̓��e�ɂ́C�ɂ݂ƃI�s�I�C�h�Ɋւ��鐳�����m���C�ɂ݂̎��Ìv��Ƌ�̓I�Ȓ��ɖ�̎g�p���@�C��Ï]���҂ւ̒ɂ݂̓`�����C��Ö@�Ɛ����̍H�v�C�Z���t�R���g���[���Ȃǂ��܂߂�B
1B�i���������C�Ⴂ�G�r�f���X���x���j
���
�����u�Ƀ}�l�W�����g�ɂ��Ă̊��ҋ�����ǂ̂悤�ɍs���ׂ����ɂ��Ă̋�̓I�ȕ��@�ƕ��@���r�������̍����Տ������͂Ȃ��B
���������āC�ǂ̕��@�����̕��@�Ɣ�r���Č��ʂ����邩�͖��炩�ł͂Ȃ��B
�{�K�C�h���C���ł́C���Ƃ̍��ӂƂ��āC�����u�Ƀ}�l�W�����g�̋���͎��ۂɂ͕����̕��@���g�ݍ��킹�čs���邽�߁C�\1 �ɋ������������r�����Ŏ��{����Ă�������v���O�����ɋ��ʂ��Ă������e����@�����C��������B
�܂��C���҂̉Ƒ��́C���҂̂����u�Ƀ}�l�W�����g�ւ̕s���������Ă���iFerrell ��j�C���҂��ɂ݂��o�����Ă��Ă��C�Ƒ������ɖ�̕���ɂ��߂炢��s���������C���҂ɒ��ɖ�p���������Ȃ��Ƃ����l���������Ƃ�����iLin�j�B���������āC�����u�Ƀ}�l�W�����g�ɂ��Ă̊��ҋ���ɂ����ẮC�\�Ȍ���C�Ƒ����܂ߍs�����Ƃ��]�܂����B
41-1�@���Ҍʂɉ�����������s��
�L�����������ꂽ����v���O�����ł́C�ɂ݂ɑ���u�S�ʓI�ȏ��v�����u���̊��҂����ۂɐS�z���Ă��邱�Ƃ𖾂炩�ɂ��Ή����邱�Ɓv���v�f�Ƃ��Ċ܂߂��Ă���ide Wit ��4�j�CLai ��5�j�CRimer ��6�j�COliver ��8�j�CSyrjala ��9�j�CThomas ��10�j�CYildrim ��11�j�Cvan der Peet ��12�j�j�B
�Ⴆ�C�u��ʓI�ɃI�s�I�C�h�ł͖��łɂ͂Ȃ�Ȃ��v�Ǝw�����邾���ł͂Ȃ��C�u�ǂ������S�z�����Ă��܂����v�ȂǁC�I�s�I�C�h���g�p���邤���ŐS�z���Ă�����e�₻�̗��R�����҂����̓I�ɕ����������ŁC���̊��҂̗L���Ă���������������B�����Ċ��҂����X�L���[��̎g�p���@���킩��Ȃ��̂ł���C���̕��@���ꏏ�Ɋm�F����Ƃ������悤�ɁC�R�[�`���O�Ȃǂ̋Z�@���p���C���q��v�_���L�ڂ����J�[�h�C����I�ȕ��p���m�F�ł���s���{�b�N�X�Ȃǂ����p���Ȃ��犳�Ҍʂɉ�����������s�����Ƃ��d�v�ł���B
41-2�@�p�����ċ�����s��
�L�����������ꂽ����v���O�����ł́C1 ���ł͂Ȃ��C���Ԃ̌o�߂ɔ����ăt�H���[�A�b�v��d�b��K��ōs������C����̐������e�̘^���⎋���o���ނ��g�p������C�ɂݓ��L���m�F�����肵�ČJ��Ԃ�������s���Ă���ide Wit ��4�j�CMiaskowski ��7�j�CSyrjala ��9�j�CThomas ��10�j�CYildrim ��11�j�Cvan der Peet ��12�j�j�B�܂�C���҂̒ɂ݂���ɖ�ɂ��Ă̗����͈�x�œ�������̂łȂ��C�܂��C���X�L���[��̎g�p�Ȃǂ͒ɂ݂̃^�C�~���O�ɂ��킹�C�p���������炪�K�v�ł��邱�Ƃ����������B
41-3�@ ������e�Ƃ��āC�ɂ݂ƃI�s�I�C�h�Ɋւ��鐳�����m���C�ɂ݂̎��Ìv��Ƌ�̓I�Ȓ��ɖ�̎g�p���@�C��Ï]���҂ւ̒ɂ݂̓`�����C��Ö@�Ɛ����̍H�v�C�Z���t�R���g���[�����܂߂�
�L�����������ꂽ����v���O�����Ɋ܂܂�Ă���������e�����\2 �Ɏ������ide Wit ��4�j�CLai ��5�j�CRimer ��6�j�CMoiaaskowski ��7�j�COliver ��8�j�CWard ��13�j�CClotfelter ��14�j�CYates ��15�j�j�B
�i1�j�ɂ݂ƃI�s�I�C�h�ɑ��鐳�����m��
���҂̒ɂ݂�I�s�I�C�h�Ɋւ���F�����m�F���C�ɂ݂��ɘa���邱�Ƃ̈Ӌ`��ɂ݂��䖝���邱�Ƃ̈��e����`���C�܂��C�u�Ɋɘa�̏�Q�ƂȂ��Ă������Ɋւ��鐳�����m�����������B���ɁC�I�s�I�C�h�ɂ��Ă̌�����F���i�u���łɂȂ�v�C�u�������k�܂�v�C�u���X�ɒ��Ɍ��ʂ��Ȃ��Ȃ�v�Ȃǁj�������݂��邱�Ƃ�����C���̔F���Ɏ��������ҌX�̔w�i�Ȃǂ��\���ɔc�����������ŁC�����u�ɂ�I�s�I�C�h�ɂ��Ă̏�����Ă����K�v�������iⅡ-6-2 �I�s�I�C�h�̌���ɂ��Ă̈�w�I�^���̍��Q�Ɓj�B
�i2�j�ɂ݂̎��Ìv��Ƌ�̓I�Ȓ��ɖ�̎g�p���@
���҂̒ɂ݂��ɘa���邽�߂̎��Ìv��C���Ȃ킿���҂̒ɂ݂̌����C�u�Ɏ��Â̖ڕW�C�ɂ݂̎��Ìv��C��̓I�Ȓ��ɖ�̎g�p���@�C���ɁC����I�Ȓ��ɖ�̕��p���@�C���X�L���[��̎g�p���@�C����p�̑�ɂ��Đ�������B
�i3�j��Ï]���҂ւ̒ɂ݂̓`����
�ɂ݂���Ï]���҂ɓ`���邱�Ƃ̈Ӌ`��`���C�ɂ݂̕]���C�ɂݓ��L�ȂǁC���҂��ɂ݂���Ï]���҂ɓ`������@���K�����邱�Ƃ����߂�B�����u�Ƀ}�l�W�����g�����܂������Ȃ��������̘A�����@�ɂ��Ă������Ɋ܂܂��B��̓I�Ȓɂ݂̋�����`������@�Ƃ��ẮCNRS ����ʓI�ɐ���������iⅡ-2-2 �ɂ݂̕]���̍��Q�Ɓj�B
�i4�j��Ö@�Ɛ����̍H�v
���҂�Ƒ����s���Ă���L���ȖȊO���u�Ɋɘa���@���m�F���C�u�Ɋɘa�ɂȂ���Ö@�ȊO�̕��@���݂��čs���悤�ɑ����B�Ⴆ�C�u�ǂ̂悤�ɂ���Βɂ݂��a�炬�܂����C�ɂ݂������Ȃ�܂����v�Ȃǂƕ]�����C�����̂����Œɂ݂���������v����y������v���i���߂�C�ړ��̎d���̍H�v�Ȃǁj���ώ@���C�����Ɏ������悤�ɑ����B
�i5�j�Z���t�R���g���[��
�����u�Ƀ}�l�W�����g���s�����߂Ɋ��҂������Œɂ݂��ώ@����悤�ɑ����B�Ⴆ�C�ɂݓ��L��t���[�V�[�g��p���C���Ҏ��g���R���g���[�����Ă�����������Ă�悤�ɁC�ꏏ�Ɋ��҂����s���₷�����@��I������B
| �ɂ݂ƃI�s�I�C�h�ɑ��� �������m�� |
�ȉ��̌�����F�����Ȃ������m�F����
|
|---|---|
| �ɂ݂̎��Ìv��ƒ��ɖ� �̋�̓I�Ȏg�p���@ |
|
| ��Ï]���҂Ƃ̒ɂ݂Ɋ� ����R�~���j�P�[�V���� |
|
| ��Ö@�Ɛ����̍H�v |
|
| �Z���t�R���g���[�� |
|
���F�_�o�u���b�N
�Ǐ��������_�o�j���C�M�Ȃǂɂ��_�o�̓`�B�@�\���ꎞ�I�E�i�v�I�ɎՒf���邱�Ƃɂ���āC�܂��́C�I�s�I�C�h�Ȃǒ��ɖ�̍d���O�o�E�N�������o�ւ̓��^�ɂ���Ē��Ɍ��ʂ��i�B�i���߁j���`�̐_�o�u���b�N�͈�ʓI�ɑO�҂������C��҂Ƃ��킹�����̂��ȓI���Ɂianesthesiological procedure�j�ƌĂԂ��Ƃ����邪�C�{�K�C�h���C���ł́C�ȕւɁC���������킹�āu�_�o�u���b�N�v�ƌĂԁB
�����̃K�C�h���C���Ƃ̐�����
NCCN �̃K�C�h���C���i2012�j�ł́C�����u�Ƀ}�l�W�����g�ɂ����銳�ҋ���ɂ��āC�ɂ݂��ɘa���邱�Ƃ̏d�v���C�u�Ɋɘa�ɗp�������×p����ł͐��_�ˑ��͖��ɂȂ�Ȃ����ƁC���҂ƉƑ��ɒɂ݂̒��x�╛��p�C�ɂ݈ȊO�̋�ɏǏ���ɘa���邱�ƂŒɂ݂̃R���g���[�������i����邱�Ƃ̉\���C����сC�����u�Ƀ}�l�W�����g�Ɋւ���^��ɂ��Ĉ�Ï]���҂ɓ`���邱�Ƃ��d�v�ł��邱�Ƃ����炷�邱�Ƃ���������Ă���B�܂��C���ɖ�̎�ނƎg�p���@�C����p��C��Ï]���҂ɘA�����ׂ��Ǐ�ƘA����̈ꗗ�����ʂŏ����邱�ƁC�p���I�Ƀt�H���[�A�b�v���邱�Ƃ���������Ă���B
�i�~�c�@�b�C�ז���I�C�V���q�q�C���Ԉ�q�C�т��q�C�A������j
�y�� ���z
1�j Allard P, Maunsell E, Labbé J, et al. Educational interventions to improve cancer pain control�F a systematic review. J Palliat Med 2001�G4�F191-203
2�j Goldberg GR, Morrison RS. Pain management in hospitalized cancer patients�Fa systematic review. J Clin Oncol 2007�G25�F1792-801
3�j Devine EC. Meta-analysis of the effect of psychoeducational interventions on pain in adults with cancer. Oncol Nurs Forum 2003�G30�F75-89
4�j de Wit R, van Dam F, Zandbelt L, et al. A pain education program for chronic cancer pain patients�Ffollow-up results from a randomized controlled trial. Pain 1997�G73�F55-69
5�j Lai YH, Guo SL, Keefe FJ, et al. Effects of brief pain education on hospitalized cancer patients with moderate to severe pain. Support Care Cancer 2004�G12�F645-52
6�j Rimer B, Levy MH, Keintz MK, et al. Enhancing cancer pain control regimens through patient education. Patient Educ Couns 1987�G10�F267-77
7�j Miaskowski C, Dodd M, West C, et al. Randomized clinical trial of the effectiveness of a self-care intervention to improve cancer pain management. J Clin Oncol 2004�G22�F1713-20
8�j Oliver JW, Kravitz RL, Kaplan SH, et al. Individualized patient education and coaching to improve pain control among cancer outpatients. J Clin Oncol 2001�G19�F2206-12
9�j Syrjala KL, Abrams JR, Polissar NL, et al. Patient training in cancer pain management using integrated print and video materials�Fa multisite randomized controlled trial. Pain 2008�G135�F175-86
10�j Thomas ML, Elliott JE, Rao SM, et al. A randomized, clinical trial of education or motivational-interviewing-based coaching compared to usual care to improve cancer pain management. Oncol Nurs Forum 2012�G39�F39-49
11�j Yildirim YK, Cicek F, Uyar M. Effects of pain education program on pain intensity, pain treatment satisfaction, and barriers in Turkish cancer patients. Pain Manag Nurs 2009�G10�F220-8
12�j van der Peet EH, van den Beuken-van Everdingen MH, Patijn J, et al. Randomized clinical trial of an intensive nursing-based pain education program for cancer outpatients suffering from pain. Support Care Cancer 2009�G17�F1089-99
13�j Ward S, Donovan HS, Owen B, et al. An individualized intervention to overcome patient-related barriers to pain management in women with gynecologic cancers. Res Nurs Health 2000�G23�F393-405
14�j Clotfelter CE. The effect of an educational intervention on decreasing pain intensity in elderly people with cancer. Oncol Nurs Forum 1999�G26�F27-33
15�j Yates P, Edwards H, Nash R, et al. A randomized controlled trial of a nurse-administered educational intervention for improving cancer pain management in ambulatory settings. Patient Educ Couns 2004�G53�F227-37
�y�Q�l�����z
16�j Ferrell BR, Grant M, Chan J, et al. The impact of cancer pain education on family caregivers of elderly patients. Oncol Nurs Forum 1995�G22�F1211-8
17�j Lin CC. Barriers to the analgesic management of cancer pain�Fa comparison of attitudes of Taiwanese patients and their family caregivers. Pain 2000�G88�F7-14
�S
����̕a�Ԃɂ��ɂ݂ɑ��鎡��
�P
�_�o��Q���u��
�� ����ɂ��_�o��Q���u�����ɑ���L���Ȏ��Â͉����H
�֘A����Տ��^��
- ►42����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC�s���ׂ��]���͉����H
- ►43����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►44����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC�R��������C�R����C�R�s������CNMDA ��e�̝h�R��C�R���`�R�X�e���C�h�́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►45����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC������ɕ⏕��ʂ��Ă����ʂ��Ȃ��ꍇ�C���̒��ɕ⏕��ւ̕ύX�╹�p�́C�s��Ȃ����Ƃɔ�r���Ēɂ݂��ɘa���邩�H
����
- ►42�ɂ݂̌����̕]���ƒɂ݂̕]�����s���B
- ►43����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���iⅢ-1 ���ʂ����u�Ɏ����̍��Q�Ɓj
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►44����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC�R��������C�R����C�R�s������CNMDA ��e�̝h�R��C�R���`�R�X�e���C�h�̂��������ꂩ�𓊗^����B
2B�i�ア�����C�Ⴂ�G�r�f���X���x���j - ►45����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC������ɕ⏕��ʂ��Ă����ʂ��Ȃ��ꍇ�C���Ƃɑ��k���������ŁC���̒��ɕ⏕��ւ̕ύX�╹�p���s���B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j
���_�o��Q���u��
�Ɋo��`����_�o�̒��ړI�ȑ����₱���̐_�o�̎����ɋN������ɂ݁B�ܔM�ɁC�d���ɁC�Ɋo�ߕq�C���o�ߕq�C�A���f�B�j�A�Ȃǂ����Ƃ�����B����Œ��ɕ⏕��̕��p��K�v�Ƃ��邱�Ƃ������B�Q���B
►�Տ��^��42
����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC�s���ׂ��]���͉����H
����
�ɂ݂̌����̕]���ƒɂ݂̕]�����s���iⅡ-2 �ɂ݂̕�I�]���̍��Q�Ɓj�B
���
1 �j�ɂ݂̌�����g�̏�����摜��������]������
�_�o��Q���u�ɂ́C�����_�o�n�E�����_�o�n�̏�Q�ɂ���Ĉ����N�������B
�����́C①����ɂ��_�o��Q���u�ɁC②���Âɂ��_�o��Q���u�ɁC③����E���ƒ��ڊW�̂Ȃ��_�o��Q���u�ɂ�����B�����͌����ɂ���đΏ�������@���قȂ�B�{�K�C�h���C���̖Ö@�ł́C�u����ɂ��_�o��Q���u�Ɂv�������B
�i1�j����ɂ��_�o��Q���u��
�Ґ������nj�Q�C�r�_�o�p�Z���nj�Q�C���啔�_�o�p�Z���nj�Q�C���������؏nj�Q�Ȃǂ��܂܂���iⅡ-1 �����u�ɂ̕��ށE�@���E�nj�Q�̍��Q�Ɓj�B�Ö@���s���ƂƂ��ɁC�O�Ȏ��ÁC���w�Ö@�C���ː����Â̓K���ɂ��Č�������B
�ɂ݂��Ґ������nj�Q�Ȃǐ_�o��Ⴢ̏nj�ł��邩�f����B�Ґ������nj�Q�ɂ��ɂ݂̏ꍇ�C������Ⴢɐi�W�����ꍇ�͊��҂�QOL ���傫�����Ȃ��邽�߁C�f�f���x�̍���MRI �Ȃǂ��{�s���C���}�ɕ��ː����ÉȁE���`�O�ȂȂǂ̐��Ƃɑ��k����B
�i2�j����̎��Âɂ��_�o��Q���u��
���w�Ö@�ɂ��_�o��Q���u�Ɂi�r���A���J���C�h�n��܁C�^�L�T���n��܂ő����݂���j�C���[�؏����u�ɁE�J���p���u�ɂȂNJO�Ȏ��Âɂ��ɂ݂Ȃǂ�����B
�i3�j����E���ƒ��ڊ֘A�̂Ȃ��_�o��Q���u��
�я��v�]��_�o�ɁC���A�a���_�o��Q�C�Ғ��Nj���ǂȂǂ��ɂ݂̌����ƂȂ��Ă��Ȃ�����]������
2 �j�ɂ݂̕]�����s��
�ɂ݂̓��퐶���ւ̉e���C�ɂ݂̃p�^�[���i�����ɂ��ˏo�ɂ��j�C�ɂ݂̋����C�ɂ݂̕��ʁC�ɂ݂̌o�߁C�ɂ݂̐���C�ɂ݂̑������q�ƌy�����q�C���ݍs���Ă��鎡�Â̔����C����сC���X�L���[��̌��ʂƕ���p�ɂ��ĕ]������B
►�Տ��^��43
����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�ɂ݂��ɘa����B
����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��āC���҂�ΏۂƂ������̍����Տ������͂Ȃ��B
�I�s�I�C�h�𒆐S�Ƃ���WHO ���������u�Ɏ��Ö@�̐_�o��Q���u�ɂւ̒��Ɍ��ʂ�]�������ώ@����������B�Ⴆ�CGrond ��1�j�́C�I�s�I�C�h�𒆐S�Ƃ���WHO ���������u�Ɏ��Ö@�Ɋ�Â������ẤC�N�Q��e���u�����C�������u�ɁC�_�o��Q���u�ɂ̂�����ɂ����Ă��C�����x�̒��Ɍ��ʂ�����ꂽ�ƕ����i���@����3 ����̒ɂ݂�NRS�i0�`10�j�F�N�Q��e���u��6.6��2.6 vs �������u��6.5��3.0 vs �_�o��Q���u��7.0��2.8�j�B���l�ɁCMercadante ��i1999�j2�j�́C�ݑ�Âɂ����āC�_�o��Q���u�ɂ��܂ޒɂ݂̑����́CWHO ���������u�Ɏ��Ö@�Ŏ��S�O1 �T�ԑO�܂Ŋɘa�ł������Ƃ���Ă���B�܂��CCaraceni ��3�j�ɂ��K�o�y���`���̌��ʂ��݂��������r�����ł́C�I�s�I�C�h�ɂ�鎡�Â��ΏƌQ�Ƃ��ėp�����C�ɂ݂�33���ቺ��L���Ƃ����L�����́C���^��10 ���ڂɖ�60���ł������B
Mercadante ��i2009�j4�j�́C����ɂ��_�o��Q���u�ɂ�L���銳��167 ��̊ώ@�����ɂ����āC�����u�Ɋw��̐_�o��Q���u�ɂ̃O���[�h���ނ�p���āC����ɂ��_�o��Q���u�ɂ��m��I�idefinite�C60 ��j�C�\���������iprobable�C36 ��j�C�\�����Ⴂ�iunlikely�C71 ��j�ɕ��ނ��C�I�s�I�C�h�̒��Ɍ��ʂ��^�C�g���[�V�����O��Ŕ�r���Ă���B����ɂ��ƁC�_�o��Q���u�ɂ́u�\�����Ⴂ�v�ꍇ�ł́C�_�o��Q���u�ɂ��u�m��I�v�ł���ꍇ�Ɣ�r���āC�I�s�I�C�h�ɂ����Ɍ��ʂ��L�ӂɍ����������̂́C�_�o��Q���u�ɂ��u�m��I�v�C�u�\���������v�C�u�\�����Ⴂ�v�̂�����ɂ����Ă��C�I�s�I�C�h�̃^�C�g���[�V�����ɂ��L�ӂȒ��Ɍ��ʂ�����ꂽ�kNRS�i0�`10�j�G�m��I�F5.9�}2.2��2.4�}1.7�C�\���������F4.9�}2.2��2.3�}1.6�C�\�����Ⴂ�F5.4�}1.9��1.7�}1.3�l�B�Ȃ��C�_�o��Q���u�ɂ��u�m��I�v�ȏꍇ�ɂ́C�I�s�I�C�h�����������Ɣ�ׂč��������B�ȏ���C�_�o��Q�ɂ��m��I�ȏꍇ�ł��C�I�s�I�C�h�̐ϋɓI�ȑ��ʂƒ��Ӑ[������p�̑Ή��ɂ��Տ��I�ɗL���Ȓ��ɂ�������Ƃ��Ă���B
�҂̐_�o��Q���u�ɂɊւ���I�s�I�C�h�̒��Ɍ��ʂ�]������Eisenberg5�j�̌n���I���r���[�ł́C�I�s�I�C�h�͒����x�̒��Ɍ��ʂ����邱�Ƃ��m�F����Ă���B
����
�ȏ���C�m���͏\���ł͂Ȃ����̂́C����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�ɂ݂��ɘa����ƍl������B
���������Ė{�K�C�h���C���ł́C����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC���̋@���ɂ�邪���u�ɂƓ��l�ɁC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s�����Ƃ𐄏�����B
���F�N�Q��e���u��
�̐��ɂƓ����ɂɕ��ނ����B�����_�o�I���̐N�Q��e�킪�C�M��@�B�I�E���w�I�Ȏh���ɂ���Ď��N�Q��d�C�M���ɕϊ����C�]�ɓ`���邱�ƂŎ��o����ɂ݁B�Q���B
►�Տ��^��44
����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC�R����������1�C�R������2�C�R�s��������3�CNMDA ��e�̝h�R����4�C�R���`�R�X�e���C�h��5�́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC�R��������C�R����C�R�s������CNMDA ��e�̝h�R��C�R���`�R�X�e���C�h�́C�ɂ݂��ɘa����\��������B
����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC�R��������C�R����C�R�s������CNMDA ��e�̝h�R��C�R���`�R�X�e���C�h�̂��������ꂩ�𓊗^����B
��1�F�R��������
�������i�Ă�j����ɗp�����܂ŁC���ɕ⏕��Ƃ��Ă��p������B�_�o�̋�����_�o�`�B������}�������p�@���ɂ����Ɍ��ʂ�����B�Q���B
��2�F�R����
��ɂ��Ǐ���ɘa�����܂ŁC���ɕ⏕��Ƃ��Ă��p������B�����_�o�n�̃Z���g�j���C�m���A�h���i�����Ď�荞�݂�j�Q���C���s���}���n�����邱�Ƃɂ���Ē��Ɍ��ʂ�����B�Q���B
��3�F�R�s������
�s�����̎��ÂɎg�p�����܂ŁC���ɕ⏕��Ƃ��Ă��p������B�ɂ݂ɂ��_�o�̉ߕq������}�����C�܂��Ґ���p�j���[�����̉ߏ�Ȋ����d�ʂ�}������B�Q���B
��4�FNMDA ��e�̝h�R��
�������̐_�o�`�B�����Ƃ��Ă��@�\����O���^�~���_���C�O���^�~���_��e�̂̈�ł���NMDA�iN-���`��-D-�A�X�p���M���_�j��e�̂Ɍ�������̂�j�Q���Ē��ɍ�p�Ȃǂ������܁B�Q���B
��5�F�R���`�R�X�e���C�h
���t�玿�X�e���C�h�B���]�ڒɁC��ᇂɂ��_�o�����C�ߒɁC���W�������i�C�Ǎo����̕ǂȂǂɂ��ɂ݂Ɏg�p�����B�ɂ݂����m���镔�ʂ̕���̌y���C�X�e���C�h�������̎�ᇂ̏k���Ȃǂ���p�@���ƍl�����Ă���B�Q���B
���
���ɕ⏕��Ƃ��ẮC�R��������C�R����C�R�s������CNMDA ��e�̝h�R��C����уR���`�R�X�e���C�h�Ȃǂ�����B
�{�Տ��^��Ɋւ���Տ������Ƃ��āC���u�ɂɂ��ẮC��r�I�L�x�ȗՏ������ɂ��C���҂������Ɍ��ʂƕ���p�̒��x�����炩�ɂ���Ă����iⅡ-4-3 ���ɕ⏕���̍��Q�Ɓj�B����C����ɂ��_�o��Q���u�ɂɂ��Ă̒m���͌����Ă��邪�C�R��������C�R����C�R�s������CNMDA ��e�̝h�R��C�R���`�R�X�e���C�h�̈ꕔ�ɂ��āC�������r�������܂ޒm��������B
Bennett �̌n���I���r���[6�j�ł��C�R����܂��͍R����������I�s�I�C�h�ɕ��p�����ꍇ�ɁC����p�ɂ��L�p���͌��肳��邪���ʂ����҂����Ƃ��Ă���B
1 �j�R��������
�i1�j�v���K�o����
����ɂ��_�o��Q���u�ɂւ̗L�����Ɋւ��ẮC1 ���̖������r����������BMishra ��7�j�͐_�o��Q���u�ɂ̂��邪��120 ���30 �Ⴘ��AT �Q�i�A�~�g���v�`������50 mg/�����J�n���C1 �T�Ԃ�����75 mg/���C100 mg/���Ƒ��ʂ���Q�j�CGB �Q�i�K�o�y���`����900 mg/������J�n���C1 �T�Ԃ�����1,200 mg/���C1,800 mg/���Ƒ��ʂ���Q�j�CPG �Q�i�v���K�o������150 mg/�����J�n���C1 �T�Ԃ�����300 mg/���C600 mg/���ɑ��ʂ���Q�j�CPL �Q�i�v���Z�{�𑼂̖�܂Ɠ����J�v�Z���ɏ[�U����3 �T�ԓ����������Q�j��4 �Q�ɕ����C�ɂ݂��������̓��X�L���[��Ƃ��ă����q�l���������܂𓊗^�����ۂ̒��Ɍ��ʁC����p�C���Ö����x�����Ă���B���̌��ʁC3 �T�Ԍ��VAS ��AT �Q��7.77 ����3.23 �ցCGB �Q��7.5 ����3.07 �ցCPG �Q��7.77 ����2.5 �ցCPL �Q��7.47 ����3.4 �ɗL�ӂɒቺ���C�܂�PG �Q��VAS ��GB �Q��VAS ���L�ӂɒႩ�����ip��0.042�j�B����p���v���K�o�����Q�Œ��x�̌y�����҂������C���Ö����x�̒Ⴂ���҂����Ȃ������C�ƕ��Ă���B
Moore ��8�j�̔�ł̃��r���[�ɂ��ƁC�v���K�o����600 mg/����NNT��1�́C�я��v�]��_�o�ɂ�3.9�C���A�a���_�o��Q���u�ɂ�5.0�C�����ɂ�5.6 �ł���C���C��15�`25���ɁC�߂܂���27�`46���ɁC���Â̒��~��18�`28���Ŋώ@����Ă����B
��1�FNNT�iNumber Needed to Treat�j
1 ��̌��ʂ邽�߂ɂ��̎��Â����l�̊��҂ɗp���Ȃ���Ȃ�Ȃ����������w�W�B
�i2�j�K�o�y���`��
��C���҂̐_�o��Q���u�ɂɑ��āCWiffen9�j�̌n���I���r���[�ł́C�K�o�y���`���ɂ́C�߂܂��C���C�C���ɁC�����C�����C���S�̕���p�����邪�C�����x�̒��Ɍ��ʂ����邱�Ƃ��m�F����Ă���B�v���Z�{��19���C�K�o�y���`����42���ɗL���ł���CNNT ��4.3 �ł������B���Ò��~�̓v���Z�{�ƗL�Ӎ��͂Ȃ��i14�� vs 10���j�C�d�x�ł͂Ȃ�����p��NNH��2��3.7 �ł���B
����C���҂̐_�o��Q���u�ɂւ̗L�����Ɋւ��ẮC�������r������2 ���C�O���r������2 ������B
Caraceni ��10�j�ɂ�閳�����r�����ł́C�I�s�I�C�h���Ò��Ő_�o��Q���u�ɂ̂��邪��121 ���ΏۂɁC�K�o�y���`��600�`1,800 mg/���ƃI�s�I�C�h�̕��p���ÂƁC�I�s�I�C�h�P�Ǝ��Â̌��ʂ��r�����Ƃ���C�ɂ݂�NRS �́C�K�o�y���`�����p�Q�ł��ቺ�����i7.0��4.6 vs 7.7��5.4�Cp��0.025�j�B�ɂ݂�33���ቺ��L���Ƃ����L�����́C���^��1�`5 ���ɃK�o�y���`���Q�ō����������i3 ���ځC57�� vs 31���j�C10 ���ڂɂ͍��͂Ȃ��Ȃ����i62�� vs 64���j�B����p�Ƃ��āC���C�i23�� vs 9.7���j�C��������݁i8.8�� vs 0���j�C���S�E�q�f�i6.3�� vs 0���j�����������B�������~�ɂ��Ǐ�͂��������7���ɔF�߂��C���ÁC�ċz�}���C�����ቺ�Ȃǂł������B�K�o�y���`���́C�I�s�I�C�h�P�Ǝ��ÂƔ�r���Ă�����ԂɌ����āC����ɂ��_�o��Q���u�ɂ����ɘa�����B
Keskinbora ��11�j�ɂ�閳�����r�����ł́C�I�s�I�C�h���Ò��̂���ɂ��_�o��Q���u�ɂ̂��銳��75 ���ΏۂɁC�K�o�y���`������629 mg/���i4 ���ځj�`1,287 mg/���i13 ���ځj�ƃI�s�I�C�h�Ƃ̕��p���ÂƁC�I�s�I�C�h�P�Ǝ��Â�13 ���Ԃ̒��Ɍ��ʂ��r�����Ƃ���C����4�C13 ����ɃK�o�y���`���Q�ɂ�苭�����Ɍ��ʂ��F�߂�ꂽ�i�x�[�X���C���Ɣ�r����NRS �̕ω��F�ܔM�ɁF-7.4 vs -5.8�Cp��0.018�G�d���ɁF-6.8 vs -4.7�Cp��0.009�j�B�K�o�y���`�����p�ł̕���p�́C���C�i13�� vs 6.2���j�������������C���S�͏��Ȃ��i3.2�� vs 19���j�C�߂܂��i13�� vs 13���j�͓����ł������B�ċz�}���ɂ�鎎�����~�̓K�o�y���`�����p�Q��1 ��F�߂��B
���̑��ɁC2 ���̑O���r����������BCaraceni ��12�j�ɂ��I�s�I�C�h���Ò��̂���ɂ��_�o��Q���u�ɂ̂��銳��22 ���ΏۂɁC�K�o�y���`��1,004 mg�i600�`1,800 mg�j�̕��p���s�����Ƃ���CNRS ��6.4 ����3.2 �ɒቺ������CRoss ��13�j�ɂ��C����ɂ��_�o��Q���u�ɂɑ���300�`1,800 mg �̃K�o�y���`���ƃI�s�I�C�h���p��45���ɗL���k�ɂ݂̒��x��Brief Pain Inventory�iBPI�j��3��33���ȏ�ቺ�l�ł������Ƃ����Ȃǂ�����B�����̘_�����܂�Bennett6�j�̌n���I���r���[�ɂ����āC�K�o�y���`���̃I�s�I�C�h�Ƃ̕��p�́C���̍R���������R����Ɣ�r���Ă��L���ł���Ƃ��Ă���B
�{�M�ɂ����Ă��CTakahashi ��14�j�ɂ��O�����ώ@�������Ȃ���Ă���B����ɂ��C�܂��͂��Âɂ��_�o��Q���u�ɂ�����C�I�s�I�C�h�ɂ����Ɍ��ʂ��\���łȂ����҂ɑ��āC400�`1,200 mg �̃K�o�y���`���p�����Ƃ���C�ň��C�ŏ��C���ς�NRS �͂��ꂼ��7.2�}1.8��5.9�}2.3�ip��0.0003�j�C3.6�}2.3��3.0�}1.4�ip��0.0033�j�C5.7�}1.9��4.5�}1.5 �ƗL�ӂɌ��������B����ŁC4 �Ⴊ�K�o�y���`���ɂ��Ǝv���镛��p�̂��ߌ������~�ƂȂ��Ă����B
�i3�j�v���K�o�����C�K�o�y���`���ȊO�̍R��������
�v���K�o�����C�K�o�y���`���ȊO�̍R��������ɂ��ẮC�҂ł̒��Ɍ��ʂ͒����x�ł��邱�Ƃ�������Ă���B�҂̐_�o��Q���u�ɂ���Ƃ���Finnerup15�j�̌n���I���r���[�ł́C50���ȏ�̒ɂ݂̉��P��L���Ƃ���`�����ꍇ��NNT �́C�J���o�}�[�s��2.0�C�t�F�j�g�C��2.1�C�o���v���_2.8 �Ȃǂł���C�R��������S�̂�4.2 �ł������B����p�ɂ�鎡�Ò��~��NNH ��11 �ł����iⅡ-4-3 ���ɕ⏕���̍��Q�Ɓj�B
����C���҂ł͎��̍����Տ������͂قƂ�ǂȂ��C�t�F�j�g�C���C�o���v���_�C�N���i�[�p���ɂ��ď����̌���������ɂ����Ȃ��B
Yajnik ��16�j�̖������r�����ł́C�����u�Ɋ���75 ���ΏۂƂ��C�u�v���m���t�B���P��0.4 mg/���C�t�F�j�g�C���P��200 mg/���C�u�v���m���t�B��0.2 mg/���ƃt�F�j�g�C��100 mg/�����p���r�����Ƃ���C50���ȏ�̒��x�Œɂ݂����P�����䗦�ɍ��͂Ȃ������i84�� vs 72�� vs 88���j�B�t�F�j�g�C���P�ƌQ�ł̕���p�͓��ɂƂ߂܂������ꂼ��1 ��ɁC���p�Q�ł͕���p�͊ώ@����Ȃ������B
Hardy ��17�j�ɂ�閳�����r�����ł́CWHO ���������u�Ɏ��Ö@�ŃI�s�I�C�h���g�p���Ă��ɂ݂̉��P���݂��Ȃ��_�o��Q���u�Ɋ���25���ΏۂɁC�o���v���_400�`1,200 mg/�����p�̌��ʂ��݂��Ƃ���15 ����̗L�����́C①BPI �ɂ��ɂ݂�4 �i�K�ɕ����C�u�ɂ݂Ȃ��v�C�u�����ɂ��i1�`4�j�v�C�u���ɂ��i5�`7�j�v�C�u�Ђǂ��ɂ��i8�`10�j�v�ɕ��ނ�1 �i�K�ȏ�y�������̂�56���C②NRS �ŕ��ς̒ɂ݂���Βl1 �ȏ�ቺ�����̂�67���C③�ɂ݂̒ቺ�̒��x�����Ŗ₢50���ȏ�̒ቺ���݂�ꂽ�̂�28���������B1 �Ⴊ�U��̂��߂ɒ��~�C5 �Ⴊ�a��̈����̂��߂ɒ��~�����B����p�͖��C�i8 ����30���C15 ����47���j���ł������C�����ŁC�ӂ���i8 ����10���C15 ����41���j�C�H�~�s�U�i8 ����25���C15 ����25���j�ł������B
Hugel18�j��ɂ��O���r�����ł́C�I�s�I�C�h�ɂ����Ɍ��ʂ��\���łȂ��_�o��Q���u�ɂ̂���10 ���ΏۂɁC�N���i�[�p��0.5�`2 mg�i5 ���㕽��1 mg�j�̕��p���^�̌��ʂ��݂��Ƃ���C5 �Ⴉ��]���������C4 �i�K�ɂ݂̕]�����@�i0�`3�j�ŁC���ÑO����3 ���玡�Ì�1 �ɒቺ�����B3 ��͒ɂ݂̈����C2 ��͖��C�̈����̂��߂Ɏ����𒆎~�����B
����
�ȏ���C�v���K�o��������уK�o�y���`���́C����ɂ��_�o��Q���u�ɂɑ��āC����p�ɒ��ӂ��Ȃ���I�s�I�C�h�ƕ��p���Ďg�p���邱�Ƃɂ�蒆���x�ȏ�̒ɂ݂��ɘa����ƍl������B�K�o�y���`���ȊO�̍R��������́C����ɂ��_�o��Q���u�ɂɑ��āC�ɂ݂��ɘa���鍪���͕s�\���ł��邪�C�҂̐_�o��Q���u�ɂł̒m���ƗՏ��o������L���ȉ\��������B
��2�FNNH�iNumber Needed to Harm�j
���l�̊��҂����Â����1 ��̗L�Q�ǗႪ�o�����邩�������w�W�B
��3�FBPI�iBrief Pain Inventory�j
�ȈՒɂݎ���\�Ƃ��Ă�銳�҂̎��L�L�ڌ`���̒����\�B�ɂ݂̋����i���݁C�ň��̎��C�ł��y�����FNRS�j�ƕ��ʁC����̒��Ɍ��ʁC�ɂ݂����퐶���ɉe��������x�iNRS�C7 ���ځj����\������Ă���B
2 �j�R����
�i1�j�O�n�R������
�҂̐_�o��Q���u�ɂ̌n���I���r���[�ł́C�A�~�g���v�`�����Ȃǂ̎O�n�R����́C����p�Ƃ��Ė��C�C�����C�����C�֔�C�r�A��Q���ώ@����邪�C�҂̐_�o��Q���u�ɂɑ��Ē����x�̒��Ɍ��ʂ����邱�Ƃ��m�F����Ă���BSaarto ��19�j�̃��r���[�ł́C�u�����x�̒��Ɍ��ʁv��L���ƒ�`�����ꍇ��NNT��3.6 �ł���C���Ò��~��NNH ��28�C�d�ĂłȂ�����p��NNH ��6 �ł������iⅡ-4-3 ���ɕ⏕���̍��Q�Ɓj�B
����C���҂̐_�o��Q���u�ɂ̗L�����Ɋւ���m���͌����Ă���C����܂łɖ������r������1 ������݂̂ł���B
Mercadante ��20�j�ɂ�閳����N���X�I�[�o�[��r�����ł́C��r�I�S�g��Ԃ̂悢����ɂ��_�o��Q���u�ɂŃ����q�l���^���̊���16���ΏۂɁC�A�~�g���v�`����25 mg�@3 ���Ԃɑ���50 mg�@4 ���Ԃƃv���Z�{�Ƃ��r�����Ƃ���C���ς̒ɂ݂̋����iNRS�@5.5��4.7 vs 5.4�Cp �l�L�ڂȂ��j��C�ɂ݂̍ŏ��l�C�ɂ݂̊ɘa�͕ς��Ȃ������BNRS �ł̒ɂ݂̍ő�l�̓A�~�g���v�`�����̂ق����ቺ�����i8.4��7.0 vs 7.9�Cp��0.035�j�B�������C����p�̓A�~�g���v�`�����̂ق��������C���C�i1��1.6 vs 0.8�Cp��0.036�j�C�����i0.06��0.6 vs 0.06�Cp��0.003�j�C�����i1.1��1.8 vs 1.3�Cp��0.034�j���ώ@���ꂽ�B�ȏ���C���҂ɂ�����A�~�g���v�`�����̌��ʂ͏��Ȃ��C�T�d�ɓ��^����ׂ��ł���ƌ��_�����B
���F�O�n�R����
�]������g���Ă����R����̈��B�����_�o�n�̃Z���g�j���C�m���A�h���i�����Ď�荞�݂�j�Q���C���s���}���n�����邱�Ƃɂ���Ē��Ɍ��ʂ�����i��\�I�Ȗ�܂Ƃ��ăA�~�g���v�`�����Ȃǁj�B
�i2�j���̑��̍R����
�O�n�R����ȊO�̍R����Ƃ��āC�I��I�Z���g�j���Ď�荞�ݑj�Q��iselective serotonin reuptake inhibitor�GSSRI�j�C�Z���g�j���E�m���A�h���i�����Ď�荞�ݑj�Q��iserotonin noradrenalin reuptake inhibitor�GSNRI�j�́C�҂̐_�o��Q���u�ɂł͂�����x�̒��Ɍ��ʂ����邱�Ƃ��m�F����Ă���B
�҂̐_�o��Q���u�ɂ���Ƃ���Saarto ��19�j�̌n���I���r���[�ł́C�u�����x�̒��Ɍ��ʁv��L���Ƃ���`�����ꍇ��NNT ��3.1 �ł���C���Ò��~��NNH ��16�C�d�ĂłȂ�����p��NNH ��9.6 �ł������iⅡ-3-3 ���ɕ⏕���̍��Q�Ɓj�B
Lunn ��21�j�̔҂ɑ���f�����L�Z�`���̌n���I���r���[�ł́C�f�����L�Z�`��60 mg �̓��^�œ��A�a���_�o��Q��NNT ��6�C���ۋؒɏǂ�NNT ��8 �ŁC����p�͗p�ʈˑ����ł��������d�ĂȂ��̂͂Ȃ������B
����Ɋ֘A�����_�o��Q���u�ɂƂ��āC�f�����L�Z�`���̉��w�Ö@�ɂ��_�o��Q���u�ɂɑ�����ʂɂ��Ă�1 ���̖������r������2 ���̊ώ@����������B
Smith ��22�j�̖�����N���X�I�[�o�[��r�����ł́C�p�N���^�L�Z���⑼�̃^�L�T���n��܂܂��̓I�L�T���v���`���ɂ��CTCAE ��Garade 1 �ȏォ��0�`10 ��11 �i�K�X�P�[����4 �ȏ�̖������_�o��Q���u�ɂƐf�f���ꂽ231 ���ΏۂɁC�f�����L�Z�`��30 mg ��1 �T�ԁC����4 �T�Ԃ�60 mg ���^�ƁC�v���Z�{�̌��ʂ��r�����Ƃ���CBrief Pain Inventory�iBPI�j-Short term �ɂ��ɂ݂̕��ϒl�́C�f�����L�Z�`�����^�Q�ł��ቺ�����i1.06 vs 0.34�Cp��0.003�j
Yang ��23�j�́C�咰����ɑ��ăI�L�T���v���`�����܂ލR������Ò��̊���39 ��ɂ����āCCTCAE ��Grade�@1�`3 �̐_�o��Q�ƒɂ݂�L���銳�҂�ΏۂɃf�����L�Z�`��30�`60 mg/����12 �T�ԓ��^�����ۂ̒��Ɍ��ʁkVAS�i0�`10 cm�j�ŕ]�����C���^�O�ɔ�r�����ꍇ��30���ȏ��VAS �̉��P��L���Ɣ��f�l�C�_�o��Q�̒��x�iCTCAE�@ver3.0�j��]�����Ă���B9 ��i23���j�͌p�����^������i4 �Ⴊ�߂܂��C2 �Ⴊ�X���C�s���C1 �Ⴊ�r�A��Q�j�ł��������C12 �T�Ԍp�����^���\�ł�����30 ��̂���19 ��i64���j�ŗL�ӂȒɂ݂̉��P���݂�ꂽ�B
�ώ@������1 ���́C�I�L�T���v���`�����^�ɔ��������_�o��Q���u�ɂɑ���L�����̌����ŁC�I�s�I�C�h�Ƃ̕��p�ł͂Ȃ������B
����
�ȏ���C�҂���т��҂̐_�o��Q���u�ɂł̒m���ƗՏ��o������C����ɂ��_�o��Q���u�ɂ��ɘa����\��������ƍl������B
3 �j�R�s������
���h�J�C���Ȃǂ̍R�s������́C��̐_�o��Q���u�ɂł͌y�x�̒��Ɍ��ʂ����邱�Ƃ��m�F����C����p�Ƃ��Ė��C�C���ӊ��C���S�C�����̂��тꊴ�C������������B�҂̐_�o��Q���u�ɂ���Ƃ���Challapalli ��24�j�̌n���I���r���[�ł́C���ÑO��ł�VAS���̌����̕��ϒl��-11 mm �ł���C����p�̃I�b�Y���4.2�i32�� vs 12���G�߂܂������h�J�C����30���C���L�V���`��16���C���S�����L�V���`����17���j�ł������iⅡ-4-3 ���ɕ⏕���̍��Q�Ɓj�B
����C����ɂ��_�o��Q���u�ɂւ̗L�����Ɋւ���Տ������Ƃ��ẮC�������r������3 ���C�O���r������2 ������B
Ellemann ��25�j�ɂ�閳�����r�����ł́C10 ��̂���ɂ��_�o��Q�u�ɂ̂��銳�҂�ΏۂɁC5 mg/kg �̃��h�J�C���ƃv���Z�{��30 ���Ԃœ��^���邱�Ƃ�1 �T�Ԍp���������ʂ��r�����Ƃ���C�L�����i�ɂ݂�VAS ��15 mm �ȏ�̌����ƒ�`�j�́C���h�J�C���Q��20���i2 ��j�C�v���Z�{��30���i3 ��j�ł���C���h�J�C���̓v���Z�{���L���ł���Ƃ͂����Ȃ������B
Bruera ��26�j�ɂ�閳�����r�����ł́C�I�s�I�C�h�ɂ����Ɍ��ʂ��s�\���Ȃ���ɂ��_�o��Q���u�ɂ̂��銳��10 ���ΏۂɁC5 mg/kg �̃��h�J�C���ƃv���Z�{��30 ���P�^���r�����Ƃ���C�ɂ݂�VAS ��2 ����܂ŗL�Ӎ��͂Ȃ������B�d�Ăȕ���p���ώ@����Ȃ������B
Sharma ��27�j�ɂ�閳�����r�����ł́C�I�s�I�C�h�ɂ����Ɍ��ʂ��\���łȂ������u�ɂ̂��銳��50 ��i�������u��52���C�N�Q��e���u��30���C�_�o��Q���u��18���j��ΏۂɁC���h�J�C��4 mg/kg�i2 mg/kg �{�[���X��2 mg/kg ��1 ���Ԃ����ē��^�j�ƃv���Z�{���r�����Ƃ���C�ɂ݂�NRS �̓��h�J�C�����^��ɗL�ӂɌ������i���^�O8.5�C8.7 ����C���ꂼ��^��6.3 vs 2.3�Cp��0.0001�j�C50���ȏ�ɂ݂̉��P�̎��o���݂�ꂽ�̂́C���h�J�C���Q82���ɑ��v���Z�{�Q16���ł������ip��0.0001�j�B��������NRS �l�̔������Ăё������鎞�Ԃ̓��h�J�C���Q��9.3 ���ɑ��C�v���Z�{�Q��3.8 ���ł������B���h�J�C���Q�̕���p�Ƃ��Č����͂̊��o�ቺ�i14���j�C����i8���j���v���Z�{�Q��葽���ώ@���ꂽ�B
���̑��ɁC�t���J�C�j�h100�`200 mg �̌��ʂ��݂�von Gunten ��28�j�ɂ��O���r�����ł́CNRS �ōő�̒ɂ݂̋�����3 �_�ȏ�C���邢��50���ȏ�̒��x���������邱�Ƃ�L���ƒ�`����ƁC30���̊��҂ŗL���ł������B����p�͌y�x�̔����������ǂ��ώ@���ꂽ�B
����
�ȏ���C�R�s������ɂ��ẮC����ɂ��_�o��Q���u�ɂɑ��ėL���ł���Ƃ�����̂ƌ��ʂ��Ȃ��Ƃ�����̂Ƃ�����C�L�����͖��炩�ł͂Ȃ��B�҂̐_�o��Q���u�ɂł̒m������C�R�s������͂���ɂ��_�o��Q���u�ɂ��ɘa����\��������B
���FVAS�ivisual analogue scale�j
100 mm �̐��̍��[���u�ɂ݂Ȃ��v�C�E�[���u�ň��̒ɂ݁v�Ƃ����ꍇ�C���҂̒ɂ݂̒��x��\���Ƃ���Ɉ��t���Ă��炤���́B�Q���B
4 �jNMDA ��e�̝h�R��
NMDA ��e�̝h�R��ɂ́C�P�^�~���C�A�}���^�W���C�f�L�X�g�����g���t�@���C�C�t�F���v���W���Ȃǂ�����B���̂����C�P�^�~���ɂ́C����ɂ��_�o��Q���u�ɂɂ��ėL���Ȃ�����x�̍�����������Ă������i�Տ��^��18 �Q�Ɓj�C�ے�I�Ȗ������r���������\���ꂽ�B
Hardy ��29�j�́C�P�^�~�����R���g���[������Ă��Ȃ������u�ɂ̂��銳��185 ��ɃI�s�I�C�h��W���I�⏕�Ö@�ƕ��p�����ꍇ�̒��Ɍ��ʂ��v���Z�{�Ɣ�r�����B���ʂƂ��āC�Տ��I�ɗL�ӂƍl��������Ɍ��ʁi���ϓIBPI ��2 �ȏ�̒ቺ�Ń��X�L���[��̎g�p��4 ���j���������̂̓v���Z�{�Q27���ɑ��ăP�^�~���Q31���ō����Ȃ��ip��0.55�j�i���ς�BPI �̓v���Z�{�Q3.49�C�P�^�~���Q3.11�Cp��0.15�j�C����p�̔����䗦�i�v���Z�{�Q�ɔ�r���ăP�^�~���Q��1.95�Cp��0.001�j�Əd�Ǔx�������i�I�b�Y��F1.09�Cp��0.039�j�CNNT ��25�CNNH ��6 �ł���C����͒ɂ݂�N�Q��e���u�ɂƐ_�o��Q���u�ɂɕ��ނ��Č������s���Ă������ł������B
����
�ȏ���NMDA ��e�̝h�R��́C���Ƃɑ��k���C���҂Ɍ��ʂƕ���p���\���ɐ������������ŁC�g�p����������B
5 �j�R���`�R�X�e���C�h
�R���`�R�X�e���C�h���_�o��Q���u�ɂɂ��ėL���ł��邱�Ƃ��������̍����Տ������͂Ȃ��B�Ґ������nj�Q�ȂǁC�_�o�ւ̈����≊�ǂɂ��ɂ݂̏ꍇ�ɗL���ł��邱�Ƃ��o���I�Ɏ�������Ă����i�Տ��^��19 �Q�Ɓj�B
����
�ȏ���C����ɂ��_�o��Q���u�ɂɑ��āC�v���K�o�����ƃK�o�y���`���͂��҂�ΏۂƂ����Տ������ɂ�蒆���x�̒��Ɍ��ʂ����邱�Ƃ���������Ă���B�K�o�y���`���ȊO�̍R��������C�R����C�R�s������C�P�^�~���ȊO��NMDA ��e�̝h�R��C�R���`�R�X�e���C�h�Ɋւ��ẮC�\���Ȓm�����Ȃ����C�҂ł̒m����Տ��o������C����ɂ��_�o��Q���u�ɂ��ɘa����\��������ƍl������B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C����ɂ��_�o��Q���u�ɂɑ��āC�R��������C�R����C�R�s������CNMDA ��e�̝h�R��C�R���`�R�X�e���C�h�̂��������ꂩ���g�p���邱�Ƃ𐄏�����B
�ǂ̖����̖ɔ�r���Ē��Ɍ��ʂ��D���Ƃ����\���ȍ����͂Ȃ����߁C�̑I���́C�̕���p�C����сC�ɂ݂��Ă���a�Ԃ���I������B���Ȃ킿�C����p���܂ޖ̌��ʂ��C���҂ɂƂ��čD�܂������̂�D�悵�đI������B�Ⴆ�C�s��������ꍇ�ɂ͒��Í�p�̂�����̂�D�悷��C�֔邪����ꍇ�ɂ͍R�R������p�̏��Ȃ����̂�D�悷���iⅡ-4-3 ���ɕ⏕���̍��Q�Ɓj�B
�a�ԂƂ��ẮC�R���`�R�X�e���C�h�́C�Ґ������nj�Q�Ȃǐ_�o�ւ̈����≊�ǂɂ��ɂ݂̏ꍇ�Ɍ��������i�Տ��^��19 �Q�Ɓj�B
������̖����ʂŊJ�n���āC���C�Ȃǂ̕���p���o�Ȃ��͈͂ŁC3�`5 �����ɑ��ʂ���B���ʂ̏����Ƃ��āC①�ɂ݂�������x�ɘa���Ă���C���ʂɂ����Ɍ��ʂ�������ƍl������C②���e�ł���͈͂̕���p�ł���C③�g�p�ʂ���ʓI�ȗp�ʂ̏���ɒB���Ă��Ȃ����Ƃ�ڈ��Ƃ���B
►�Տ��^��45
����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC������ɕ⏕��ʂ��Ă����ʂ��Ȃ��ꍇ�C���̒��ɕ⏕��ւ̕ύX�╹�p�́C�s��Ȃ����Ƃɔ�r���Ēɂ݂��ɘa���邩�H
����
������ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC������ɕ⏕��ʂ��Ă����ʂ��Ȃ��ꍇ�C���̒��ɕ⏕�����ւ̕ύX�╹�p���ɂ݂��ɘa���邩�ɂ��ď\���ȍ������Ȃ��B
����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC������ɕ⏕��ʂ��Ă����ʂ��Ȃ��ꍇ�C���Ƃɑ��k���������ŁC���̒��ɕ⏕��ւ̕ύX�╹�p���s���B
�����ɕ⏕��
�傽���p�ɂ͒��ɍ�p��L���Ȃ����C���ɖ�ƕ��p���邱�Ƃɂ����Ɍ��ʂ����߁C����̏��Œ��Ɍ��ʂ������i�R����C�R��������CNMDA ��e�̝h�R��Ȃǁj�B��I�s�I�C�h���ɖ��I�s�I�C�h�����ł͒ɂ݂��y���ł��Ȃ��ꍇ�ɑI�������B�Q���B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��āC�ώ@������2 ������B
Matsuoka ��30�j�ɂ��O���r�����ł́C�����u�Ɋw��̐_�o��Q���u�ɐf�f��ɍ��v����ɂ݂�L����15 ��i�j��9 ��j�̂��ҁi�咰����6 ��C������5 ��C�x����3 ��C�s��1 ��j�ŁC�v���K�o�����������܂��͌��ʂ����邪����p�̂��߂ɏ\���ȑ��ʂ�����ł��������҂�ΏۂɁC�f�����L�Z�`��20�`40 mg/���p���^�����ۂ̒��Ɍ��ʂƕ���p��]�������B���̌��ʁC7 ��ŗՏ��I�ɗL�p�ƍl������NRS ��33���ȏ�̉��P���݂�ꂽ�B�܂��C4 ��ŗL�ӂȕ���p�̉��P��F�߂��B
Arai ��31�j�ɂ��p�C���b�g�X�^�f�B�ł́C�I�s�I�C�h�ɂ����Ɍ��ʂ��\���łȂ�����ɂ��_�o��Q���u�ɂ̂��邪��52 ���ΏۂƂ��C�K�o�y���`��400mg/���ƃC�~�v���~��20 mg/���̕��p�́C�K�o�y���`��400 mg/���܂���800 mg/������уC�~�v���~��20 mg/���̒P�Ɠ��^�ɔ�r����NRS �����̌Q���2 �ȏ�L�Ӎ��������Ēቺ���C�܂�����p�ɂ͍����Ȃ������B
����܂߂��_�o��Q���u�ɂɑ��č�p�@���̈قȂ�2 ��ވȏ�̖�܂p���邱�ƂɊւ��āC1 ���̌n���I���r���[������BChaparro32�j��̌n���I���r���[�ł́C2 �̖�܂̕��p�ɂ��ɂ݂��y�����邪�C�ǂ̂悤�ȑg�ݍ��킹�����ʓI�ŕ���p�̓_�ŗD��Ă��邩�ɂ��Ă͂���Ȃ錟�����K�v�ł���Ƃ��Ă���B�Ⴆ�CGilron ��33�j�ɂ�閳�����r�����ł́C��̐_�o��Q���u�ɂ̂��銳��56 ���ΏۂɁC�m���g���v�`�����P�ƁC�K�o�y���`���P�ƁC����܂̕��p���^�̌��ʂ��r�����Ƃ���C���p�Q�ŗL�ӂɒ��Ɍ��ʂ�����ꂽ�B�܂��C������̌Q�ł��d�Ăȕ���p�݂͂��Ȃ������B
����
�ȏ���C����ɂ��_�o��Q���u�ɂ̂��銳�҂ɑ��āC���ɕ⏕��ʂ��Ă��\���Ɍ��ʂ��Ȃ��ꍇ�ɁC���Ƃɑ��k���������ō�p�@���̈قȂ鑼�̒��ɕ⏕��p���邱�Ƃ𐄏�����B���p�ɍۂ��Ă͕���p�ɏ\�����ӂ��C�K�v�ł���ΐ�s������ɕ⏕��̌��ʂ��s���������ł̕��p���l������B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�I�s�I�C�h�ɕ����I�ɂ����������Ȃ��_�o��Q���u�ɂɑ��ăA�~�g���v�`�������K�o�y���`���p���邱�Ƃ𐄏����Ă���B�������C�I�s�I�C�h�Ƃ����̒��ɕ⏕��̕��p�͂�苭�������_�o�n�̕���p��悷�邱�Ƃ�����̂ŁC���Ӑ[���^�C�g���[�V��������ɕ⏕���łȂ��I�s�I�C�h�ɑ��Ă��s���ׂ��ł���C�ƋL�ڂ��Ă���B
EAPC �̃K�C�h���C���i2001a�j�ł́C�Ґ������nj�Q�ɑ��ẮC�R���`�R�X�e���C�h�C���ː����ÁC���w�Ö@���������邱�Ƃ𐄏����Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�R�����/�܂��͍R�����������I���Ƃ��C����p�����e�ł����ʂ�������܂ŁC��p���^�ʂ͈͓̔��i�O�n�R����50�`150 mg/���C�f�����L�Z�`��60�`120 mg/���C�R��������v���K�o������300�`600 mg/���C�K�o�y���`��900�`3,600 mg/���j�ő��ʂ��邱�Ƃ𐄏����Ă���B�Ґ������nj�Q���^����ꍇ�ɂ́C�v���ɐ��Ƃ֏Љ�邱�ƂƁC�R���`�R�X�e���C�h�𓊗^���邱�Ƃ𐄏����Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C����p�ɗ��ӂ��I�s�I�C�h�ƒ�p�ʂ̍R����C�܂��͍R��������̕��p�𐄏����Ă���B�_�o�ւ̈����ɂ��ɂ݂̏ꍇ�̓R���`�R�X�e���C�h�̎g�p�𐄏����Ă���B
ACCP �̃K�C�h���C���i2007�j�ł́C���ɕ⏕��i�O�n�R����C�R��������j���g�p���C�����ȏꍇ�͐��Ƃ֑��k���邱�Ƃ𐄏����Ă���B�V�������������w���ɂɑ��ẮCMRI �ŐҐ������nj�Q�̗L�������C���ː����ÉȁC�Ґ��O�ȂȂǂ̐��Ƃv���ɑ��k���邱�Ƃ𐄏����Ă���B
���{�y�C���N���j�b�N�w��̔��ɂ��u�_�o��Q���u�ɖÖ@�K�C�h���C���v�i2011�j�ɂ����ẮC�O�n�R����i���ɑ�A�~��TCA�F�m���g���v�`�����C���邢�̓A�~�g���v�`�����C�C�~�v���~���j�C�K�o�y���`���܂��̓v���K�o�����Ƃ�����Ca2�{�`���l����2���K���h���g�p���邱�Ƃ𐄏����Ă���B������P�Ƃ������͕��p���Ă��\���Ȍ��ʂ������Ȃ��ꍇ�ɑ��I���ł���SNRI�i�f�����L�Z�`���j�C���N�V�j�A�E�C���X�ڎ�Ɠe���ǔ畆���o�t�ܗL���܁C���L�V���`���C����ё�O�I���ł��閃���ɖ���������邩�C�ɂݎ��Â̐��ƂɏЉ�邱�Ƃ𐄏����Ă���B
�i����ߎq�C�y���u�Y�C�k�����\���j
�y�� ���z
�Տ��^��43
1�j Grond S, Radbruch L, Meuser T, et al. Assessment and treatment of neuropathic cancer pain following WHO guidelines. Pain 1999�G79�F15-20
2�j Mercadante S. Pain treatment and outcomes for patients with advanced cancer who receive follow-up care at home. Cancer 1999�G85�F1849-58
3�j Caraceni A, Zecca E, Bonezzi C, et al. Gabapentin for neuropathic cancer pain�Fa randomized controlled trial from the Gabapentin Cancer Pain Study Group. J Clin Oncol 2004�G22�F2909-17
4�j Mercadante S, Gebbia V, David F, et al. Tools for identifying cancer pain of predominantly neuropathic origin and opioid responsiveness in cancer patients. J Pain 2009�G10�F594-600
5�j Eisenberg E, Mcnicol E, Carr DB. Opioid for neuropathic pain. Cochrane Database Syst Rev 2006�i3�j�FCD006146
�Տ��^��44
6�j Bennett MI. Effectiveness of antiepileptic or antidepressant drugs when added to opioids for cancer pain�Fsystematic review. Palliat Med 2011�G25�F553-9
7�j Mishra S, Bhatnagar S, Goyal GN, et al. A comparative efficacy of amitriptyline, gabapentin, and pregabalin in neuropathic cancer pain�Fa prospective randomized double-blind placebo-controlled study. Am J Hosp Palliat Care 2012�G29�F177-82
8�j Moore RA, Straube S, Wiffen PJ, et al. Pregabalin for acute and chronic pain in adults. Cochrane Database Syst Rev 2009�i3�j�FCD007076
9�j Wiffen PJ, McQuay HJ, Edwards J, et al. WITHDRAWN�FGabapentin for acute and chronic pain. Cochrane Database Syst Rev 2011�i3�j�FCD005452
10�j Caraceni A, Zecca E, Bonezzi C, et al. Gabapentin for neuropathic cancer pain�Fa randomized controlled trial from the Gabapentin Cancer Pain Study Group. J Clin Oncol 2004�G22�F2909-17
11�j Keskinbora K, Pekel AF, Aydinli I, et al. Gabapentin and an opioid combimation versus opioid alone for the management of neuropathic cancer pain�Fa randomized open trial. J Pain Symptom Manage 2007�G34�F183-9
12�j Caraceni A, Zecca E, Martini C, et al. Gabapentin as an adjuvant to opioid analgesia for neuropathic cancer pain. J Pain Symptom Manage 1999�G17�F441-5
13�j Ross JR, Goller K, Hardy J, et al. Gabapentin is effective in the treatment of cancer-related neuropathic pain�Fa prospective, open-label study. J Palliat Med 2005�G8�F1118-26
14�j Takahashi H, Shimoyama N. A prospective open-label trial of gabapentin as an adjuvant analgesic with opioids for Japanese patients with neuropathic cancer pain. Int J Clin Oncol 2010�G15�F46-51
15�j Finnerup NB, Otto M, McQuay HJ, et al. Algorithm for neuropathic pain treatment�Fan evedence based proposal. Pain 2005�G118�F289-305
16�j Yajnik S, Singh GP, Singh G, et al. Phenytoin as a coanalgesic in cancer pain. J Pain Symptom Manage 1992�G7�F209-13
17�j Hardy JR, Rees EA, Gwilliam B, et al. A phase Ⅱ study to establish the efficacy and toxicity of sodium valproate in patients with cancer-related neuropathic pain. J Pain Symptom Manage 2001�G21�F204-9
18�j Hugel H, Ellershaw JE, Dickman A. Clonazepam as an adjuvant analgesic in patients with cancer-related neuropathic pain. J Pain Symptom Manage 2003�G26�F1073-4
19�j Saarto T, Wiffen PJ. Antidepressants for neuropathic pain. Cochrane Database Syst Rev 2007�i4�j�FCD005454
20�j Mercadante S, Arcuri E, Tirelli W. Amitriptyline in neuropathic cancer pain in patients on morphine therapy�Fa randomized placebo-controlled, double-blind crossover study. Tumori 2002�G88�F239-42
21�j Lunn MP, Hughes RA, Wiffen PJ. Duloxetine for treating painful neuropathy or chronic pain. Cochrane Database Syst Rev 2009�G�i4�j�FCD007115
22�j Smith EM, Pang H, Cirrincione C, et al�GAlliance for Clinical Trials in Oncology. Effect of duloxetine on pain, function, and quality of life among patients with chemotherapy-induced painful peripheral neuropathy�Fa randomized clinical trial. JAMA 2013�G309�F1359-67
23�j Yang YH, Lin JK, Chen WS, et al. Duloxetine improves oxaliplatin-induced neuropathy in patients with colorectal cancer�Fan open-label pilot study. Support Care Cancer 2012�G20�F1491-7
24�j Challapalli V, Tremont-Lukats IW, McNicol ED, et al. Systemic administration of local anesthetic agents to neuropathic relieve pain. Cochrane Database Syst Rev 2005�G4
25�j Ellemann K, Sjogren P, Banning AM, et al. Trial of intravenous lidocaine on painful neuropathy in cancer patients. Clin J Pain 1989�G5�F291-4
26�j Bruera E, Ripamonti C, Brenneis C, et al. A randomized double-blind crossover trial of intravenous lidocaine in the treatment of neuropathic cancer pain. J Pain Symptom Manage 1992�G7�F138-40
27�j Sharma S, Rajagopal MR, Palat G, et al. A phase Ⅱ pilot study to evaluate use of intravenous lidocaine for opioid-refractory pain in cancer patients. J Pain Symptom Manage 2009�G37�F85-93
28�j von Gunten CF, Eappen S, Cleary JF, et al. Flecainide for the treatment of chronic neuropathic pain�Fa Phase �U trial. Palliat Med 2007�G21�F667-72
29�j Hardy J, Quinn S, Fazekas B, et al. Randomized, double-blind, placebo-controlled study to assess the efficacy and toxicity of subcutaneous ketamine in the management of cancer pain. J Clin Oncol 2012�G30�F3611-7
�Տ��^��45
30�j Matsuoka H, Makimura C, Koyama A, et al. Pilot study of duloxetine for cancer patients with neuropathic pain non-responsive to pregabalin. Anticancer Res 2012�G32�F1805-9
31�j Arai YC, Matsubara T, Shimo K, et al. Low-dose gabapentin as useful adjuvant to opioids for neuropathic cancer pain when combined with low-dose imipramine. J Anesth 2010�G24�F407-10
32�j Chaparro LE, Wiffen PJ, Moore RA, et al. Combination pharmacotherapy for the treatment of neuropathic pain in adults. Cochrane Database Syst Rev 2012�G7�FCD008943
33�j Gilron I, Bailey JM, Tu D, et al. Nortriptyline and gabapentin, alone and in combination for neuropathic pain�Fa double�\blind, randomised controlled crossover trial. Lancet 2009�G374�i9697�j�F1252�\61
�Q
���]�ڂɂ��ɂ�
�� ���]�ڂɂ��ɂ݂ɑ���L���Ȏ��Â͉����H
�֘A����Տ��^��
- ►46���]�ڂɂ��ɂ݂̂��邪�҂ɑ��āC�s���ׂ��]���͉����H
- ►47���]�ڂɂ��ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►48���]�ڂɂ��ɂ݂̂��邪�҂ɑ��āC�r�X�z�X�z�l�[�g�C�f�m�X�}�u�Ȃǂ�bone-modifying agents�iBMA�j�́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
- ►46�ɂ݂̌����̕]���ƒɂ݂̕]�����s���B
- ►47���]�ڂɂ��ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���iⅢ-1 ���ʂ����u�Ɏ����̍��Q�Ɓj
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►48���]�ڂɂ��ɂ݂̂��邪�҂ɑ��āC�\������鐶���\����������������Œ��Ɍ��ʂ�ړI�Ƃ���BMA �𓊗^����B
2B�i�ア�����C�Ⴂ�G�r�f���X���x���j
►�Տ��^��46
���]�ڂɂ��ɂ݂̂��邪�҂ɑ��āC�s���ׂ��]���͉����H
����
�ɂ݂̌����̕]���ƒɂ݂̕]�����s���iⅡ-2 �ɂ݂̕�I�]���̍��Q�Ɓj�B
���
1 �j�ɂ݂̌�����g�̏�����摜��������]������
�ɂ݂̌����Ƃ��āC����ɂ��ɂ݈ȊO�̉\�����܂߂ĕ]������B���]�ڂł���C�a�ς̕��ʁC�i�W�͈́i���͂̐_�o�C���ǁC�ؓ��Ƃ̊W�j�C�P���������������Ȃǂ̕]�����K�v�ł���B�摜�����͒P��X ���ʐ^����{�ƂȂ邪�C�Ғłł����MRI�C���Ս��ł����CT ��lj����邱�Ƃł��ڍׂȕ]�������҂ł���B����ɁC���V���`�O���t�B�������邱�Ƃɂ�萳�m�Ȑf�f���\�ƂȂ�C�S�g�̑����]�ڂ̗L�����m�F�ł���B���]�ڂɂ�鍜�܂͊��҂̐g�̋@�\��QOL ������Q���邱�ƂɂȂ邽�߁C���܂��邢�͐ؔ����܂̗L����]������B���ɁC�d�̂������ڍ��C�P�W�C�����C�ő́C��r���Ȃǂւ̓]�ڂ̏ꍇ�ɂ́C�O�Ȏ��Â���������B���]�ڂ𐳊m�ɕ]�����邱�Ƃ́C��Ö@�ł�����ː����ÁC���ː����ʌ��f�iSr�j�C�o��I�ő̌`���p�C�_�o�u���b�N��1�Ȃǂ̓K������������ۂɕK�v�ł����iⅡ-8 �Ö@�ȊO�̒ɂݎ��Ö@�̍��Q�Ɓj�B
2 �j�ɂ݂̕]�����s��
�ɂ݂̓��퐶���ւ̉e���C�ɂ݂̃p�^�[���i�����ɂ��ˏo����2���j�C�ɂ݂̋����C�ɂ݂̕��ʁC�ɂ݂̌o�߁C�ɂ݂̐���i�_�o��Q���u�ɂ̍��݂Ȃǁj�C�ɂ݂̑������q�ƌy�����q�C���ݍs���Ă��鎡�Â̔����C����сC���X�L���[��̌��ʂƕ���p�ɂ��ĕ]������B
���ɒɂ݂������ɂȂ̂��ˏo�ɂȂ̂��]�����C�_�o��Q���u�ɂ̗v�f�����邩��]������B����ɑ������q�E�y�����q��]������B����ɂ�萶���̎d���C�R���Z�b�g���Ȃǂ̕⏕����g���ȂǁC���҂̋�ɂ�������v��������C�y��������v�����Ɏ�����邱�Ƃ��ł���B
��1�F�_�o�u���b�N
�Ǐ��������_�o�j���C�M�Ȃǂɂ��_�o�̓`�B�@�\���ꎞ�I�E�i�v�I�ɎՒf���邱�Ƃɂ���āC�܂��́C�I�s�I�C�h�Ȃǒ��ɖ�̍d���O�o�E�N�������o�ւ̓��^�ɂ���Ē��Ɍ��ʂ��i�B
�i���߁j���`�̐_�o�u���b�N�͈�ʓI�ɑO�҂������C��҂Ƃ��킹�����̂��ȓI���Ɂianesthesiological procedure�j�ƌĂԂ��Ƃ����邪�C�{�K�C�h���C���ł́C�ȕւɁC���������킹�āu�_�o�u���b�N�v�ƌĂԁB
��2�F�ˏo�Ɂibreakthrough pain�j
�����ɂ̗L������x�C���ɖÂ̗L���ɂ�����炸���������ߐ��̒ɂ݂̑����B�Q���B
►�Տ��^��47
���]�ڂɂ��ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
���]�ڂɂ��ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa����B
���]�ڂɂ��ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���B
���
�{�Տ��^��Ɋւ��閳�����r�����C�O���r�����͂Ƃ��ɂȂ����C���]�ڂɂ��ɂ݂��܂ނ����u�ɂɑ���WHO ���������u�Ɏ��Ö@�̗L�p���������������̊ώ@�����������iⅡ-3 WHO ���������u�Ɏ��Ö@�̍��Q�Ɓj�B
����
�ȏ���C���]�ڂɂ��ɂ݂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â͗L���ł���ƍl������B
���������āC�{�K�C�h���C���ł́C���]�ڂɂ��ɂ݂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s�����Ƃ𐄏�����B
►�Տ��^��48
���]�ڂɂ��ɂ݂̂��邪�҂ɑ��āC�r�X�z�X�z�l�[�g�C�f�m�X�}�u�Ȃǂ�bone-modifying agents�iBMA�j�̓v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
���]�ڂɂ��ɂ݂̂��邪�҂ɑ��āCBMA �͓��^��4�`12 �T�ł͒��Ɍ��ʂ�����B���^��4 �T�ȓ��ł͒��Ɍ��ʂ�����Ƃ��������͂Ȃ��B
���]�ڂɂ��ɂ݂̂��邪�҂ɑ��āC�\������鐶���\����������������Œ��Ɍ��ʂ�ړI�Ƃ���BMA �𓊗^����B
���
1 �j�r�X�z�X�z�l�[�g
�{�Տ��^��Ɋւ���r�X�z�X�z�l�[�g�ɂ��Ă̗Տ������Ƃ��ẮC�������r����30 �����܂ތn���I���r���[������iPetcu ��1�j�j�B
�i1�j���^��4�`12 �T�̌���
�r�X�z�X�z�l�[�g���^��4 �T����12 �T�ł̗L�����ɂ��Ă�8 ���Ō�������Ă���B�L���̒�`�́C���ꂼ��̌����ŁC①6 �_�̃X�R�A�����ɂ����āC2 ��ȏ�A������1 �_�ȏ㌸�����邢��1 ��̑����2 �_�ȏ㌸���C② 0�`5 �i�K�̃X�R�A�����ɂ����āC2 ��ȏ�A�����ăX�R�A��20���ȏ㌸���C③���ɂɂȂ����ꍇ�ȂǂƈقȂ��Ă���B�����������̒�`�̂܂܁u�L���v�Ƃ����ꍇ�C4 �T�ɂ����ėL���ł��������Ґ��́C�r�X�z�X�z�l�[�g���ÌQ214 �ᒆ40 ��i18���j�C�ΏƌQ194 �ᒆ18 ��i9���j�ŁCNNT 11�i95���M����ԁF6�`36�j�ł������B����C12 �T�ɂ����ẮC�r�X�z�X�z�l�[�g���ÌQ317 �ᒆ103 ��i32���j�C�ΏƌQ317 �ᒆ55 ��i17���j�ŁCNNT ��7�i95���M����ԁF5�`12�j�ł������B����p�́C���ÌQ��16���C�ΏƌQ��15���Ɉ��S�E�q�f��F�߂����L�Ӎ��͂Ȃ������B����p�ɂ�鎡�Ò��~�́C���ÌQ��6���C�ΏƌQ��0.6���ɐ����C���Ò��~��v����悤�ȗL�Q���ۂɊւ���NNH ��16�i95���M����ԁF12�`27�j�ł������B
�i2�j���^��4 �T�ȓ��̌���
���^��4 �T�ȓ��̒��Ɍ��ʂɊւ���Տ������Ƃ��ẮC�������r�����C�O���r�����͂Ȃ��C�p�~�h�����_���^��6 ���ڂɒ��Ɍ��ʂ��Ƃ����Ǘ��������x�ł���iEugen ��j�B
2 �j�f�m�X�}�u
�{�Տ��^��Ɋւ���f�m�X�}�u�ɂ��Ă̗Տ������Ƃ��ẮC�v���Z�{��ΏƂƂ����������r�����͂Ȃ����C�r�X�z�X�z�l�[�g�ł���]���h�����_��ΏƂƂ���3 ���̖������r�������܂ތn���I���r���[������B
Peddi ��2�j�ɂ��n���I���r���[�ł́C������ƑO���B����т��̑��̂�����ΏۂƂ���3 ���̖������r�������ʂɂ��Č������Ă���iStopeck ��3�j�CFizazi ��4�j�CHenry ��5�j�j�B
3 ���̗Տ������ł́C�u�ɕ]����0�i�x��Ȃ��j����10�i�ő�̎x��j�i�K�ŕ]������Brief Pain Inventory�iBPI�j��p���āC4 �i�K�ȏ�̈������u�ɑ����C2 �i�K�ȏ�̌������u�Ɍy���ƒ�`���Ă���B���̌��ʁC�f�m�X�}�u�𓊗^�������҂ł��u�ɑ����܂ł̊��ԁi5.5�`9.7 �J���j�́C�]���h�����_�𓊗^�������҂ł��u�ɑ����܂ł̊��ԁi4.7�`5.7 �J���j�Ɣ�r�����u�ɑ����܂ł̊��Ԃ��������C�n�U�[�h���0.8�i95���M����ԁF0.8�`0.9�j�ł������B����C�u�Ɍy���܂ł̒����l�ɂ��ẮC���Q�ԂŗL�Ӎ���F�߂Ȃ������B
����
�ȏ���C���]�ڂɂ��ɂ݂̂��邪�҂ɂ����āC�r�X�z�X�z�l�[�g�C�f�m�X�}�u�Ȃǂ�bone-modifying agents�iBMA�j�͓��^��4�`12 �T�ł͒����x�̒��Ɍ��ʂ����邪�C���^��4 �T�ȓ��ɒ��Ɍ��ʂ�����Ƃ��������͂Ȃ��B�܂��C�����͌��ݒɂ݂̂��銳�҂ɑ��Ă̒��Ɍ��ʂ̖ړI�ŗp����ꂽ���̂ł͂Ȃ��B
���������āC�{�K�C�h���C���ł́C���]�ڂɂ��ɂ݂ɑ��āC�\������鐶���\����������������Œ��ɂ�ړI�Ƃ���BMA �𓊗^���邱�Ƃ𐄏�����B���Ȃ킿�C���^��4�`12 �T�̒��Ɍ��ʂ����҂���ꍇ�ɂ͓��^���s���B����C���^��4 �T�ȓ��̒��Ɍ��ʂɊւ���G�r�f���X�͊m������Ă��Ȃ����߁C�u���݂̒ɂ݁v���ɘa���邽�߂ɂ�BMA �ȊO���u�Ɏ��Â��\���ɍs�����Ƃ��K�v�ł���B
�����̃K�C�h���C���Ƃ̐�����
NCCN �̃K�C�h���C���i2012�j�ł́CNSAIDs �͐Ґ������̂Ȃ����]�ڂɂ��ɂ݂ɑ��Đ�������Ă���CBMA�C�R���`�R�X�e���C�h�͑��������]�ڂɂ��ɂ݂ɑ��Đ�������Ă���B
ESMO �̃K�C�h���C���i2012�j�ł́C�r�X�z�X�z�l�[�g�͒ʏ�̒��Ɏ��Âɑ�ւ�����̂ł͂Ȃ����C���]�ڂɂ��ɂ݂ɑ��ėL���ȍ���������Ƃ��Ă���B
�i�n粍h�́C���@�ށj
�y�� ���z
1�j Wong R, Wiffen PJ. Bisphosphonates for the relief of pain secondary to bone metastases. Cochrane Database Syst Rev 2002�i2�j�FCD002068
2�j Peddi P, Lopez-Olivo MA, Pratt GF, et al. Denosumab in patients with cancer and skeletal metastases�Fa systematic review and meta-analysis. Cancer Treat Rev 2013�G39�F97-104
3�j Stopeck AT, Lipton A, Body JJ, et al. Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer�Fa randomized, double-blind study. J Clin Oncol 2010�G28�i35�j�F5132-9
4�j Fizazi K, Carducci M, Smith M, et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer�Fa randomised, double-blind study. Lancet 2011�G377�i9768�j�F813-22
5�j Henry DH, Costa L, Goldwasser F, et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastases in patients with advanced cancer�iexcluding breast and prostate cancer�jor multiple myeloma. J Clin Oncol 2011�G29�F1125-32
�y�Q�l�����z
6�j Petcu EB, Schug SA, Smith H. Clinical evaluation of onset of analgesia using intravenous pamidronate in metastatic bone pain. J Pain Symptom Manage 2002�G24�F281-4
7�j Yuen KK, Shelley M, Sze WM, et al. Bisphosphonates for advanced prostate cancer. Cochrane Database Syst Rev 2006�i4�j�FCD006250
8�j Wong MH, Stockler MR, Pavlakis N. Bisphosphonates and other bone agents for breast cancer. Cochrane Database Syst Rev 2012�GCD003474
9�j Mhaskar R, Redzepovic J, Wheatley K, et al. Bisphosphonates in multiple myeloma�Fa network meta-analysis. Cochrane Database Syst Rev 2012�GCD003188
�R
�X������Ȃǂɂ��㕠���̒ɂ�
�� �X������Ȃǂɂ��㕠���̒ɂ݂ɑ���L���Ȏ��Â͉����H
�֘A����Տ��^��
- ►49�X������Ȃǂɂ��㕠���̒ɂ݂̂��銳�҂ɑ��āC�s���ׂ��]���͉����H
- ►50�X������Ȃǂɂ��㕠���̒ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►51�X������Ȃǂɂ��㕠���̒ɂ݂̂��銳�҂ɑ��āC�_�o�u���b�N�́C�Ö@�ɔ�r���Ēɂ݂��ɘa���邩�H
����
- ►49�ɂ݂̌����̕]���ƒɂ݂̕]�����s���B
- ►50�X������Ȃǂɂ��㕠���̒ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���iⅢ-1 ���ʂ����u�Ɏ����̍��Q�Ɓj�B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►51�X������Ȃǂɂ��㕠���̒ɂ݂̂��銳�҂ɑ��āC���o�_�o�p�u���b�N�Ȃǂ̐_�o�u���b�N���s���B
2A�i�ア�����C�����G�r�f���X���x���j
►�Տ��^��49
�X������Ȃǂɂ��㕠���̒ɂ݂̂��銳�҂ɑ��āC�s���ׂ��]���͉����H
����
�ɂ݂̌����̕]���ƒɂ݂̕]�����s���iⅡ-2 �ɂ݂̕�I�]���̍��Q�Ɓj�B
���
1 �j�ɂ݂̌�����g�̏�����摜��������]������
�ɂ݂̌����Ƃ��āC����ɂ��ɂ݈ȊO�̉\�����܂߂ĕ]������B�g�̏����C�摜�����i�P��X ���CCT�CMRI �Ȃǁj����C�����ƂȂ�a�Ԃ̕]�����s���B����ȊO�̌����Ƃ��āC�ݏ\��w����ᇁC�_囊���C�X���Ȃǂ��l������ꍇ�ɂ́C�����̎��Â���������B����ɂ��ɂ݂̏ꍇ�C����ɑ��鎡�Ái���w�Ö@�C���ː����ÂȂǁj�̓K������������B
���o�_�o�p�u���b�N�̎{�s����������ꍇ�ɂ́C���o�_�o�p���͂̎�ᇐZ���̒��x�����ƂȂ�B���Ɍ��ʂ��m���ɓ��邽�߂ɂ́C���o�_�o�p���͂ɓK�x�ȃX�y�[�X�����鎞���ɐ_�o�u���b�N���s�����Ƃ��]�܂������߁CCT �����Ȃǂɂ��C�㕠���o����ᇂ̎��ɂ��[������Ă��Ȃ������m�F����B
2 �j�ɂ݂̕]�����s��
�ɂ݂̓��퐶���ւ̉e���C�ɂ݂̃p�^�[���i�����ɂ��ˏo�ɂ��j�C�ɂ݂̋����C�ɂ݂̕��ʁC�ɂ݂̌o�߁C�ɂ݂̐���C�ɂ݂̑������q�ƌy�����q�C���ݍs���Ă��鎡�Â̔����C����сC���X�L���[��̌��ʂƕ���p�ɂ��ĕ]������B
����ɁC���ɖ�ȊO�̒��Ɏ�i�i�_�o�u���b�N�Ȃǁj�����҂���]���邩�ǂ������m�F����B
►�Տ��^��50
�X������Ȃǂɂ��㕠���̒ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
�X������Ȃǂɂ��㕠���̒ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�ɂ݂��ɘa����B
�X������Ȃǂɂ��㕠���̒ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���B
���
�{�Տ��^��Ɋ֘A�����Տ������Ƃ��āC�X������Ȃǂɂ��㕠���̒ɂ݂Ɍ��肵�Ĕ�I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â̌��ʂ�]�������������r�����C�O���r�����͂Ȃ��B�X������Ȃǂɂ��㕠���̒ɂ݂��܂ނ����u�ɂɑ��āCWHO ���������u�Ɏ��Ö@���L�p�ł��邱�Ƃ������̊ώ@�����Ŏ�������Ă����iⅡ-3 WHO ���������u�Ɏ��Ö@�̍��Q�Ɓj�B
����
�ȏ���C�X������Ȃǂɂ��㕠���̒ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�ɂ݂��ɘa����ƍl������B
���������āC�{�K�C�h���C���ł́C�X������Ȃǂɂ��㕠���̒ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s�����Ƃ𐄏�����B
►�Տ��^��51
�X������Ȃǂɂ��㕠���̒ɂ݂̂��銳�҂ɑ��āC�_�o�u���b�N�́C�Ö@�ɔ�r���Ēɂ݂��ɘa���邩�H
����
�X������Ȃǂɂ��㕠���̒ɂ݂̂��銳�҂ɑ��āC���o�_�o�p�u���b�N�Ȃǂ̐_�o�u���b�N�́C�ɂ݂��ɘa����B
�X������Ȃǂɂ��㕠���̒ɂ݂̂��銳�҂ɑ��āC���o�_�o�p�u���b�N�Ȃǂ̐_�o�u���b�N���s���B
���
�m���o�_�o�p�u���b�N�n�iⅡ-8-2-2-①���o�_�o�p�C�����_�o�u���b�N�̍��Q�Ɓj
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�X������ɂ��ɂ݂ɑ��ĕ��o�_�o�p�u���b�N���ƖÖ@�̒��Ɍ��ʂ��r�����������r����5 �����܂ތn���I���r���[2 ���iYan ��1�j�CArcidiacono ��2�j�j�ƁC�n���I���r���[�̍쐬��ɕ��ꂽ�������r����2 ��������iZhang ��3�j�CWyse ��4�j�j�B
Yan ��1�j�̌n���I���r���[�ł́C�Ώۊ��҂�302 ��Ńu���b�N�O�̒ɂ݂�VAS ��5.0 �ł������B���o�_�o�p�u���b�N�������ҌQ�ł́C�Ö@�������ҌQ�ɔ�r���āC�ɂ݂�VAS �̍��́C2 �T�Ԍ��-0.3�C4 �T�Ԍ��-0.5�C8 �T�Ԍ��-0.6�i�e�Q�̐��l�̋L�ڂȂ��j�ł������B�I�s�I�C�h�̎g�p�ʂ͎��ÑO��30 mg �ł��������C�Ö@�P�Ƃ̏ꍇ�Ɣ�r���āC2 �T�ڂ�-40 mg�C4 �T�ڂ�-54 mg�C8 �T�ڂ�-80 mg �ƁC�g�p�ʂ����Ȃ������B�֔�̔��������Ⴉ�������i�I�b�Y��F0.7�j�C���̑��̕���p�i�ጌ���C���S�E�q�f�C�����C���C�j�ɗL�Ӎ��͔F�߂�ꂸ�C�������ɂ��L�Ӎ��͔F�߂��Ȃ������BQOL �Ɋւ��ẮC���ꂼ��̌����ňقȂ�]�����@��p���Ă������߂ɁC���ʂ��ĕ]���ł��Ȃ������B���҂�͕��o�_�o�p�u���b�N�ɂ͒����x�̒��Ɍ��ʂ�����ƌ��_�����B
�܂��CWyse ��4�j�́C��p�s�\���X������ɑ��āC���������ɃG�R�[�K�C�h���o�_�o�p�u���b�N�𑁊��ɍs�����ƂŁC�ɂ݂̐i�s��}���邱�Ƃ��ł���ƕ��Ă���B
����
�ȏ���C���o�_�o�p�u���b�N�́C�X������Ȃǂɂ��㕠���̒ɂ݂𒆓��x�ɘa����ƂƂ��ɁC�I�s�I�C�h�g�p�ʂ�ቺ�����邱�Ƃɂ��֔���y������\��������ƍl������B���̑����X������Ȃǂɂ��㕠���ɂɑ��ėL���ƍl������_�o�u���b�N�Ƃ��āC�d���O�o�܂��̓N�������o�ւ̃I�s�I�C�h��Ǐ�������̎������^������B
���������āC�{�K�C�h���C���ł́C�X������Ȃǂɂ��㕠���̒ɂ݂ɑ��āC���o�_�o�p�u���b�N�Ȃǂ̐_�o�u���b�N�̓K���ɂ��ĂȂ�ׂ����������ɐ��Ƃɑ��k���邱�Ƃ𐄏�����B
�u�Ȃ�ׂ����������Ɂv�Ƃ������R�́C�ȉ��̂Ƃ���ł���B①���o�_�o�p�u���b�N���L���ɍs���邽�߂ɂ́C���o�_�o�p���͂ɃA���R�[���𒍓����邽�߂̓K�x�ȃX�y�[�X�����鎞���ɍs�����Ƃ��]�܂����C②�u���b�N��Ɉ�ߐ��ɒ�従������i���邽�߁C従��ɂ����ƂȂ钰�ǂ̏Ǐ�������O�Ɏ{�s���邱�Ƃ��]�܂����C③�X������̒ɂ݂̔����@���́C�X�ǂ�Ԏ��̓����㏸�C���Ǔ����̏㏸�Ƌ����C�N�Q��e����h�����邳�܂��܂ȉ��w�����ɂ�閖�����o�_�o�̊���ƍl�����Ă���B���������āC�ɂ݂��ԑ̌����邱�ƂŁC�����C�Ґ��C�����ւƊ��삳��C�ɂ�臒l���ቺ����\������������Ă��邽�߁C�����ɍs���ق������Ɍ��ʂ����҂ł���C④�����̒�����������h�����ʂɒő̓]�ڂ�����ƃu���b�N���u���s�����Ǝ��̂�����ɂȂ�B
���F���o�_�o�p�u���b�N
�_�o�u���b�N�̈�B�݁C�����C�̑��C�_囊�C�_���C�������C�B���C�t���Ȃǂ̏㕠�������ɂɓK���B���u���r���z���ĕ��o�_�o�p�܂Őj��i�ߋǏ��������_�o�j���𒍓�����B�Q���B
�����̃K�C�h���C���Ƃ̐�����
NCCN �ɂ��K�C�h���C���i2012�j�ł́C���o�_�o�p�u���b�N�𐄏����Ă���B
�i�R���h��C��։�q�j
�y�� ���z
1�j Yan BM, Myers RP. Neurolytic celiac plexus block for pain control in unresectable pancreatic cancer. Am J Gastroenterol 2007�G102�F430-8
2�j Arcidiacono PG, Calori G, Carrara S, et al. Celiac plexus block for pancreatic cancer pain in adults. Cochrane Database Syst Rev 2011�i3�j�FCD007519
3�j Zhang CL, Zhang TJ, Guo YN, et al. Effect of neurolytic celiac plexus block guided by computerized tomography on pancreatic cancer pain. Dig Dis Sci 2008�G53�F856-60
4�j Wyse JM, Carone M, Paquin SC, et al. Randomized, double-blind, controlled trial of early endoscopic ultrasound-guided celiac plexus neurolysis to prevent pain progression in patients with newly diagnosed, painful, inoperable pancreatic cancer. J Clin Oncol 2011�G29�F3541-6
���F�ȉ��̕�����Yan ��̌n���I���r���[�̑ΏۂƂȂ��Ă��邽�ߌX�Ɍ������s��Ȃ������D
- Mercadante S. Celiac plexus block versus analgesics in pancreatic cancer pain. Pain 1993�G52�F187-92
- Lillemoe KD, Cameron JL, Kaufman HS, et al. Chemical splanchnicectomy in patients with unresectable pancreatic cancer. A prospective randomized trial. Ann Surg 1993�G217�F447-55
- Kawamata M, Ishitani K, Ishikawa K, et al. Comparison between celiac plexus block and morphine treatment on quality of life in patients with pancreatic cancer pain. Pain 1996�G64�F597-602
- Polati E, Finco G, Gottin L, et al. Prospective randomized double-blind trial of neurolytic coeliac plexus block in patients with pancreatic cancer. Br J Surg 1998�G85�F199-201
- Wong GY, Schroeder DR, Carns PE, et al. Effect of neurolytic celiac plexus block on pain relief, quality of life, and survival in patients with unresectable pancreatic cancer�Fa randomized controlled trial. JAMA 2004�G291�F1092-9
�S
�����̒ɂ�
�� �����̒ɂ݂ɑ���L���Ȏ��Â͉����H
�֘A����Տ��^��
- ►52�����̒ɂ݂̂��邪�҂ɑ��āC�s���ׂ��]���͉����H
- ►53�����̒ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►54�����̒ɂ݂̂��邪�҂ɑ��āC�_�o�u���b�N�́C�Ö@�ɔ�r���Ēɂ݂��ɘa���邩�H
����
- ►52�ɂ݂̌����̕]���ƒɂ݂̕]�����s���B
- ►53�����̒ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���iⅢ-1 ���ʂ����u�Ɏ����̍��Q�Ɓj�B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►54�����̒ɂ݂̂��邪�҂ɑ��āC�_�o�u���b�N���s���B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j
►�Տ��^��52
���
1 �j�ɂ݂̌�����g�̏�����摜��������]������
�ɂ݂̌����Ƃ��āC����ɂ��ɂ݈ȊO�̉\�����܂߂Č�������B�g�̏����C�摜�����i�P��X ���CCT�CMRI�C���V���`�O���t�B�C�����g�Ȃǁj����C�����ƂȂ�a�Ԃ̕]�����s���B���ɐҐ������nj�Q�𗈂��a�ς����邩�ǂ����ɒ��ӂ���B
2 �j�ɂ݂̕]�����s��
�ɂ݂̓��퐶���ւ̉e���C�ɂ݂̃p�^�[���i�����ɂ��ˏo�ɂ��j�C�ɂ݂̋����C�ɂ݂̕��ʁC�ɂ݂̌o�߁C�ɂ݂̐���C�ɂ݂̑������q�ƌy�����q�C���ݍs���Ă��鎡�Â̔����C����сC���X�L���[��̌��ʂƕ���p�ɂ��ĕ]������B���ɑ̐��Ɂi���]�ځC�畆�]�ڂȂǁj���C�����Ɂi�����Z���C�����Ȃǁj���_�o����Q���u�ɂ���]������B
�����u�ɈȊO�̌����i�S�����C�x�ǐ��C�я��v�]�C�������C�C���C�ݏ\��w����ᇂȂǁj���l������ꍇ�ɂ͌����̎��Â���������B
►�Տ��^��53
�����̒ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
�����̒ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa����B
�����̒ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���B
���
�{�Տ��^��Ɋւ��閳�����r�����C�O���r�����͂Ȃ��B
�����̒ɂ݂��܂ނ����u�ɂɑ���WHO ���������u�Ɏ��Ö@�̗L�p���������������̊ώ@�����������iⅡ-3 WHO ���������u�Ɏ��Ö@�̍��Q�Ɓj�B
����
�ȏ���C�����̒ɂ݂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa����ƍl������B���������āC�{�K�C�h���C���ł́C�����̒ɂ݂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s�����Ƃ𐄏�����B
►�Տ��^��54
�����̒ɂ݂̂��邪�҂ɑ��āC�_�o�u���b�N�́C�Ö@�ɔ�r���Ēɂ݂��ɘa���邩�H
����
�����̒ɂ݂̂��邪�҂ɑ��āC�_�o�u���b�N�́C�Ö@�ɔ�r���Ēɂ݂��ɘa����ꍇ������B
�����̒ɂ݂̂��邪�҂ɑ��āC�_�o�u���b�N���s���B
���
�{�Տ��^��Ɋւ��閳�����r�����C�O���r�����͂Ȃ��B�{�M��7 �̊ɘa�P�A�a����5 �̊ɘa�P�A�`�[����ΏۂƂ������{�����ł́C�Љ�ꂽ3,553 ��̊��҂̂���136 ��i3.8���j���_�o�u���b�N���Ă���C�ɂ݁Cperformance status �̉��P���݂��C�����\�オ28 ���ȏ�̊��҂ŁC�����ʂ��F�߂�ꂽ�B���̂���12���������̒ɂ݂Ɋւ�����̂ł������iTei ��j�B
����
�ȏ���C�\���Ȓm���͂Ȃ����C�����̒ɂ݂̂��邪�҂ɑ��āC�_�o�u���b�N�͖Ö@�ɔ�r���Ēɂ݂��ɘa����ꍇ������ƍl������B�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â̌��ʂ��s�\���ȏꍇ�C�ɂ݂������Ɍ��ǂ��Ă���ꍇ�ɂ́C�_�o�u���b�N�Ȃǂɂ���u�Ɋɘa���\�����Ƃɑ��k���邱�Ƃ𐄏�����B
���������_�o�u���b�N�ɂ́C�d���O�u���b�N�C�]�Ԑ_�o�u���b�N�C�_�o���u���b�N��1�C�N�������t�F�m�[���u���b�N��2 �����邪�C�ǂ̃u���b�N���K���Ă��邩�͐��Ƃɑ��k����B��ʓI�ɂ́C�]�Ԑ_�o�u���b�N�C�����g�M�Ìł�1 �_�o�����ɐj�̎h�����K�v�ł��邽�ߌ��ǂ��ꂽ�͈͂̒ɂ݂ɁC�N�������t�F�m�[���u���b�N�́C2-3 �_�o���߂̒ɂ݂ɗp������B�d���O�u���b�N�͕������߂ɂ܂�����ɂ݂ɗp������B
�����̑Ή��Œ��Ɍ��ʂ��s�ǂ̏ꍇ��C���Ɍ��ʂ͓����Ă��Ă����C�Ȃǂ̋��e�ł��Ȃ�����p�������Ă���ꍇ�́C�d���O�E�N�������o���ւ̎����I�s�I�C�h���^�C�Ǐ�������̕��p����������B
������̎�Z�ɂ����Ă��C�u���b�N�j�̎h�����ʂɊ�����������ꍇ�C�o���X������ыÌňُ�C�V���b�N��ԁC���҂̓��ӂ������Ȃ��ꍇ�C�S�g��Ԃ��������������Ă���ꍇ�͋֊��ƂȂ�B���������āC�_�o�u���b�N�̌��ʂ��\���Ɋ��������߂ɂ́C�K�Ȏ{�s�����ɍs�����Ƃ��d�v�ł���C�����̌��ǂ����ɂ݂�i���銳�҂́C�����ɐ��Ƃɑ��k���邱�Ƃ��]�܂����B
��1�F�_�o���u���b�N
�_�o�u���b�N�̈�B�_�o���ɋǏ��������X�e���C�h�𒍓����C���̐_�o�����x�z���Ă���̈�̒ɂ݂��ɘa���鎡�Ö@�B���݂ł͍����g�M�Ìő��u��p�����M�ÌŖ@����ʓI�B
��2�F�N�������t�F�m�[���u���b�N
�_�o�u���b�N�̈�B�N�������o�ɐ_�o�j���̃t�F�m�[���𒍓����鎡�Ö@�B�����A���̏��ɂɗL���B�ʏ�̋Ǐ���������g�p����_�o�u���b�N�����ʂ̎������Ԃ������B
�����̃K�C�h���C���Ƃ̐�����
NCCN �̃K�C�h���C���i2012�j�ł́C���ǂɌ��ǂ����ɂ݂ɑ��čd���O�u���b�N��]�Ԑ_�o�u���b�N���C�̊��ɕ��z���Ă���悤�Ȓɂ݂ɑ��čd���O�܂��̓N�������o�ւ̃I�s�I�C�h�̎������^�𐄏����Ă���B
�i���˂����C��։�q�j
�y�Q�l�����z
Tei Y, Morita T, Nakaho T, et al. Treatment efficacy of neural blockade in specialized palliative care services in Japan�Fa multicenter audit survey. J Pain Symptom Manage 2008�G36�F461-7
�T
��������Ȃǂɂ���A���̒ɂ�
�� ��������Ȃǂɂ���A���̒ɂ����ɑ���L���Ȏ��Â͉����H
�֘A����Տ��^��
- ►55��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC�s���ׂ��]���͉����H
- ►56��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►57��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC�_�o�u���b�N�́C�Ö@�ɔ�r���Ēɂ݂��ɘa���邩�H
����
- ►55�ɂ݂̌����̕]���ƒɂ݂̕]�����s���B
- ►56��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���iⅢ-1 ���ʂ����u�Ɏ����̍��Q�Ɓj�B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►57��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC�T�h���u���b�N�C�㉺���_�o�p�u���b�N�Ȃǂ̐_�o�u���b�N���s���B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j
���F��A���̒ɂ�
���Փ�����̓����m�o�́C����������ł͌����_�o���ۂɔ������ċ��S���ɋ����Ґ��_�o�߂ɓ���B�����O����ł͕������_�o���ۂɍ�����C��2 �����4 �卜�_�o�̐Ґ��_�o�߂ɓ���B��A���̒m�o�́C�A���_�o�iS2-4�j�ȂǑ̐��_�o�̎x�z����B
►�Տ��^��55
��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC�s���ׂ��]���͉����H
����
�ɂ݂̌����̕]���ƒɂ݂̕]�����s���iⅡ-2 �ɂ݂̕�I�]���̍��Q�Ɓj�B
���
1 �j�ɂ݂̌�����g�̏�����摜��������]������
�ɂ݂̌����Ƃ��āC����ɂ��ɂ݈ȊO�̉\�����܂ߕ]������B�Ǐ��̊����C�o���C���Փ��̍��]�ځC��ᇂ̋Ǐ��Ĕ��̗L������������B�����ɉ����āC�R�ۖ�C���ː����ÁC���w�Ö@�Ȃǂ��u�Ɋɘa�ɗL���Ȃ��Ƃ�����B
�_�o�u���b�N���s���ꍇ�ɂ́C�r�A�E�r�@�\���ێ�����Ă��邩�ǂ����ɂ���đI��������@���قȂ邽�߁C���݂Ə����\�������r�A�E�r�@�\��c�����Ă������Ƃ��]�܂����B
2 �j�ɂ݂̕]�����s��
�ɂ݂̓��퐶���ւ̉e���C�ɂ݂̃p�^�[���i�����ɂ��ˏo�ɂ��j�C�ɂ݂̋����C�ɂ݂̕��ʁC�ɂ݂̌o�߁C�ɂ݂̐���C�ɂ݂̑������q�ƌy�����q�C���ݍs���Ă��鎡�Â̔����C����сC���X�L���[��̌��ʂƕ���p�ɂ��ĕ]������B�܂����ɖ�ȊO�̒��Ɏ�i�i�_�o�u���b�N�Ȃǁj�����҂���]���邩�ǂ������m�F����
����ɁC�������q�E�y�����q��]������B���ʂ��Ƃ�Ƒ�������ꍇ�́C�������ʼn��P����ꍇ������B�r�֎��ɑ�������ꍇ�́C���܂ɂ��r�֒����ʼn��P����ꍇ������B������ᇂɑ���}�C���Y�p��̋���啔�ɂ�����ܔM�Ɂiburning pain�j�C�A���f�B�j�A��ُ튴�o���ȂǁC�̐��ɁC�_�o��Q���u�ɂ̗v�f���傫���Ɣ��f�����ꍇ�́C�T�h���u���b�N���L���ȏꍇ������B�������ĉ��܂�ƒɂ݂����シ��ȂǁC�����_�o�̊֗^�̗v�f���傫���Ɣ��f�����ꍇ�́C�㉺���_�o�p�u���b�N�C�s�ΐ_�o�߃u���b�N�̂悤�Ȍ����_�o�u���b�N�̌��ʂ�����ꍇ������B
►�Տ��^��56
��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�ɂ݂��ɘa����B
��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���B
���
�{�Տ��^��Ɋ֘A�����Տ������Ƃ��āC��������Ȃǂɂ���A���̒ɂ݂Ɍ��肵�Ĕ�I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â̌��ʂ��r�����������r�����C�O���r�����͂Ȃ��B��������Ȃǂɂ���A���̒ɂ݂��܂ނ����u�ɂɑ���WHO ���������u�Ɏ��Ö@�̗L�p���������������̊ώ@�����������iⅡ-3 WHO ���������u�Ɏ��Ö@�̍��Q�Ɓj�B
����
�ȏ���C��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�ɂ݂��ɘa����ƍl������B
���������āC�{�K�C�h���C���ł́C��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s�����Ƃ𐄏�����B
►�Տ��^��57
��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC�_�o�u���b�N�́C�Ö@�ɔ�r���Ēɂ݂��ɘa���邩�H
����
��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC�T�h���u���b�N�C�㉺���_�o�p�u���b�N�Ȃǂ̐_�o�u���b�N�́C�ɂ݂��ɘa����B
��������Ȃǂɂ���A���̒ɂ݂̂��銳�҂ɑ��āC�T�h���u���b�N�C�㉺���_�o�p�u���b�N�Ȃǂ̐_�o�u���b�N���s���B
���
1 �j�T�h���u���b�N
�T�h���u���b�N�́C���ʂɂăN�������o�ɍ���d�̃t�F�m�[���O���Z�����𒍓����邱�ƂŁC��4�C5 �向�_�o������_�o���Ւf����A���̒��Ɍ��ʂ�_�o�u���b�N�ł���B�����ǂƂ��āC�N��������Q���N����\���������B
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�������r������O���r�����͂Ȃ����C�����̏Ǘ��L�q�I����������iSlatkin ��C����j�B
����
�ȏ���C���̍����G�r�f���X�͑��݂��Ȃ����C�Տ��o������C��������Ȃǂɂ���A���̒ɂ݂ɑ��āC�T�h���u���b�N�́C�N��������Q�����邪�C�ɂ݂��ɘa����ƍl������B
���������āC�{�K�C�h���C���ł́C��������Ȃǂɂ���A���̒ɂ݂ɑ��āC�A�H�ύX�E�l�H���Ȃǂ��łɔr�A�E�r�@�\���p�₵�Ă���ꍇ�ɁC�T�h���u���b�N���L���ȏꍇ������̂Ő��Ƃɑ��k���邱�Ƃ𐄏�����B�l�H��傪���邪�A�H�ύX���Ȃ���Ă��Ȃ��ꍇ�ɂ́C���҂��A�H�ύX�ɂȂ邱�Ɓi���A�Ȃǁj�𗹉�����C�I���ł���ꍇ������B
2 �j�㉺���_�o�p�u���b�N
�㉺���_�o�p�u���b�N���́C���Փ�����̌����_�o�R���̒ɂ݂ɑ����u�Ɏ��Ö@�ł���B
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�������r�����͂Ȃ����C�O���r������1 ������B
Plancarte ��1�j�̑O���r�����ł́CVAS ��7�`10 �ŁC�I�s�I�C�h�ŏ\���ɒ��Ɍ��ʂ������Ȃ����C�܂��͋��e�ł��Ȃ����C�̂��߃I�s�I�C�h�ʂł��Ȃ����Վ�ᇂ̊���227 ��̂����Ǐ�������̎����I�ȓ��^�Œ��Ɍ��ʂ�����ꂽ159 ��i79���j��ΏۂɁC�㉺���_�o�p�u���b�N���{�s�����B72���̊��҂�3 �T�Ԍ��VAS ��7 �ȏォ��4 �ȉ��ւƒቺ�����B�I�s�I�C�h���^�ʂ͌o�������q�l���Z�ʂŎ��ÑO56 mg/���C���Ì�32 mg/���ƒቺ�����B�c��̊��҂ł�VAS ��4�`7 �ƒ����x�̒ቺ�ɂƂǂ܂������C�I�s�I�C�h���^�ʂ͎��Ì��65 mg/������48 mg/���ƒቺ�����B���C�̋�������18 ��̊��҂̂���16 ��ɂ����āC���C�̋�����0�`3 �̕]����2�i�����Ζ������ŗe�ՂɊo�����Ȃ��j����0�`1�i�����`���ɖ����������e�ՂɊo���j�։��P�����B�r�A�E�r�֍���Ȃǂ̕���p�͏o�����Ȃ������B
����ȊO�ɂ��C����̉�A���̒ɂ݂ɑ��āC�O�q�����T�h���u���b�N�ƂƂ��ɏ㉺���_�o�p�u���b�N�͑I�����̈�ɂȂ肤��Ƃ���L�q�I����������iVissers ��j�B
����
�ȏ���C���̍����G�r�f���X�͑��݂��Ȃ����C��������Ȃǂɂ���A���̒ɂ݂ɑ��āC�㉺���_�o�p�u���b�N�́C�ɂ݂��ɘa����\��������ƍl������B
���������āC�{�K�C�h���C���ł́C��������Ȃǂɂ���A���̒ɂ݂ɑ��āC�㉺���_�o�p�u���b�N���L���ȏꍇ������̂Ő��Ƃɑ��k���邱�Ƃ𐄏�����B
���̑��̐_�o�u���b�N�Ƃ��āC�㉺���_�o�p�u���b�N�Ɠ��������_�o�u���b�N�ł�����啔����̌����_�o�R���̒ɂ݂ɑ���C�s�ΐ_�o�߃u���b�N������BAgarwal-Kozlowski ��ɂ��n���I���r���[�ɂ��ƁC�O���B����8 ��C�����咰����7 ����܂�43 ��̊��҂Ɏ{�s���ꂽ�f�f�I�u���b�N48 ����܂�76 ���CT �K�C�h���̕s�ΐ_�o�߃u���b�N�ɂ���āC�����ǂȂ��L�ӂ�NRS �̒ቺ�Ɠ��@���Ԃ̒Z�k�C4 �J����̉��P���ʂ��������B
����ɁC�d���O�o�܂��̓N�������o�ւ̃I�s�I�C�h��Ǐ�������̎������^���I�����ɂȂ�ꍇ������B���҂ɂǂ̃u���b�N���K���Ă���̂��͐��Ƃɑ��k���邱�Ƃ��]�܂����B
���F�㉺���_�o�p�u���b�N
�_�o�u���b�N�̈�B���Փ�����R���̒ɂ݂ɑ��鎡�Ö@�B�N�������t�F�m�[���u���b�N�ɔ�ׂāC��A���m�o�E�o��r����Q�Ȃǂ����Ȃ��B�Q���B
�����̃K�C�h���C���Ƃ̐�����
NCCN �̃K�C�h���C���i2012�j�ł́C�Ǎݐ��̒������ɂ̏ꍇ�́C�_�o�j���ɂ��T�h���u���b�N�C�㉺���_�o�p�u���b�N�C�I�s�I�C�h�̍d���O�܂��̓N���������^�Ȃǂ���������Ă���B
�i���ËP�j�C��։�q�j
�y�� ���z
1�j Plancarte R, de Leon-Casasola OA, El-Helaly M, et al. Neurolytic superior hypogastric plexus block for chronic pelvic pain associated with cancer. Reg Anesth 1997�G22�F562-8
�y�Q�l�����z
2�j Slatkin NE, Rhiner M. Phenol saddle blocks for intractable pain at end of life�Freport of four cases and literature review. Am J Hosp Palliat Care 2003�G20�F62-6
3�j ���@���j�C���{�x�m�Y�C�X�R�ݏG�C���D�T�h���t�F�m�[���u���b�N�ɂ���ʂ̃I�s�I�C�h���ʂɐ�������2 �Ǘ�i���{�y�C���N���j�b�N�w���35 ����n����^�F��ʉ���Ⅲ�j�D���{�y�C���N���j�b�N�w�2005�G12�F429
4�j Vissers KC, Besse K, Wagemans M, et al. 23. Pain in patients with cancer. Pain Pract 2011�G 11�F453-75
5�j Agarwal-Kozlowski K, Lorke DE, Habermann CR, et al. CT-guided blocks and neuroablation of the ganglion impar�iWalther�jin perineal pain�Fanatomy, technique, safety, and efficacy. Clin J Pain 2009�G25�F570-6
�U
���������؏nj�Q�ɂ��ɂ�
�i�����ւ̂���̐Z���E�]�ڂɔ����ċN����l�a���E��ځE�G�̒ɂ݁j
�� ���������؏nj�Q���ɂ��ɂ݂ɑ���L���Ȏ��Â͉����H
�֘A����Տ��^��
- ►58���������؏nj�Q�ɂ��ɂ݂̂��邪�҂ɑ��āC�s���ׂ��]���͉����H
- ►59���������؏nj�Q�ɂ��ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►60���������؏nj�Q�ɂ��ɂ݂̂��邪�҂ɑ��āC�ؒo�ɖ�́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►61���������؏nj�Q�ɂ��ɂ݂̂��邪�҂ɑ��āC�_�o�u���b�N�́C�Ö@�ɔ�r���Ēɂ݂��ɘa���邩�H
����
- ►58�ɂ݂̌����̕]���ƒɂ݂̕]�����s���B
- ►59���������؏nj�Q�ɂ��ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���iⅢ-1 ���ʂ����u�Ɏ����̍��Q�Ɓj�B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►60���������؏nj�Q�ɂ��ɂ݂̂��銳�҂ɑ��āC�ؒo�ɖ�𓊗^����B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j - ►61���������؏nj�Q�ɂ��ɂ݂̂��銳�҂ɑ��āC�_�o�u���b�N���s���B
2C�i�ア�����C�ƂĂ��Ⴂ�G�r�f���X���x���j
���F���������؏nj�Q
�����ؓ��̈��������̑��݂ɂ��N����l�a���E��ځE�G�̒ɂ݁B�g�̏����Ƃ��āC�����̑�1�`4 ���Ő_�o�̈�̐_�o��Q�C�����̝��k����������Ҋߋ��ȌŒ肪�݂���B�Q���B
►�Տ��^��58
���������؏nj�Q�ɂ��ɂ݂̂��邪�҂ɑ��āC�s���ׂ��]���͉����H
����
�ɂ݂̌����̕]���ƒɂ݂̕]�����s���iⅡ-2 �ɂ݂̕�I�]���̍��Q�Ɓj�B
���
1 �j�ɂ݂̌�����g�̏�����摜��������]������
�ɂ݂̌����Ƃ��āC����ɂ��ɂ݈ȊO�̉\�����܂߂ĕ]������B���������؏nj�Q�ɂ��ɂ݂ł���C�g�̏����Ƃ��āC�����̑�1�`4 ���Ő_�o�̈�̐_�o��Q�C�����̝��k����������Ҋߋ��ȌŒ肪�݂��邱�Ƃ������B�摜�����ł́C���������ؓ��̈�����ᇂ̑��݂��݂���B�K�v�ɉ����āC�O�Ȏ��ÁC���w�Ö@�C���ː����Â̓K���ɂ��Č�������B
�����؏nj�Q����������ȊO�̌����Ƃ��Ē����ؔ^ᇂȂǂ����O����B
2 �j�ɂ݂̕]�����s��
�ɂ݂̓��퐶���ւ̉e���C�ɂ݂̃p�^�[���i�����ɂ��ˏo�ɂ��j�C�ɂ݂̋����C�ɂ݂̕��ʁC�ɂ݂̌o�߁C�ɂ݂̐���C�ɂ݂̑������q�ƌy�����q�C���ݍs���Ă��鎡�Â̔����C����сC���X�L���[��̌��ʂƕ���p�ɂ��ĕ]������B
���ɒɂ݂������ɂȂ̂��ˏo�ɂȂ̂��]�����C�_�o��Q���u�ɂ̗v�f������̂���]������B����ɑ������q�E�y�����q��]������B���������؏nj�Q�ł́C�Ҋ߂�L�W����ƒɂ݂��������C���Ȃ���ƒɂ݂��y�����邱�Ƃ��������߁C�ɂ݂̑�������p���������悤�ɂ����iⅡ-1-1-3 �_�o��Q���u���̍��Q�Ɓj�B
►�Տ��^��59
���������؏nj�Q�ɂ��ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
���������؏nj�Q�ɂ��ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�ɂ݂��ɘa����B
���������؏nj�Q�ɂ��ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�������r������O���r�����͂Ȃ��C�����̌�����������Ǘ�����Ȃ��B
Agar ��CStevens ��ɂ��Ǘ����у��r���[�ł́CWHO ���������u�Ɏ��Ö@�Ɋ�Â�����I�s�I�C�h���ɖ�E�I�s�I�C�h�̓��^�ɉ����āC�R��������i�K�o�y���`���C�o���v���_�i�g���E���C�J���o�}�[�s���j�C�O�n�R����i�A�~�g���v�`�����j�C�f�L�T���^�]���̓��^���L���ł������ǗႪ����Ă���B
����C�����u�ɂɑ���WHO ���������u�Ɏ��Ö@�̗L�p���������������̊ώ@�����������iⅡ-3 WHO ���������u�Ɏ��Ö@�̍��Q�Ɓj�B
����
�ȏ���C���������؏nj�Q�ɂ��ɂ݂ɑ���m���͌����Ă��邪�C��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC���������؏nj�Q�ɂ��ɂ݂��ɘa����ƍl������B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C���������؏nj�Q�ɂ��ɂ݂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s�����Ƃ𐄏�����B
►�Տ��^��60
���������؏nj�Q�ɂ��ɂ݂̂��邪�҂ɑ��āC�ؒo�ɖ�́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
���������؏nj�Q�ɂ��ɂ݂̂��邪�҂ɑ��āC�ؒo�ɖ�́C�ɂ݂��ɘa����\��������B
���������؏nj�Q�ɂ��ɂ݂̂��邪�҂ɑ��āC�ؒo�ɖ�𓊗^����B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�������r������O���r�����͂Ȃ��C�����̌�����������Ǘ�����Ȃ��B
Agar ��CStevens ��ɂ��Ǘ����у��r���[�ł́C�����̝��k�ɔ����Ҋ߂̗L�ɐ����ȌŒ�i�Ҋ߂����Ȉʂɂ��Ă���C�L�W�ʂɂ���ƒɂ݂�i����j�ɑ��ăW�A�[�p���C�o�N���t�F���̓��^���L���ł������ǗႪ����Ă���B
���̑��ɁC���i�̝��k�ɑ��鎡�Ö�Ƃ��āC�`�U�j�W���C�_���g�������i�g���E�����L�ڂ���Ă���B
����
�ȏ���C�\���Ȓm���ł͂Ȃ����C���������؏nj�Q�ɂ��ɂ݂̂��銳�҂ɑ��āC�ؒo�ɖ�́C�ɂ݂��ɘa����\��������ƍl������B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C���������؏nj�Q�ɂ��ɂ݂̂��銳�҂ɑ��āC���ɒ����̝��k�ɔ����Ҋ߂̗L�ɐ����ȌŒ肪�F�߂�ꂽ�ꍇ�ɋؒo�ɖ�𓊗^���邱�Ƃ𐄏�����B
�ؒo�ɖ�Ƃ��āC�ł���ʓI�Ɏg�p�������̂̓W�A�[�p���ł���B�W�A�[�p���̌��ʂ��s�\���ȏꍇ�́C���Ƃɑ��k�̂����C�o�N���t�F���C�`�U�j�W���C�܂��̓_���g�������i�g���E������������B
►�Տ��^��61
���������؏nj�Q�ɂ��ɂ݂̂��銳�҂ɑ��āC�_�o�u���b�N�́C�Ö@�ɔ�r���Ēɂ݂��ɘa���邩�H
����
���������؏nj�Q�ɂ��ɂ݂̂��銳�҂ɑ��āC�_�o�u���b�N�́C�Ö@�ɔ�r���Ēɂ݂��ɘa����\��������B
���������؏nj�Q�ɂ��ɂ݂̂��銳�҂ɑ��āC�_�o�u���b�N���s���B
���
�{�Տ��^��Ɋւ���Տ������Ƃ��ẮC�������r������O���r�����͂Ȃ��C�����̌�����������Ǘ�����Ȃ��B
Agar ��CStevens ��ɂ��Ǘ����у��r���[�ł́C�����d���O�u���b�N�C���_�o�p�u���b�N�i�����؏���ւ̋Ǐ�������E�_�o�j����j���L���ł������ǗႪ����Ă���B�������C�Ö@�Ƃ̔�r�͍s���Ă��Ȃ��B
����
�ȏ���C�m���Ȓm���ł͂Ȃ����C���������؏nj�Q�ɂ��ɂ݂̂��銳�҂ɑ��āC�_�o�u���b�N�́C�ɂ݂��ɘa����\��������ƍl����B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂƂ��āC���������؏nj�Q�ɂ��ɂ݂̂��銳�҂ɑ��āC�_�o�u���b�N�ɂ���u�Ɏ��Â��\���C���Ƃɑ��k���邱�Ƃ𐄏�����B�_�o�u���b�N�Ƃ��ẮC�d���O���ɖ@�C�N���������ɖ@�C���_�o�p�u���b�N�C�_�o���u���b�N������B
�����̃K�C�h���C���Ƃ̐�����
�����̃K�C�h���C���ł́C���������؏nj�Q�ɂ��ɂ݂ɑ���L�q�݂͂��Ȃ��B
�i���c�z��C�r�i���V�j
�y�Q�l�����z
1�j Agar M, Broadbent A, Chye R. The management of malignant psoas syndrome�Fcase reports and literature review. J Pain Symptom Manage 2004�G28�F282-93
2�j Ampil FL, Lall C, Datta R. Palliative management of metastatic tumors involving the psoas muscle�Fcase reports and review of the literature. Am J Clin Oncol 2001�G24�F313-4
3�j Stevens MJ, Atkinson C, Broadbent AM. The malignant psoas syndrome revisited�Fcase report, mechanisms, and current therapeutic options. J Palliat Med 2010�G13�F211-6
�V
�����Ǖǂɂ��ɂ�
�� �����Ǖǂɂ��ɂ݂ɑ���L���Ȏ��Â͉����H
�֘A����Տ��^��
- ►62�����Ǖǂɂ��ɂ݂̂��邪�҂ɑ��āC�s���ׂ��]���͉����H
- ►63�����Ǖǂɂ��ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►64�����Ǖǂɂ��ɂ݂̂��邪�҂ɑ��āC�����Ǖ���}����i�I�N�g���I�`�h�|�_���C�u�`���X�R�|���~���L�����j�́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
- ►65�����Ǖǂɂ��ɂ݂̂��邪�҂ɑ��āC�R���`�R�X�e���C�h�́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
- ►62�ɂ݂̌����̕]���ƒɂ݂̕]�����s���B
- ►63�����Ǖǂɂ��ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���iⅢ-1 ���ʂ����u�Ɏ����̍��Q�Ɓj�B
1B�i���������C�Ⴂ�G�r�f���X���x���j - ►64�����Ǖǂɂ��ɂ݂̂��銳�҂ɑ��āC�I�N�g���I�`�h�|�_���܂��̓u�`���X�R�|���~���L�����̂����ꂩ���g�p����B
2B�i�ア�����C�Ⴂ�G�r�f���X���x���j - ►65�����Ǖǂɂ��ɂ݂̂��銳�҂ɑ��āC�R���`�R�X�e���C�h���g�p����B
2B�i�ア�����C�Ⴂ�G�r�f���X���x���j
►�Տ��^��62
�����Ǖǂɂ��ɂ݂̂��邪�҂ɑ��āC�s���ׂ��]���͉����H
����
�ɂ݂̌����̕]���ƒɂ݂̕]�����s���iⅡ-2 �ɂ݂̕�I�]���̍��Q�Ɓj�B
���
1 �j�ɂ݂̌�����g�̏�����摜��������]������
�ɂ݂̌����Ƃ��āC����ɂ��ɂ݈ȊO�̉\�����܂߂ĕ]������B�a���E�g�̏����E�����P��X ���E���������g�����Ȃǂ���C�����Ǖǂ̊O�Ȏ��ÓK���ɂ��Č�������B�֔�C�����C���ǂ̊g���ȂǁC�ɂ݂Ɋ֘A���鎡�É\�ȑ��̗v�������邩�ɂ��ĕ]�����s���C���ꂼ��C�r�փR���g���[���C�����̃R���g���[���C���ǂ̌����Ȃǂ���������B
2 �j�ɂ݂̕]�����s��
�ɂ݂̓��퐶���ւ̉e���C�ɂ݂̃p�^�[���i�����ɂ��ˏo�ɂ��j�C�ɂ݂̋����C�ɂ݂̕��ʁC�ɂ݂̌o�߁C�ɂ݂̐���C�ɂ݂̑������q�ƌy�����q�C���ݍs���Ă��鎡�Â̔����C����сC���X�L���[��̌��ʂƕ���p�ɂ��ĕ]������B���ɁC�����ɂ��ˏo�ɂ��i�����ǂ�従��ɂ��ˏo�ɂ����邩�j�C�������q�E�y�����q�i�H����r�ւ��e�����Ă��邩�j�C�s���Ă��鎡�Â̌��ʂ╛��p�ɂ��ĕ]������B
►�Տ��^��63
�����Ǖǂɂ��ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
�����Ǖǂɂ��ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ����Ɏ��Â͒ɂ݂��ɘa����B
�����Ǖǂɂ��ɂ݂̂��邪�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s���B
���
�����Ǖǂɂ��ɂ݂Ɍ��肵���Տ������͌����Ă���B�������C�����Ǖǂɂ��ɂ݂��܂ނ����u�ɂɑ���WHO ���������u�Ɏ��Ö@���L�p���������������̊ώ@�����������iⅡ-3 WHO ���������u�Ɏ��Ö@�̍��Q�Ɓj�B
����
�ȏ���C�����Ǖǂɂ��ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��ẤC�ɂ݂��ɘa����ƍl������B
���������āC�{�K�C�h���C���ł́C�����Ǖǂɂ��ɂ݂̂��銳�҂ɑ��āC��I�s�I�C�h���ɖ�E�I�s�I�C�h�ɂ���u�Ɏ��Â��s�����Ƃ𐄏�����B
►�Տ��^��64
�����Ǖǂɂ��ɂ݂̂��邪�҂ɑ��āC�����Ǖ���}����i�I�N�g���I�`�h�|�_���C�u�`���X�R�|���~���L�����j�́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
�����Ǖǂɂ��ɂ݂̂��邪�҂ɑ��āC�����Ǖ���}����i�I�N�g���I�`�h�|�_���C�u�`���X�R�|���~���L�����j�́C�ɂ݂��ɘa����\��������B
�����Ǖǂɂ��ɂ݂̂��邪�҂ɑ��āC�I�N�g���I�`�h�|�_���܂��̓u�`���X�R�|���~���L�����̂����ꂩ���g�p����B
���
�{�Տ��^��Ɋ֘A����Տ������Ƃ��Ă͖������r������3 ������B������̌������I�N�g���I�`�h�|�_���ƃu�`���X�R�|���~���L�����̌��ʂ��r�������̂ł���C�I�s�I�C�h�̒P�Ǝ��ÂƁC�����Ǖ���}����ƃI�s�I�C�h�Ƃ̕��p���Â̌��ʂ��r�������̂ł͂Ȃ��B
Mystakidou ��1�j�ɂ��C�O�Ȏ��Õs�\�̂���ɂ������Ǖǂ̂��銳��68 ���ΏۂɁC�ɂ݂��܂ޕ����Ǐ�ɑ���u�`���X�R�|���~���L����60�`80 mg/���ƃI�N�g���I�`�h�|�_��0.6�`0.8 mg/���̌��ʂ��r�����������r�����ł́C��������ɂ݂�VAS�i0�`10�j��3 ����ɉ��P���C���Q�ɗL�Ӎ��͂Ȃ������i5.4��1.3 vs 5.1��1.1�Cp��0.05�j�B���Q�Ƃ��I�s�I�C�h��N�����v���}�W���Ȃǂ����p����Ă����B�d�Ăȕ���p�͂Ȃ������B
Ripamonti ��2�j�ɂ��C�O�Ȏ��Õs�\�̈݊ǂ��}�����ꂽ����ɂ������Ǖǂ̂��銳��17 ���ΏۂɁC�����ɁE従��ɂ��܂ޕ����Ǐ�ɑ���u�`���X�R�|���~���L����60 mg/���ƃI�N�g���I�`�h�|�_��0.3 mg/���̌��ʂ��r�����������r�����ł́C��������ɂ݂�VRS�i4 �i�K�j��3 ����ɉ��P���i�����ɁF1.4��0.4 vs 1.4��0.3�Cp��0.05�G従��ɁF0.9��0.1 vs 0.7��0.1�Cp��0.05�j�C���Q�ɗL�Ӎ��͂Ȃ������B����p�ɂ��ċL�ڂ��Ȃ��B
Mercadante ��3�j�ɂ��C�O�Ȏ��Õs�\�̂���ɂ������ǕNJ���18 ���ΏۂɁC�����ɁE従��ɂ��܂ޕ����Ǐ�ɑ���u�`���X�R�|���~���L����60 mg/���ƃI�N�g���I�`�h�|�_��0.3 mg/���̌��ʂ��r�����������r�����ł́C��������C�ɂ݂�VRS �l�i4 �i�K�j��2 ����ɂ����P�X���ł���i�����ɁF1.8��1.2 vs 0.6��0.3�G従��ɁF0.4��0.2 vs 0.4��0.1�Cp��0.05�j�C���Q�ɗL�Ӎ��͂Ȃ������B���Ҏ��S����уf�[�^�����ɂ��E���ǗႪ17���������B����p�ɂ��Ă͋L�ڂ��Ȃ��B
����
�ȏ���C�ɂ݂�]�����ڂƂ����v���Z�{�Ƃ̔�r�ɂ�閳�����r�������Ȃ����ߏ\���ȍ����ł͂Ȃ����̂́C�����Ǖǂɂ��ɂ݂̂��銳�҂ɑ��āC�����Ǖ���}����i�I�N�g���I�`�h�|�_���C�u�`���X�R�|���~���L�����j�́C�ɂ݂��ɘa����\��������ƍl������B
���������āC�{�K�C�h���C���ł́C���Ƃ̍��ӂɂ��C���Ɍ��ʂ����҂���C�d�Ăȕ���p�����Ȃ��Ƃ������R�ŁC�����Ǖǂ̒ɂ݂ɑ��āC�I�N�g���I�`�h�|�_���܂��̓u�`���X�R�|���~���L�����̂����ꂩ���g�p���邱�Ƃ𐄏�����B
���ɁC従��ɂɑ��ẮC�R�R������p�̋����u�`���X�R�|���~���L�����̎g�p����������B
►�Տ��^��65
�����Ǖǂɂ��ɂ݂̂��邪�҂ɑ��āC�R���`�R�X�e���C�h�́C�v���Z�{�ɔ�r���Ēɂ݂��ɘa���邩�H
����
�����Ǖǂɂ��ɂ݂̂��銳�҂ɑ��āC�R���`�R�X�e���C�h�́C�ɂ݂��ɘa����\��������B
�����Ǖǂɂ��ɂ݂̂��銳�҂ɑ��āC�R���`�R�X�e���C�h���g�p����B
���
�{�Տ��^��Ɋ֘A����Տ������Ƃ��āC1 ���̌n���I���r���[������B
Feuer ��4�j�̌n���I���r���[�ł́C����ɂ������Ǖǂ̂��銳�҂�ΏۂɁC�R���`�R�X�e���C�h�ƃv���Z�{�̌��ʂ��r����2 ���̖������r���������������B�Ώۊ��҂�97 ��ł���C�����Ǖǂ̍ĊJ�ʁi�q�f��従��ɂȂǂ̏Ǐ�̏����C�y�H�̐ێ悪�\�C�r�K�X���邢��従��̑��݂ƒ�`�j��NNT ��6 �ł���C�R���`�R�X�e���C�h�͏����Ǖǂ̏Ǐ�ɘa�ɗL�p�ȉ\�������������ƌ��_���Ă���B�����̌����͒��ځC���ɂɑ�����ʂ�]���������̂ł͂Ȃ����̂́C�ĊJ�ʂ̌��ʂƂ��ĕ��ɂ̉��P��������\��������B
Hardy ��5�j�ɂ��C����ɂ������ǕNJ���39 ���ΏۂɁC�f�L�T���^�]��16 mg/���ƃv���Z�{�̌��ʂ��r�����������r�����ł́C�f�L�T���^�]���Q�ŏ����Ǖǂ̍ĊJ�ʂ������F�߂���X���ł������i62�� vs 57���j�B����p��1 �Ⴊ�ݒ���Q�Ŏ������~�C����������͂̕s���������������C�d�Ăȕ���p�͂Ȃ������B
Laval ��6�j�ɂ��C����ɂ������ǕNJ���58 ���ΏۂɁC���`���v���h�j�]����40 mg/���@�Ö������^�i�܂���240 mg �o�����^�j�ƃv���Z�{�̌��ʂ��r�����������r�����ł́C���`���v���h�j�]�����Q�ŏ����Ǖǂ̍ĊJ�ʂ������F�߂�ꂽ�i59�� vs 33���Cp��0.080�j�B����p�͂Ȃ������B
����
�ȏ���C�����Ǖǂɂ��ɂ݂̂��銳�҂ɑ��āC�R���`�R�X�e���C�h�́C�ɂ݂��ɘa����\��������ƍl������B
���������āC�{�K�C�h���C���ł́C��L�̒m���Ɛ��Ƃ̍��ӂɂ��C�����Ǖǂɂ��ɂ݂̂��銳�҂ɑ��āC�R���`�R�X�e���C�h�𓊗^���邱�Ƃ𐄏�����B
�����̃K�C�h���C���Ƃ̐�����
EAPC �̃K�C�h���C���i2012�j�ł́C�����Ǖǂ̒ɂ݂Ɋւ���L�ڂ͂Ȃ��B
EAPC �̏����Ǖǂɂ��ẴK�C�h���C���i2001�j�ł́C������ᇂɂ������Ǖǂɔ��������ɂ����従��ɂ́CWHO ���������u�Ɏ��Ö@�ɏ]�����I�s�I�C�h���^�C�����Ǖ���}����𓊗^���C�I�s�I�C�h���^�ɂ��c������従��ɂɑ��Ă̓u�`���X�R�|���~���L�����Ȃǂ̍R�R������p��𐄏����Ă���B�R���`�R�X�e���C�h�̗L�p���ɂ��ẮC�܂����_���o�Ă��炸�C�ɂ݂Ɍ��肷��L�ڂł͂Ȃ����C���f���ʂ���ю�ᇂ�_�o���͂̕�������P���邱�ƂŏǏ�ɘa�ɗL�p�ȉ\��������Ƃ��Ă���B
NCCN �̃K�C�h���C���i2012�j�ł́C�����Ǖǂ̌�����]�����C�ɘa��p�C���ː����ÁC���w�Ö@�̉\�����l������B�Ǐ�ɘa�Ƃ��Ă͏����ǂ̈��ÁC�o�@�݊ǂ��ᑂɂ��h���i�[�W�C�X�e���C�h�@����/�܂��́@�I�N�g���I�`�h�|�_������������Ă���B
�i�v�i�M�V�C�u�^�וv�j
�y�� ���z
�Տ��^��64
1�j Mystakidou K, Tsilika E, Kalaidopoulou O, et al. Comparison of octreotide administration vs conservative treatment in the management of inoperable bowel obstruction in patients with far advanced cancer�Fa randomized, double-blind, controlled clinical trial. Anticancer Res 2002�G22�i2B�j�F1187-92
2�j Ripamonti C, Mercadante S, Groff L, et al. Role of octreotide, scopolamine butylbromide, and hydration in symptom control of patients with inoperable bowel obstruction and nasogastric tubes�Fa prospective randomized trial. J Pain Symptom Manage 2000�G19�F23-34
3�j Mercadante S, Ripamonti C, Casuccio A, et al. Comparison of octreotide and hyoscine butylbromide in controlling gastrointestinal symptoms due to malignant inoperable bowel obstruction. Support Care Cancer 2000�G8�F188-91
�Տ��^��65
4�j Feuer DJ, Broadley KE. Corticosteroids for the resolution of malignant bowel obstruction in advanced gynaecological and gastrointestinal cancer. Cochrane Database Syst Rev 2000�i2�j�FCD001219
5�j Hardy J, Ling J, Mansi J, Isaacs R, et al. Pitfalls in placebo-controlled trials in palliative care�Fdexamethasone for the palliation of malignant bowel obstruction. Palliat Med 1998�G12�F437-42
6�j Laval G, Girardier J, Lassaunière JM, et al. The use of steroids in the management of inoperable intestinal obstruction in terminal cancer patients�Fdo they remove the obstruction? Pal-liat Med 2000�G14�F3-10
�y�Q�l�����z
�Տ��^��65
7�j Ripamonti C, Twycross R, Baines M, et al�GWorking Group of the EAPC. Clinical-practice recommendations for the management of bowel obstruction in patiens with end stage cancer. Support Care Cancer 2001�G9�F223-33